解题方法
1 . 某种常见补铁药物的主要成分为琥珀酸亚铁。该药品不溶于水但能溶于常见稀酸。某学习小组同学分别设计实验检验药片中Fe2+的存在并测定Fe2+的含量(假设杂质不参与反应)。回答下列问题:
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是_______ (填编号)。
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为_______ 。
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为_______ 。
②步骤三中,加入H2O2溶液发生反应的离子方程式为_______ ,灼烧后 所得固体的颜色为 _______ ,灼烧时需要使用下列仪器中的 _______ (填编号)。
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是_______ 。
④由实验数据计算,每片药片中约含Fe2+_______ mg。
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的_______ (选填“氧化性”、“ 还原性”或“碱性”。)
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为
②步骤三中,加入H2O2溶液发生反应的离子方程式为
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是
④由实验数据计算,每片药片中约含Fe2+
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的
您最近一年使用:0次
名校
2 . 已知Mg与稀HNO3反应的化学方程式如下(未配平):Mg+HNO3(稀)——Mg(NO3) 2+NO↑+H2O
(1)请配平上述化学方程式,并用单线桥表示电子转移的方向和数目 ___________ 。
(2)该反应中,氧化剂和还原剂的物质的量之比为___________ 。
(3)硝酸在该反应中,表现的性质有___________ 。
A 氧化性 B 还原性 C 酸性 D 碱性
(4)当转移1.806×1023个电子时,生成的NO气体在标况下的体积为___________ L。
(5)写出该反应配平后的离子方程式___________ 。
(1)请配平上述化学方程式,
(2)该反应中,氧化剂和还原剂的物质的量之比为
(3)硝酸在该反应中,表现的性质有
A 氧化性 B 还原性 C 酸性 D 碱性
(4)当转移1.806×1023个电子时,生成的NO气体在标况下的体积为
(5)写出该反应配平后的离子方程式
您最近一年使用:0次
3 . 下表是元素周期表中的一部分。

根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是______ ,氧化性最强的单质是____ ,还原性最强的单质是_____ 。
(2)最高价氧化物对应的水化物中,碱性最强的是___________ ,酸性最强的是___________ ,呈两性的是_______________ 。
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是______________ 。
(4)在B、C、D、G、I中,原子半径最大的是______________________ 。
(5)元素C与I形成的化合物的电子式是________________________ 。

根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是
(2)最高价氧化物对应的水化物中,碱性最强的是
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是
(4)在B、C、D、G、I中,原子半径最大的是
(5)元素C与I形成的化合物的电子式是
您最近一年使用:0次
2016-12-09更新
|
192次组卷
|
2卷引用:2014-2015学年四川省乐山市五通桥中学高一下化学试卷
名校
4 . 公元前9世纪,二氧化硫就被用于消毒和漂白。实验室可用图1所示装置(部分夹持仪器略去)制取SO2并验证其性质。
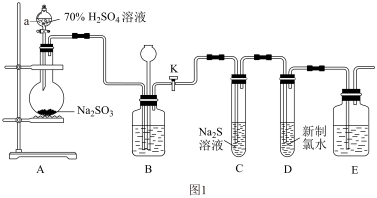
(1)装置a的名称为____ ,A中反应的化学方程式为____ ,硫酸在反应中体现了____ 性。
(2)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有____ “还原性”、“氧化性”或“漂白性”)。
(3)实验结束时,关闭止水夹K,装置B所起的作用是____ 。
(4)取少量试管D中的溶液,加入BaCl2溶液,产生白色沉淀。
①该白色沉淀为____ (写化学式)。
②原试管D中反应的化学方程式为____ 。
(5)用图2所示装置验证H2SO3酸性比H2CO3强。
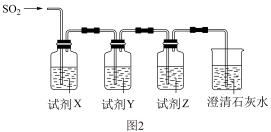
请从下列试剂中选择合适试剂以完成实验(要求:试剂不重复,填代号):
a.品红溶液 b.酸性KMnO4溶液 c.饱和NaHCO3溶液 d.饱和NaHSO3溶液
X为____ ,Y为____ ,Z为____ 。

(1)装置a的名称为
(2)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有
(3)实验结束时,关闭止水夹K,装置B所起的作用是
(4)取少量试管D中的溶液,加入BaCl2溶液,产生白色沉淀。
①该白色沉淀为
②原试管D中反应的化学方程式为
(5)用图2所示装置验证H2SO3酸性比H2CO3强。

请从下列试剂中选择合适试剂以完成实验(要求:试剂不重复,填代号):
a.品红溶液 b.酸性KMnO4溶液 c.饱和NaHCO3溶液 d.饱和NaHSO3溶液
X为
您最近一年使用:0次
5 . 硒(Se)在人体中具有抗氧化和结合重金属的作用,科学补硒可以减少疾病的发生。工业上从硒化亚铜中提取Se涉及到的其中一步反应为: ,下列说法错误的是
,下列说法错误的是
 ,下列说法错误的是
,下列说法错误的是| A.该反应中浓硫酸体现的性质既有氧化性,也有酸性 |
B.该反应体现出还原性强弱为: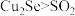 |
C.标准状况下,该反应每生成44.8 L的 气体,转移的电子数为4 NA 气体,转移的电子数为4 NA |
D.该反应的还原产物只有 ,氧化产物只有 ,氧化产物只有 |
您最近一年使用:0次
2021-12-24更新
|
573次组卷
|
4卷引用:四川省峨眉第二中学校2021-2022学年高一下学期3月月考化学试题
名校
解题方法
6 . 下列各项中,理由、结论及因果关系均正确的是
| 选项 | 理 由 | 结 论 |
| A | 键能: 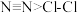 | 单质沸点:N2>Cl2 |
| B | 分子中可电离的H+个数: | 酸性: |
| C | 元素的非金属性:N>P | 酸性: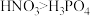 |
| D | 氧化性:Fe3+>Cu2+ | 还原性:Fe2+>Cu |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 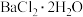 为无色结晶,有毒;水中的溶解度为35.7g(20℃)、58.7g(100℃)。实验室用毒重石(主要含
为无色结晶,有毒;水中的溶解度为35.7g(20℃)、58.7g(100℃)。实验室用毒重石(主要含 ,及少量
,及少量 、
、 、
、 等杂质)经过加工处理,可制得
等杂质)经过加工处理,可制得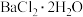 晶体。其实验步骤如下:
晶体。其实验步骤如下:
I.样品分解:称取a g毒重石矿粉于烧杯中,加入稍过量的 溶液,90℃下加热搅拌2h,待充分反应后,冷却,过滤。
溶液,90℃下加热搅拌2h,待充分反应后,冷却,过滤。
II.除 :向滤液中加入一定量的BaS溶液,有黑色沉淀生成,过滤。
:向滤液中加入一定量的BaS溶液,有黑色沉淀生成,过滤。
III.结晶:将步骤II的 滤液经过___________,___________,抽滤,用冷水和乙醇各洗涤晶体2~3次,自然晾干。
滤液经过___________,___________,抽滤,用冷水和乙醇各洗涤晶体2~3次,自然晾干。
回答下列问题:
(1)步骤I中,观察到的实验现象有___________ 。
(2)步骤II检验 是否完全沉淀的方法是
是否完全沉淀的方法是___________ ;在过滤中,下列仪器必需用到的是___________ (填仪器名称),与普通过滤相比,步骤III抽滤的优点是___________ 。___________ ,___________ ,抽滤”。
(4)样品分解时,不选用酸性更强且等量的盐酸溶液替代 溶液,可能的原因是
溶液,可能的原因是___________ 。
(5)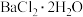 纯度的测定
纯度的测定
某学生查阅资料: ,X代表
,X代表 ,
, 、
、 等,
等, 代表
代表 的阴离子,设计如下纯度测量方案:
的阴离子,设计如下纯度测量方案:
步骤I.准确称取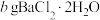 粗品并用20.0mL水溶解。
粗品并用20.0mL水溶解。
步骤II.用 的
的 标准溶液滴定其中的
标准溶液滴定其中的
步骤III.重复滴定2~3次,记录每次消耗 标准溶液的体积
标准溶液的体积
①滴定时采用下图所示的侧边自动定零位滴定管,结合该装置的使用说明书分析其优点___________ 。 含量的测定值偏高的是
含量的测定值偏高的是___________ (填序号)。
a.未干燥锥形瓶 b. 标准溶液久置部分失效
标准溶液久置部分失效
c.滴定终点时滴定管尖嘴中产生气泡 d.杂质可与 反应
反应
 为无色结晶,有毒;水中的溶解度为35.7g(20℃)、58.7g(100℃)。实验室用毒重石(主要含
为无色结晶,有毒;水中的溶解度为35.7g(20℃)、58.7g(100℃)。实验室用毒重石(主要含 ,及少量
,及少量 、
、 、
、 等杂质)经过加工处理,可制得
等杂质)经过加工处理,可制得 晶体。其实验步骤如下:
晶体。其实验步骤如下:I.样品分解:称取a g毒重石矿粉于烧杯中,加入稍过量的
 溶液,90℃下加热搅拌2h,待充分反应后,冷却,过滤。
溶液,90℃下加热搅拌2h,待充分反应后,冷却,过滤。II.除
 :向滤液中加入一定量的BaS溶液,有黑色沉淀生成,过滤。
:向滤液中加入一定量的BaS溶液,有黑色沉淀生成,过滤。III.结晶:将步骤II的
 滤液经过___________,___________,抽滤,用冷水和乙醇各洗涤晶体2~3次,自然晾干。
滤液经过___________,___________,抽滤,用冷水和乙醇各洗涤晶体2~3次,自然晾干。回答下列问题:
(1)步骤I中,观察到的实验现象有
(2)步骤II检验
 是否完全沉淀的方法是
是否完全沉淀的方法是
(4)样品分解时,不选用酸性更强且等量的盐酸溶液替代
 溶液,可能的原因是
溶液,可能的原因是(5)
 纯度的测定
纯度的测定某学生查阅资料:
 ,X代表
,X代表 ,
, 、
、 等,
等, 代表
代表 的阴离子,设计如下纯度测量方案:
的阴离子,设计如下纯度测量方案:步骤I.准确称取
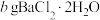 粗品并用20.0mL水溶解。
粗品并用20.0mL水溶解。步骤II.用
 的
的 标准溶液滴定其中的
标准溶液滴定其中的
步骤III.重复滴定2~3次,记录每次消耗
 标准溶液的体积
标准溶液的体积①滴定时采用下图所示的侧边自动定零位滴定管,结合该装置的使用说明书分析其优点
 含量的测定值偏高的是
含量的测定值偏高的是a.未干燥锥形瓶 b.
 标准溶液久置部分失效
标准溶液久置部分失效c.滴定终点时滴定管尖嘴中产生气泡 d.杂质可与
 反应
反应
您最近一年使用:0次
2024-03-29更新
|
243次组卷
|
3卷引用:四川省乐山市2024届高三第二次调查研究考试理科综合-化学试题
四川省乐山市2024届高三第二次调查研究考试理科综合-化学试题2024届四川省雅安市、遂宁市、眉山市高三第二次诊断性考试理科综合试题-高中化学(已下线)湖南省长沙市第一中学2023-2024学年高三下学期三模化学试题
名校
8 . 乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得知,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定。该组同学设计了滴定的方法测定x值。
①称取1.260g纯草酸晶体,将其酸制成100.00mL水溶液为待测液。
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00mL;
请回答:
(1)将草酸晶体配制成一定物质的量浓度的溶液时,必须用到的玻璃仪器是烧杯、玻璃棒、______ 、______ 。
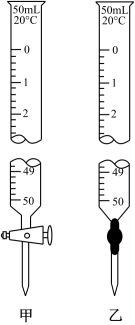
(2)滴定时,将KMnO4标准液装在图中的______ (填“甲”或“乙”)滴定管中。
(3)请写出滴定终点的判断方法:______ 。
(4)写出滴定过程中反应的离子方程式:______ ,x值=______ 。
(5)欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L−1HCl标准溶液进行中和滴定(用酚酞作指示剂)。下列哪些操作会使测定结果偏高______ (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端无气泡,滴定后有气泡
D.滴定前读数正确,滴定后仰视滴定管读数
①称取1.260g纯草酸晶体,将其酸制成100.00mL水溶液为待测液。
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00mL;
请回答:
(1)将草酸晶体配制成一定物质的量浓度的溶液时,必须用到的玻璃仪器是烧杯、玻璃棒、
(2)滴定时,将KMnO4标准液装在图中的

(3)请写出滴定终点的判断方法:
(4)写出滴定过程中反应的离子方程式:
(5)欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L−1HCl标准溶液进行中和滴定(用酚酞作指示剂)。下列哪些操作会使测定结果偏高
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端无气泡,滴定后有气泡
D.滴定前读数正确,滴定后仰视滴定管读数
您最近一年使用:0次
9 . 某研究性学习小组的同学通过查阅资料获得两个信息:一是在CaO存在的条件下,干燥的NaOH与干燥的CH3COONa混合加热可得到CH4;二是在加热条件下CH4可还原CuO。他们设计如下装置(加热仪器省略)制备CH4、还原CuO并验证B中有CO2、H2O生成。
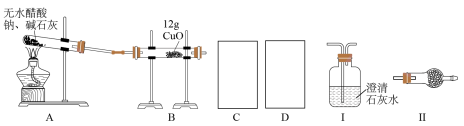
(1)为实现上述实验目的,C、D中的仪器应分别为_______________ (填"Ⅰ、Ⅱ"或"Ⅱ、Ⅰ"),Ⅱ中的试剂是________________ 。
(2)A、B处均需要加热,实验中应先加热______ 处,表明B中有CO2生成的现象是_________ 。A中另一种生成物是常见的无机盐,A中反应的化学方程式为_________ 。
(3)实验表明,即使实验操作、使用试剂完全符合规范实验的要求,制备过程中试管仍会出现破裂情况,试分析其原因:________________ 。
(4)实验结束后,B中固体全部变成红色,甲同学通过查阅资料后认为,该固体可能是铜、氧化亚铜或者是二者的混合物,同时查得Cu2O在酸性条件下可转化为Cu、Cu2+。为确定红色固体的成分,他设计了如下两种方法。
①取少量红色固体于试管中,再向试管中加入足量的稀硫酸,判断含有Cu2O的现象是________ ,在常用的酸中,稀硫酸能不能换成稀硝酸_________ (填“能”或“不能"),原因是_________ 。
②称量所得红色固体的质量,当固体质量(m)介于___________ 之间表明红色固体是Cu与Cu2O的混合物。

(1)为实现上述实验目的,C、D中的仪器应分别为
(2)A、B处均需要加热,实验中应先加热
(3)实验表明,即使实验操作、使用试剂完全符合规范实验的要求,制备过程中试管仍会出现破裂情况,试分析其原因:
(4)实验结束后,B中固体全部变成红色,甲同学通过查阅资料后认为,该固体可能是铜、氧化亚铜或者是二者的混合物,同时查得Cu2O在酸性条件下可转化为Cu、Cu2+。为确定红色固体的成分,他设计了如下两种方法。
①取少量红色固体于试管中,再向试管中加入足量的稀硫酸,判断含有Cu2O的现象是
②称量所得红色固体的质量,当固体质量(m)介于
您最近一年使用:0次
名校
10 . 我国科学家被遴选为“全球青年化学家元素周期表硫元素代言人”。某小组同学利用反应:S+2H2SO4(浓) 3SO2↑+2H2O,进行如图所示的含硫物质的转化实验(夹持装置略)。下列说法正确的是
3SO2↑+2H2O,进行如图所示的含硫物质的转化实验(夹持装置略)。下列说法正确的是
 3SO2↑+2H2O,进行如图所示的含硫物质的转化实验(夹持装置略)。下列说法正确的是
3SO2↑+2H2O,进行如图所示的含硫物质的转化实验(夹持装置略)。下列说法正确的是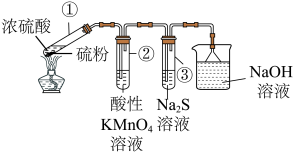
| A.试管①中,浓硫酸体现了强氧化性和脱水性 |
| B.试管②中,溶液褪色,体现+4价硫元素的氧化性 |
| C.试管③中,有淡黄色沉淀出现,体现-2价硫元素的还原性 |
| D.烧杯中的反应为SO3+2NaOH=Na2SO4+H2O |
您最近一年使用:0次
2023-03-08更新
|
2496次组卷
|
17卷引用:四川省乐山沫若中学2022-2023学年高一下学期3月月考化学试题
四川省乐山沫若中学2022-2023学年高一下学期3月月考化学试题广东省2023年第一次高中学业水平测试化学试题广东省阳山县南阳中学2022-2023学年高一下学期第一次月考化学试题湖南省常德市汉寿县第一中学2022-2023学年高二下学期第一次月考化学试题云南省玉溪第一中学2022-2023学年高一下学期第一次月考化学试题 云南省昆明市官渡区第三中学2022-2023学年高一下学期期中考试化学试题广西防城港市实验高级中学2022-2023学年高一下学期期中考试化学试题云南省下关第一中学2022-2023学年高二下学期5月期中考试化学试题广东省梅州市2022-2023学年高一下学期7月期末考试化学试题(已下线)2023年广东卷高考真题变式题(选择题6-10)河南省焦作市博爱县第一中学2022-2023学年高一下学期6月期末考试化学试题(已下线)专题十二 硫及其化合物(已下线)合格考真题汇编11硫元素及其化合物第3课时 不同价态含硫物质的转化广东省信宜市第二中学2022-2023学年高一下学期化学期中热身试试卷四川省泸州市龙马潭区2023-2024学年高一下学期5月期中考试化学试题广东省湛江市第二十一中学2023-2024学年高一下学期期中考试化学(学考)试卷



