1 . I.完成下列氧化还原反应相关问题。
(1)误食NaNO2会使人体血红蛋白中的Fe2+转化为Fe3+而导致中毒,该过程中NaNO2表现出___________ (填“氧化性”或“还原性”)。
(2)已知NaNO2可以与NH4Cl反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
Ⅱ.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物ClO2。其反应的化学方程式为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(3)该反应中的氧化产物为___________ (填化学式)。
(4)浓盐酸在该反应中显示出来的性质是___________ (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(5)在碱性条件下加入NaClO3,可将NaCrO2转化为Na2CrO4,ClO 被还原为Cl−,其离子方程式为
被还原为Cl−,其离子方程式为___________ 。还原性:
___________ Cl−(填“>”“<”或“=”)。
(1)误食NaNO2会使人体血红蛋白中的Fe2+转化为Fe3+而导致中毒,该过程中NaNO2表现出
(2)已知NaNO2可以与NH4Cl反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:
Ⅱ.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物ClO2。其反应的化学方程式为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(3)该反应中的氧化产物为
(4)浓盐酸在该反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(5)在碱性条件下加入NaClO3,可将NaCrO2转化为Na2CrO4,ClO
 被还原为Cl−,其离子方程式为
被还原为Cl−,其离子方程式为
您最近一年使用:0次
2 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱:数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如下表所示:(注意:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为___________ (填序号)。
① ②酸性
②酸性 ③酸性
③酸性
(2)已知 与
与 不能共存,由此推测下列能大量共存的离子组是
不能共存,由此推测下列能大量共存的离子组是___________ 。
a. b.
b. c.
c.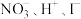 d.
d.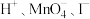
(3)向等浓度的 和FeCl2混合溶液滴加少量酸性
和FeCl2混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为___________ 。
(4)已知常温下 遇淀粉变蓝。现往淀粉
遇淀粉变蓝。现往淀粉 溶液中逐滴加入氯水(含
溶液中逐滴加入氯水(含 ),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:
),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1: 将淀粉氧化; 猜想2:
将淀粉氧化; 猜想2: 被
被 继续氧化(为
继续氧化(为 )。
)。
①实验1所用试剂a为___________ 。
②试剂b是一种可溶性含碘化合物,该反应的离子方程式为___________ 。
结合上述信息思考:对于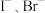 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出合理的氧化方案:加入
,请提出合理的氧化方案:加入___________ 。(合理即给分)
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱:数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如下表所示:(注意:实验中进行酸化时均用稀硫酸)
| 物质 | FeCl3 | KMnO4(酸化) | NaNO3(酸化) | Br2 | I2 | Na2S |
| 浓度 | 0.10M(M为物质的量浓度的单位) | |||||
| 电位值/mV | 171 | 1130 | 603 | 662 | 116 | -361 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
①
 ②酸性
②酸性 ③酸性
③酸性
(2)已知
 与
与 不能共存,由此推测下列能大量共存的离子组是
不能共存,由此推测下列能大量共存的离子组是a.
 b.
b. c.
c.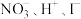 d.
d.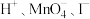
(3)向等浓度的
 和FeCl2混合溶液滴加少量酸性
和FeCl2混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知常温下
 遇淀粉变蓝。现往淀粉
遇淀粉变蓝。现往淀粉 溶液中逐滴加入氯水(含
溶液中逐滴加入氯水(含 ),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:
),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1: 将淀粉氧化; 猜想2:
将淀粉氧化; 猜想2: 被
被 继续氧化(为
继续氧化(为 )。
)。| 序号 | 实验操作 | 试剂 | 观察实验现象 | 结论 |
| 1 | 分别取少量褪色后溶液于三支试管中,并加入对应试剂 | a | 溶液变蓝 | 猜想1不正确 |
| 2 | 淀粉溶液 | 溶液不变蓝 | 猜想2正确 | |
| 3 | b+稀H2SO4 | 溶液变蓝 |
②试剂b是一种可溶性含碘化合物,该反应的离子方程式为
结合上述信息思考:对于
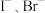 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出合理的氧化方案:加入
,请提出合理的氧化方案:加入
您最近一年使用:0次
3 . 氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式:_______ 。
(2)苹果汁是人们喜欢的饮料。由于此饮料中含有Fe2+,现榨的会由淡绿色(含Fe2+)变为棕黄色(含Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。
(3)锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一、早在远古时代,人们便发现并使用锡了。在我国的一些古墓中,便常发掘到一些锡壶、锡烛台之类锡器。工业上冶炼锡的第一步反应原理为2SnO2+3C 2Sn+aM↑+CO2↑,a的数值为
2Sn+aM↑+CO2↑,a的数值为_______ ,发生还原反应的元素是_______ 。
(4)焊接铜器时,可用NH4Cl除去表面的CuO再进行焊接,该反应是: CuO+NH4Cl→ Cu+CuCl2+N2↑+H2O
①配平该反应方程式____CuO+ ___NH4Cl=___Cu+____CuCl2+_____N2↑+____H2O___
②该反应的氧化剂是_______ ,氧化产物是_______ 。氧化剂和还原剂的个数比是____ 。
(5)一定条件下,分别以KMnO4、KClO3、H2O2为原料制取O2,当制得相同质量的O2时,三个反应中转移的电子数目之比为_______ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式:
(2)苹果汁是人们喜欢的饮料。由于此饮料中含有Fe2+,现榨的会由淡绿色(含Fe2+)变为棕黄色(含Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
 2Sn+aM↑+CO2↑,a的数值为
2Sn+aM↑+CO2↑,a的数值为(4)焊接铜器时,可用NH4Cl除去表面的CuO再进行焊接,该反应是: CuO+NH4Cl→ Cu+CuCl2+N2↑+H2O
①配平该反应方程式____CuO+ ___NH4Cl=___Cu+____CuCl2+_____N2↑+____H2O
②该反应的氧化剂是
(5)一定条件下,分别以KMnO4、KClO3、H2O2为原料制取O2,当制得相同质量的O2时,三个反应中转移的电子数目之比为
您最近一年使用:0次
名校
解题方法
4 . 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。

已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为 ;
;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O。
回答下列问题:
(1)装置E中盛放浓硝酸的仪器名称是___________ ,其中发生反应的化学方程式为___________ 。
(2)上述实验装置中,依次连接的合理顺序为h→___________ 。
(3)装置B中装浓硫酸利用了其___________ 性(选填氧化性、还原性、脱水性、吸水性)。
(4)酸性KMnO4溶液的作用是___________ (用离子方程式表示)。
(5)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为___________ 。
(6)测定深水井中NaNO2含量:取1000mL水样于锥形瓶中,立即加入500mL0.01mol/L酸性高锰酸钾溶液,充分反应后用0.1mol/L Na2C2O4溶液滴定高锰酸钾,终点时消耗草酸钠溶液75.00mL。则水中NaNO2的含量为___________ mol/L。若所取样品在空气中放置时间过长,则测定结果___________ (填“偏高”“偏低”或“无影响”)。

已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为
 ;
;③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O。
回答下列问题:
(1)装置E中盛放浓硝酸的仪器名称是
(2)上述实验装置中,依次连接的合理顺序为h→
(3)装置B中装浓硫酸利用了其
(4)酸性KMnO4溶液的作用是
(5)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为
(6)测定深水井中NaNO2含量:取1000mL水样于锥形瓶中,立即加入500mL0.01mol/L酸性高锰酸钾溶液,充分反应后用0.1mol/L Na2C2O4溶液滴定高锰酸钾,终点时消耗草酸钠溶液75.00mL。则水中NaNO2的含量为
您最近一年使用:0次
5 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
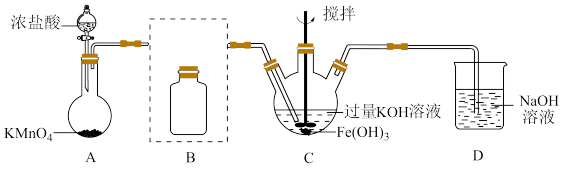
①A为氯气发生装置。A中反应方程式是________________ (锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。_______
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有________________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________ 产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2________  (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是________________ 。
③资料表明,酸性溶液中的氧化性 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:________________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH
 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性
 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
2018-06-09更新
|
9682次组卷
|
31卷引用:四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(强基班)
四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(强基班)2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题(已下线)高考母题题源18 化学实验设计与探究(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)(已下线)2019年高考总复习巅峰冲刺-专题03 氧化还原反应 离子反应应试策略(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精讲)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 高考帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 高考帮河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题(已下线)易错22 气体实验装置的设计-备战2021年高考化学一轮复习易错题(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第7讲 铁及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向14 物质制备探究-备战2022年高考化学一轮复习考点微专题(已下线)第07讲 铁及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第28讲 定性、定量实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)天津市耀华中学2023届高三第一次统练化学试题云南省玉溪市华宁县第二中学2021-2022年高一下学期开学考试化学试题第三章 金属及其化合物 第14讲 铁及其化合物的转化关系(已下线)第一部分 化学综合实验 热点6 物质性质探究实验北京一零一中学2023-2024学年高一上学期11月统练三化学试卷河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题
名校
解题方法
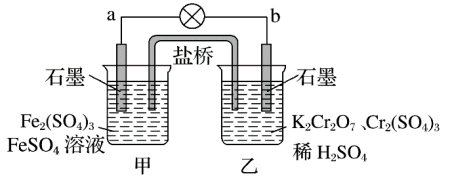
6 . 某学习小组的同学查阅相关资料知氧化性: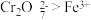 ,设计了盐桥式的原电池,如图所示,盐桥中装有琼脂与饱和
,设计了盐桥式的原电池,如图所示,盐桥中装有琼脂与饱和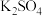 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是
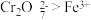 ,设计了盐桥式的原电池,如图所示,盐桥中装有琼脂与饱和
,设计了盐桥式的原电池,如图所示,盐桥中装有琼脂与饱和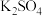 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是
| A.甲烧杯的溶液中发生还原反应 |
B.乙烧杯中发生的电极反应为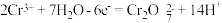 |
C.电池工作时,盐桥中的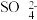 移向乙烧杯 移向乙烧杯 |
| D.外电路的电流方向为从b到a |
您最近一年使用:0次
2021-04-07更新
|
588次组卷
|
12卷引用:四川省射洪中学2022—2023学年高一下学期(强基班)第三次月考化学试题
四川省射洪中学2022—2023学年高一下学期(强基班)第三次月考化学试题2015届福建省长汀县第一中学高三上学期第四次月考化学试卷2016-2017学年浙江省嘉兴一中高二上期中化学试卷(已下线)2019年9月15日 《每日一题》2020年一轮复习 —— 每周一测(已下线)第20讲 原电池 化学电源(精练)-2021年高考化学一轮复习讲练测江西省宜春市奉新县第一中学2020-2021学年高二下学期第一次月考化学试题(已下线)第16讲 原电池 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)辽宁省沈阳市第二中学2021-2022学年高一下学期期中考试化学试题四川省南充市第一中学2021-2022学年高一下学期6月月考化学试题重庆市第一中学校2020-2021学年高二下学期期末考试化学试题广东省韶关市2022-2023学年高二下学期期末考试化学试题(已下线)第24讲原电池与化学电源
12-13高一下·黑龙江鹤岗·期中
名校
解题方法
7 . 以下关于锂、钠、钾、铷、铯的叙述不正确的是( )
①氢氧化物中碱性最强的是CsOH
②单质熔点最高的是铯
③与O2反应均可得到多种氧化物
④它们的密度依次增大,要保存在煤油中
⑤其单质的还原性依次增强
⑥它们对应离子的氧化性依次增强
①氢氧化物中碱性最强的是CsOH
②单质熔点最高的是铯
③与O2反应均可得到多种氧化物
④它们的密度依次增大,要保存在煤油中
⑤其单质的还原性依次增强
⑥它们对应离子的氧化性依次增强
| A.①③⑤ | B.②④⑥ | C.②③④⑥ | D.①⑤ |
您最近一年使用:0次
2020-03-27更新
|
302次组卷
|
11卷引用:四川省遂宁市射洪县射洪中学校2019-2020学年高一下学期第一次学月考试化学试题
四川省遂宁市射洪县射洪中学校2019-2020学年高一下学期第一次学月考试化学试题(已下线)2012-2013学年黑龙江省鹤岗一中高一下学期期中考试化学试卷2015-2016学年四川省成都七中高一下第一次阶段测化学卷2015-2016学年四川省成都市七中高一下学期期中化学试卷2015-2016学年湖南省长郡中学高一下期中化学试卷云南省富宁县三中2019-2020学年高一上学期期末考试化学试题天津市第九十五中学2019-2020学年高一下学期3月检测考试化学试题甘肃省天水市秦安县第一中学2019-2020学年高一上学期期末考试化学试题广西南宁市沛鸿高中2020-2021学年高一3月月考化学试题内蒙古赤峰市元宝山区第一中学2021-2022学年高一下学期4月月考化学试题四川省达州市第一中学校2021-2022学年高一下学期第一次月考化学试题
名校
8 . 部分弱酸的电离平衡常数如表:
(1)已知HX为一元弱酸。HX的电离常数为5.5×10-8。某混合溶液中含有4mol NaX、2mol Na2CO3和1mol NaHCO3.往溶液中通入3mol CO2气体,充分反应后,气体全部被吸收,计算NaHCO3的物质的量___________
(2)向少量氯水中加入足量Na2CO3固体,写出反应的离子方程式:___________
(3)下列离子方程式书写正确的是___________
(4)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两种酸之间的化学反应方程式:___________ 。
(5)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:___________ 。
(6)上表的7种酸进行比较,酸性最弱的是___________ ;HCOO-、S2-、HSO 三种离子中,最难结合H+的是
三种离子中,最难结合H+的是___________ 。
| 弱酸 | HCOOH | HClO | HNO2 | H2S | H2SO3 | H2C2O4 | H2CO3 |
| 电离常数(25℃) | K=1.8×10-4 | Ka=3.0×10-8 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
(2)向少量氯水中加入足量Na2CO3固体,写出反应的离子方程式:
(3)下列离子方程式书写正确的是___________
A.2HCOOH + SO = 2HCOO- + H2O + SO2 ↑ = 2HCOO- + H2O + SO2 ↑ |
B.H2SO3 + 2HCOO- = 2HCOOH + SO |
C.H2SO3 + SO = 2HSO = 2HSO |
D.H2C2O4 + NO = HC2O = HC2O + HNO2 + HNO2 |
(5)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:
(6)上表的7种酸进行比较,酸性最弱的是
 三种离子中,最难结合H+的是
三种离子中,最难结合H+的是
您最近一年使用:0次
名校
解题方法
9 . 下列有几个结论是正确的
①金属性: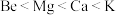
②氢化物的稳定性: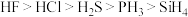
③微粒半径:
④氧化性: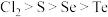
⑤酸性: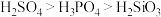
⑥沸点:
⑦离子的还原性:
①金属性:
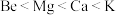
②氢化物的稳定性:
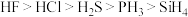
③微粒半径:

④氧化性:
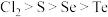
⑤酸性:
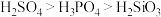
⑥沸点:

⑦离子的还原性:

| A.7个 | B.6个 | C.5个 | D.4个 |
您最近一年使用:0次
2023-03-24更新
|
390次组卷
|
4卷引用:四川省遂宁市射洪中学校2022-2023学年高二下学期5月月考化学试题
10 . 利用“价类二维图”研究物质的性质,是一种有效的学习方法。以下是铁元素及其化合物的二维图的部分信息。

(1)X、Y的化学式分别为_________ 。_________ 、
(2)图中只具有还原性的物质是_________ (写化学式)。
(3)可以证明FeCl2既具有氧化性又具有还原性的试剂分别为_________ 、_________ 。
(4)某实验小组设计如下实验探究亚铁盐的性质。
实验I中最后生成红褐色沉淀的化学方程式是____________________________________ 。
②对实验II所得白色沉淀展开研究:(已知Fe(HCO3)2常温常压下在水中不能大量存在)
i.取II中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量H2O2,溶液立即变为红色。
根据以上现象,实验II中生成的白色沉淀的化学式为_________ 。
③研究过程中发现实验II中白色沉淀在空气中久置最终也变为红褐色。则该沉淀比实验I中所得的Fe(OH)2的还原性_________ (填“强”或“弱”)。

(1)X、Y的化学式分别为
(2)图中只具有还原性的物质是
(3)可以证明FeCl2既具有氧化性又具有还原性的试剂分别为
(4)某实验小组设计如下实验探究亚铁盐的性质。
实验方案 | 现象 | |
| Ⅰ | 1.0mL0.1mol/LFeSO4溶液中滴入1.0mL0.5mol/L NaOH溶液 | 生成白色沉淀,3min后沉淀基本变为红褐色 |
| Ⅱ | 1.0mL0.1mol/LFeSO4溶液中滴入1.0mL0.5mol/L NaHCO3溶液 | 生成白色沉淀,3min后沉淀颜色几乎不变 |
②对实验II所得白色沉淀展开研究:(已知Fe(HCO3)2常温常压下在水中不能大量存在)
i.取II中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量H2O2,溶液立即变为红色。
根据以上现象,实验II中生成的白色沉淀的化学式为
③研究过程中发现实验II中白色沉淀在空气中久置最终也变为红褐色。则该沉淀比实验I中所得的Fe(OH)2的还原性
您最近一年使用:0次
2020-03-03更新
|
190次组卷
|
3卷引用:四川省遂宁市射洪中学2021-2022学年高一上学期第三次(12月)月考(强基班)化学试题
四川省遂宁市射洪中学2021-2022学年高一上学期第三次(12月)月考(强基班)化学试题四川省成都市2019-2020学年高一上学期期末调研考试化学试题(已下线)第13讲 铁的氧化物和铁的氢氧化物-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)



