1 . 某实验小组用下列装置制备高铁酸钾( K2FeO4 )并探究其性质,制备原理为:3Cl2+2Fe(OH)3+ 10KOH=2K2FeO4+6KCl+8H2O。(夹持装置略)
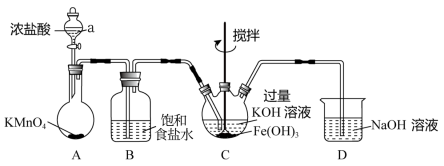
查阅资料:①K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2。②ClO-能将盐酸氧化成氯气。
I. K2FeO4的制备
(1)仪器a的名称为___________ ,D中的NaOH溶液可以用___________ 代替(填入对应字母)。
A.蒸馏水 B.澄清石灰水 C.石灰乳 D.饱和食盐水
(2)检验气体发生装置A气密性的方法是___________ ; 该装置中生成黄绿色气体的化学反应方程式为___________ 。
(3)制备K2FeO4需要在___________ (填“酸性”“碱性”或“中性”)环境中进行,根据上述K2FeO4的制备实验得出:氧化性Cl2___________ FeO (填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式
(填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式___________ 。
II.探究K2FeO4的性质
(4)实验方案:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液。取少量该溶液于试管中,滴加过量盐酸后发现有Cl2产生。
①为确保氧化Cl-的物质只能是FeO ,则用KOH溶液洗涤的目的是
,则用KOH溶液洗涤的目的是___________ 。
②由(4)的实验得出Cl2和FeO 的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是
的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是___________ 。

查阅资料:①K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2。②ClO-能将盐酸氧化成氯气。
I. K2FeO4的制备
(1)仪器a的名称为
A.蒸馏水 B.澄清石灰水 C.石灰乳 D.饱和食盐水
(2)检验气体发生装置A气密性的方法是
(3)制备K2FeO4需要在
 (填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式
(填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式II.探究K2FeO4的性质
(4)实验方案:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液。取少量该溶液于试管中,滴加过量盐酸后发现有Cl2产生。
①为确保氧化Cl-的物质只能是FeO
 ,则用KOH溶液洗涤的目的是
,则用KOH溶液洗涤的目的是②由(4)的实验得出Cl2和FeO
 的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是
的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是
您最近一年使用:0次
2022-01-15更新
|
331次组卷
|
2卷引用:四川省资阳市2021-2022学年高一上学期期末考试化学试题
名校
2 . 某课外活动小组在实验室用如图所示装置快速制取 并验证
并验证 的某些性质,同时还收集到少量纯净的氮气。
的某些性质,同时还收集到少量纯净的氮气。
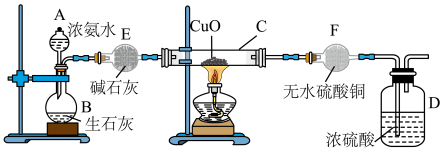
(1)用生石灰和浓氨水制取 的原理为
的原理为__________ 。
(2)实验进行一段时间后,观察到装置C中黑色氧化铜粉末变为红色,装置F中无水硫酸铜变为蓝色,并且在最后的出气导管口处收集到纯净、干燥的氮气。根据这些现象,写出装置C中发生反应的化学方程式:__________ ,该反应说明 具有
具有__________ (填序号)。
A.碱性 B.还原性 C.氧化性 D.不稳定性
(3)装置D中浓硫酸的作用是__________ 。
(4)欲在最后的出气导管口处收集到干燥、纯净的氮气,收集方法是__________ (填序号)。
A.排空气法 B.排水法 C.用气囊收集
(5)装置E的作用是__________ ,装置F的作用主要是__________ 。
 并验证
并验证 的某些性质,同时还收集到少量纯净的氮气。
的某些性质,同时还收集到少量纯净的氮气。
(1)用生石灰和浓氨水制取
 的原理为
的原理为(2)实验进行一段时间后,观察到装置C中黑色氧化铜粉末变为红色,装置F中无水硫酸铜变为蓝色,并且在最后的出气导管口处收集到纯净、干燥的氮气。根据这些现象,写出装置C中发生反应的化学方程式:
 具有
具有A.碱性 B.还原性 C.氧化性 D.不稳定性
(3)装置D中浓硫酸的作用是
(4)欲在最后的出气导管口处收集到干燥、纯净的氮气,收集方法是
A.排空气法 B.排水法 C.用气囊收集
(5)装置E的作用是
您最近一年使用:0次
3 . 绿矾(FeSO4·7H2O)在不同温度下可分解得到各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:
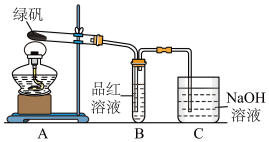
(1)同学甲按右图所示装置实验检验绿矾的分解产物。装置B中可观察到的现象是_____ ,由此得出绿矾的分解产物中含有SO2。装置C的作用是_____ 。
(2)同学乙认为同学甲的实验结论不严谨。乙对甲做完实验的B装置试管进行加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中_____ 。(选填字母)
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)同学丙查阅资料发现绿矾受热分解还可能有O2放出,为此,丙选用甲的部分装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置:
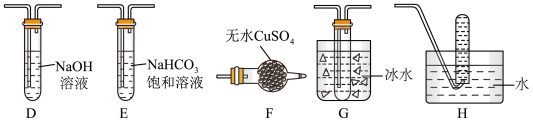
①同学丙的实验装置中,依次连接的合理顺序为_____ 。
②能证明绿矾分解产物中有O2的实验操作及现象是_____ 。
(4)为证明绿矾分解产物中含有三价铁,选用的实验仪器有试管、药匙、_____ ;选用的试剂为_____ 。

(1)同学甲按右图所示装置实验检验绿矾的分解产物。装置B中可观察到的现象是
(2)同学乙认为同学甲的实验结论不严谨。乙对甲做完实验的B装置试管进行加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)同学丙查阅资料发现绿矾受热分解还可能有O2放出,为此,丙选用甲的部分装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置:

①同学丙的实验装置中,依次连接的合理顺序为
②能证明绿矾分解产物中有O2的实验操作及现象是
(4)为证明绿矾分解产物中含有三价铁,选用的实验仪器有试管、药匙、
您最近一年使用:0次
2018-01-25更新
|
770次组卷
|
5卷引用:四川省资阳市高中2018届高三第二次诊断性考试理科综合化学试题
四川省资阳市高中2018届高三第二次诊断性考试理科综合化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题17 以物质的性质为线索的理论综合题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》(已下线)专题01 定性设计-【微专题·大素养】备战2022年高考化学核心突破(实验综合大题)(已下线)03 物质成分或反应产物探究类综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
4 . 下图为碳与浓硫酸反应产物的探究实验,下列分析正确的是


| A.碳与浓硫酸的反应体现了浓硫酸的酸性、强氧化性、脱水性 |
B.Ⅰ、Ⅱ中溶液褪色体现了 的还原性 的还原性 |
| C.Ⅲ中溶液会产生白色沉淀 |
D.浓硫酸氧化性强,不可干燥还原性气体 |
您最近一年使用:0次
2022-10-12更新
|
331次组卷
|
4卷引用:四川省资阳市乐至中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
5 . 某校化学兴趣小组用如下装置图验证NO2的氧化性和NO的还原性。请回答下列问题:
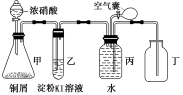
(1)写出甲中反应的离子方程式:______________ ;
(2)说明NO2具有氧化性的现象是_________________ ;
(3)说明NO具有还原性的操作和现象是______________ ;
(4)小组一成员对实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由除了硝酸具有挥发性外,还有可能是_____________________________________ ;经小组讨论,他们设计了以下方案,其中合理的是__________
A.NO2与HCl气体混合 B.NO2与H2S气体混合 C.NO2通入Na2S溶液中

(1)写出甲中反应的离子方程式:
(2)说明NO2具有氧化性的现象是
(3)说明NO具有还原性的操作和现象是
(4)小组一成员对实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由除了硝酸具有挥发性外,还有可能是
A.NO2与HCl气体混合 B.NO2与H2S气体混合 C.NO2通入Na2S溶液中
您最近一年使用:0次
6 . 化学与生活密切相关,下列说法错误的是
| A.古人曾利用明矾溶液的酸性来清洗青铜器上的铜绿 |
| B.酸性重铬酸钾用于检查酒驾是利用其强氧化性 |
| C.葡萄中含有的花青素在碱性环境下显蓝色,可用苏打粉检验假葡萄酒 |
| D.手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料 |
您最近一年使用:0次
7 . 废旧显示屏玻璃中含有SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[化学式为xFe2(SO4)3·y(NH4)2SO4·zH2O],流程设计如下:
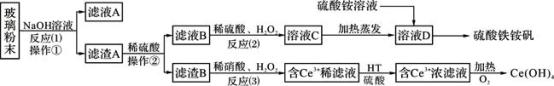
已知:Ⅰ、酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ、CeO2不溶于稀硫酸,也不溶于氢氧化钠溶液。
回答以下问题:
(1)操作①的名称是_____________ ;该操作所用的玻璃仪器有:烧杯、_________ 、_________ 。
(2)反应(2)中过氧化氢的作用是:_________________________ 。
(3)反应(3)的离子方程式是:_____________________ 。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+(水层)+6HT(有机层) 2CeT3(有机层)+6H+(水层)
2CeT3(有机层)+6H+(水层)
从平衡角度解释:向CeT3(有机层)加入硫酸获得较纯的含Ce3+的水溶液的原因是_________________ 。
(5)硫酸铁铵矾广泛用于水的净化处理,其净水原理用离子方程式表示为:_________________ 。
(6)相同物质的量浓度的以下四种溶液中,铵根离子浓度由大到小的顺序是:_________________ 。
a.xFe2(SO4)3·y(NH4)2SO4·zH2O
b.(NH4)2SO4
c.(NH4)2CO3
d.NH3·H2O
(7)为测定某硫酸铁铵矾样品的组成,现称取14.00 g该样品,将其溶于水配制成100 mL溶液;再将溶液分成两等份,向其中一份加入足量氢氧化钠溶液,过滤、洗涤沉淀、再烘干灼烧至恒重,得到1.60 g固体;向另一份溶液中加入0.5 mol/L硝酸钡溶液100 mL,恰好完全反应。则该硫酸铁铵矾的化学式为____________________ 。

已知:Ⅰ、酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ、CeO2不溶于稀硫酸,也不溶于氢氧化钠溶液。
回答以下问题:
(1)操作①的名称是
(2)反应(2)中过氧化氢的作用是:
(3)反应(3)的离子方程式是:
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+(水层)+6HT(有机层)
 2CeT3(有机层)+6H+(水层)
2CeT3(有机层)+6H+(水层)从平衡角度解释:向CeT3(有机层)加入硫酸获得较纯的含Ce3+的水溶液的原因是
(5)硫酸铁铵矾广泛用于水的净化处理,其净水原理用离子方程式表示为:
(6)相同物质的量浓度的以下四种溶液中,铵根离子浓度由大到小的顺序是:
a.xFe2(SO4)3·y(NH4)2SO4·zH2O
b.(NH4)2SO4
c.(NH4)2CO3
d.NH3·H2O
(7)为测定某硫酸铁铵矾样品的组成,现称取14.00 g该样品,将其溶于水配制成100 mL溶液;再将溶液分成两等份,向其中一份加入足量氢氧化钠溶液,过滤、洗涤沉淀、再烘干灼烧至恒重,得到1.60 g固体;向另一份溶液中加入0.5 mol/L硝酸钡溶液100 mL,恰好完全反应。则该硫酸铁铵矾的化学式为
您最近一年使用:0次
名校
8 . 现有以下物质:①NaCl晶体;②干冰;③液态的醋酸;④铜;⑤ 固体;⑥蔗糖;⑦浓盐酸;⑧熔融的
固体;⑥蔗糖;⑦浓盐酸;⑧熔融的 ;⑨酒精溶液;⑩
;⑨酒精溶液;⑩ 溶液
溶液
请回答下列问题(填序号)
(1)以上物质能导电的是___________ 。
(2)以上物质属于电解质的是___________ 。
(3)以上物质属于非电解质的是___________ 。
(4)物质④铜在氧化还原反应中应该只能表现___________ (填“氧化性”和“还原性”)。实验室常用高锰酸钾与⑦反应制备 ,请你配平其化学方程式
,请你配平其化学方程式___________ 。
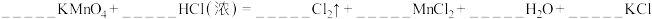
在此反应中,浓盐酸表现的化学性质是___________ 。
(5)向⑩ 溶液中滴加
溶液中滴加 溶液至中性,写出该反应的离子方程式
溶液至中性,写出该反应的离子方程式___________ 。
 固体;⑥蔗糖;⑦浓盐酸;⑧熔融的
固体;⑥蔗糖;⑦浓盐酸;⑧熔融的 ;⑨酒精溶液;⑩
;⑨酒精溶液;⑩ 溶液
溶液请回答下列问题(填序号)
(1)以上物质能导电的是
(2)以上物质属于电解质的是
(3)以上物质属于非电解质的是
(4)物质④铜在氧化还原反应中应该只能表现
 ,请你配平其化学方程式
,请你配平其化学方程式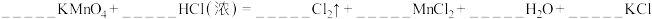
在此反应中,浓盐酸表现的化学性质是
(5)向⑩
 溶液中滴加
溶液中滴加 溶液至中性,写出该反应的离子方程式
溶液至中性,写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
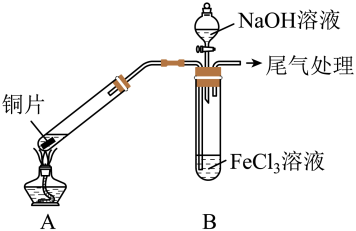
9 . 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如右图所示(夹持仪器已略去)。
(1)实验前,应先检查装置的___ ;实验中产生的尾气应通入___ 溶液进行处理。
(2)实验过程中需要配制100 mL l mol·L-1FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、___ ;实际配制过程中,常先将FeCl3固体完全溶于适量稀盐酸中,再加水稀释,此特殊操作的目的是____ 。
(3)该小组同学向5 mL l mol·L-1FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,写出其反应的离子方程式___ 。再打开分液漏斗活塞,逐滴加入煮沸冷却后的NaOH稀溶液,则试管B中产生的实验现象是___ 。
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应,最终溶液呈浅绿色。
【查阅资料】[Fe(HSO3)]2+在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为 。则[Fe(HSO3)]2+与Fe3+在溶液中反应的离子方程式是
。则[Fe(HSO3)]2+与Fe3+在溶液中反应的离子方程式是___ 。
(5)若实验中用5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mol·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓H2SO4浓度为____ 。(忽略过程中溶液的体积变化)
(1)实验前,应先检查装置的
(2)实验过程中需要配制100 mL l mol·L-1FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、
(3)该小组同学向5 mL l mol·L-1FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,写出其反应的离子方程式

(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应,最终溶液呈浅绿色。
【查阅资料】[Fe(HSO3)]2+在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为
 。则[Fe(HSO3)]2+与Fe3+在溶液中反应的离子方程式是
。则[Fe(HSO3)]2+与Fe3+在溶液中反应的离子方程式是(5)若实验中用5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mol·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓H2SO4浓度为
您最近一年使用:0次
2016-12-09更新
|
604次组卷
|
2卷引用:2016届四川省资阳市高三下学期第三次模拟考试理综化学试卷
10 . 下列反应① ②
②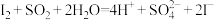 ③
③ 。由此判断下列说法错误的是
。由此判断下列说法错误的是
 ②
②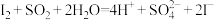 ③
③ 。由此判断下列说法错误的是
。由此判断下列说法错误的是A.氧化性强弱顺序为: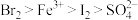 |
B.还原性强弱顺序为: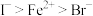 |
C. 与 与 水溶液不能反应 水溶液不能反应 |
D. 和 和 可以大量共存,若想除去 可以大量共存,若想除去 ,而又不影响 ,而又不影响 和 和 ,可用 ,可用 试剂 试剂 |
您最近一年使用:0次
2022-09-02更新
|
1100次组卷
|
6卷引用:四川省资阳市乐至中学2023-2024学年高一上学期10月月考化学试题



