名校
解题方法
1 . 下列有关热化学方程式书写与对应表述均正确的是
A.稀硫酸与 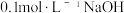 溶液反应: 溶液反应: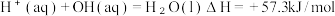 |
B.在10lkPa下 的燃烧热 的燃烧热 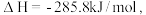 则水分解的热化学方程式为 则水分解的热化学方程式为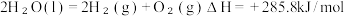 |
C.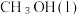 的燃烧热 的燃烧热  则有 则有 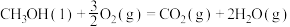  |
D.已知9.6g硫粉与11.2g铁粉混合加热生成 17.6g FeS 时放出 19.12kJ热量, 则 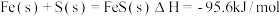 |
您最近一年使用:0次
2024-09-11更新
|
994次组卷
|
26卷引用:四川省大竹中学2021-2022学年高二上学期期中达标测化学试题(提高卷)
四川省大竹中学2021-2022学年高二上学期期中达标测化学试题(提高卷)【全国百强校】福建省莆田市第一中学2018-2019学年高一下学期期中考试化学试题河南省平顶山市鲁山县第一高级中学2019-2020高一下学期5月考试化学试题高中必刷题高二选择性必修1第一章 化学反应的热效应 第一章素养检测河北省沧州市泊头市第一中学2020-2021学年高二上学期第一次月考化学试题选择性必修1专题1第一单元综合训练山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题贵州省毕节市金沙县第一中学2021-2022学年高二上学期期中考试化学试题河北省沧州市泊头市第一中学2021-2022学年高二上学期第一次月考化学试题天津市南开区2021-2022学年高一下学期期末阶段性质量检测化学试题四川省遂宁中学校2020-2021学年高二下学期第一次月考化学试题浙江省金华市江南中学2021-2022学年高二上学期期中考试化学试题安徽省六安中学2021-2022学年高二上学期期中考试化学试题天津市第二十一中学2022-2023学年高二上学期期中调研化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题广东省深圳市龙华高级中学2022-2023学年高二上学期第二次段考化学试题吉林省长春外国语学校2023-2024学年高三上学期11月期中考试化学试题新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二上学期第二次月考试化学试卷广西钦州市第四中学2023-2024学年高二上学期9月考试化学试卷黑龙江省牡丹江市第一高级中学2023-2024学年高一下学期5月期中考试化学试题吉林省东北师范大学附属中学深圳学校2023-2024学年高二上学期月考化学试题陕西省延安中学2023-2024学年高一下学期第二次月考化学试卷安徽省马鞍山中加双语学校2023-2024学年高二上学期第一次月考化学试题四川省雅安市天全中学2023-2024学年高一下学期5月期中考试化学试题天津市河北区2023-2024学年高二上学期11月期中化学试题河南省新乡市原阳县第一高级中学2024-2025学年高二上学期入学测试化学试卷
解题方法
2 . 部分含N、S物质的分类与相应化合价的关系如图所示,下列说法正确的是
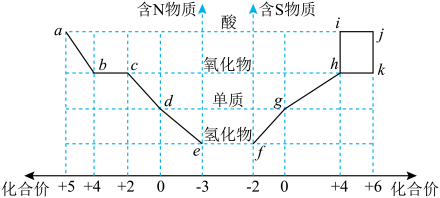
| A.b、c、h、k在标准状况下均为无色气体 |
| B.f与h、j的浓溶液均可反应生成g |
| C.工业上制备a的路线为d→c→b→a |
| D.e与i、f与i的反应属于同一基本反应类型 |
您最近一年使用:0次
2024-09-06更新
|
101次组卷
|
2卷引用:四川省达州市通川区2024-2025学年高三上学期开学考试化学试题
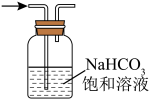
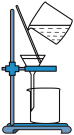
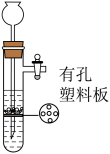
3 . 下列装置或操作能达到相应实验目的的是
|
|
| A.除去CO2中的SO2 | B.分离I2的CCl4溶液和H2O的混合物 |
|
|
| C.用MnO2与H2O2制取O2 | D.制备无水乙醇 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-09-06更新
|
110次组卷
|
2卷引用:四川省达州市通川区2024-2025学年高三上学期开学考试化学试题
4 . 下列所示的物质间转化或化学反应表示正确的是
A.金属Mg的制备:Mg(OH)2 MgCl2溶液 MgCl2溶液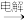 Mg Mg |
B.实验室制硅酸:SiO2 Na2SiO3 Na2SiO3 H2SiO3 H2SiO3 |
C.漂白粉失效:NaClO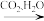 HClO HClO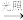 HCl HCl |
D.金属钠在空气中放置: Na Na2O2 Na2O2 Na2CO3 Na2CO3 |
您最近一年使用:0次
2024-09-06更新
|
119次组卷
|
2卷引用:四川省达州市通川区2024-2025学年高三上学期开学考试化学试题
5 . 叠氮化钠(NaN3)的晶胞结构如图。下列说法错误的是

A.与Na+等距离且最近的 有4个 有4个 | B.每个 含有10个电子 含有10个电子 |
| C.晶体中存在离子键和共价键 | D.晶体中所有离子的配位数相同 |
您最近一年使用:0次
2024-09-05更新
|
101次组卷
|
5卷引用:四川省达州市通川区2024-2025学年高三上学期开学考试化学试题
6 . 以钠箔和多壁碳纳米管(MWCNT)为电极材料的可充电“Na-CO2”电池的工作原理如图所示,放电时的总反应为:4Na+3CO2=2Na2CO3+C。下列说法中,不正确的是
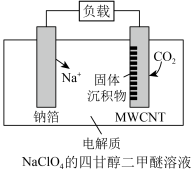
| A.放电时,电子的流向为钠箔→导线→MWCNT |
| B.放电时,正极反应为2CO2+4Na+ +4e-=2Na2CO3 |
C.充电时, 向MWCNT极移动 向MWCNT极移动 |
| D.充电时,每转移0.1 mol电子,释放出CO2的体积在标准状况下为1.68L |
您最近一年使用:0次
2024-09-04更新
|
109次组卷
|
2卷引用:四川省达州市通川区2024-2025学年高三上学期开学考试化学试题
解题方法
7 . 草酸亚铁晶体(FeC2O4·2H2O)是生产锂电池正极FePO4的原料,呈浅黄色,难溶于水,有较强还原性,受热易分解。
Ⅰ.制备草酸亚铁晶体
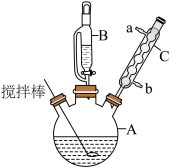
①称取5.0g (NH4)2Fe(SO4)2,并放入如图装置的仪器A中,加入10滴左右1.0 mol/LH2SO4溶液和15mL蒸馏水,加热溶解。
③待浅黄色晶体沉淀后,抽滤、洗涤、干燥得到晶体。
(1)仪器A的名称为___________ ,仪器C的作用是___________ 。
(2)用98.3%的浓硫酸配制1.0mol/L稀硫酸,需要选用的仪器是___________ (填字母)。___________ (写出两点即可)。
(4)称取一定量FeC2O4·2H2O,在氩气中进行热分解,得到固体残留率随温度变化曲线如图。 。
。
若M→N生成三种氧化物,则该过程反应的化学方程式为___________ 。
Ⅱ.样品中铁元素质量分数检测
草酸亚铁晶体(FeC2O4·2H2O)粗品中可能含有杂质为Fe2(C2O4)3、H2C2O4·2H2O,用KMnO4溶液滴定法测定该粗品的纯度,实验过程如图。
已知:5H2C2O4 +2 +6H+=10CO2↑+2Mn2++8H2O。
+6H+=10CO2↑+2Mn2++8H2O。
(5)“滴定②”中发生反应的离子方程式为___________ 。
(6)样品中铁元素的质量分数为___________ 。
Ⅰ.制备草酸亚铁晶体
①称取5.0g (NH4)2Fe(SO4)2,并放入如图装置的仪器A中,加入10滴左右1.0 mol/LH2SO4溶液和15mL蒸馏水,加热溶解。
③待浅黄色晶体沉淀后,抽滤、洗涤、干燥得到晶体。
(1)仪器A的名称为
(2)用98.3%的浓硫酸配制1.0mol/L稀硫酸,需要选用的仪器是
A. B.
B. C.
C. D.
D. E.
E.
(4)称取一定量FeC2O4·2H2O,在氩气中进行热分解,得到固体残留率随温度变化曲线如图。
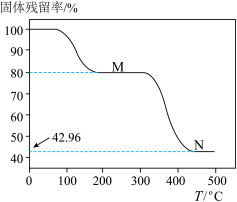
 。
。若M→N生成三种氧化物,则该过程反应的化学方程式为
Ⅱ.样品中铁元素质量分数检测
草酸亚铁晶体(FeC2O4·2H2O)粗品中可能含有杂质为Fe2(C2O4)3、H2C2O4·2H2O,用KMnO4溶液滴定法测定该粗品的纯度,实验过程如图。
已知:5H2C2O4 +2
 +6H+=10CO2↑+2Mn2++8H2O。
+6H+=10CO2↑+2Mn2++8H2O。
(5)“滴定②”中发生反应的离子方程式为
(6)样品中铁元素的质量分数为
您最近一年使用:0次
2024-09-04更新
|
69次组卷
|
2卷引用:四川省达州市通川区2024-2025学年高三上学期开学考试化学试题
解题方法
8 . 甲烷是优质气体燃料,也是制造合成气和许多化工产品的重要原料。
Ⅰ.CH4(g)和CO2(g)的一种催化反应历程如图所示:
(1)已知产物均为气态,反应CO2(g)+CH4(g)=CH3COOH(g)的ΔH =___________ 。
(2)若改用更高效的催化剂,该反应的ΔH___________ (填“增大”“减小”或“不变”)。
(3)将等物质的量的CO2(g)和CH4(g)置于恒容的绝热容器中发生上述反应,下列能说明该反应已达平衡状态的是___________ (填字母)。
a.2 molC=O断裂的同时生成NA个CH3COOH b.容器中的温度不变
c. =1,且保持不变 d.混合气体的密度不变
=1,且保持不变 d.混合气体的密度不变
e.v正(CO2)=v逆(CH3COOH) f.容器中的总压不变
Ⅱ.甲烷水蒸气催化重整是制备高纯氢的方法之一、反应如下:
反应ⅰ.CH4(g)+ H2O(g) CO(g)+3H2(g) ΔH=+206kJ/mol
CO(g)+3H2(g) ΔH=+206kJ/mol
反应ⅱ.CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH=+165 kJ/mol
CO2(g)+4H2(g) ΔH=+165 kJ/mol
(4)对于反应ⅰ,向体积为1 L的恒容密闭容器中,按n(CH4):n(H2O)=1:1投料。若在恒温条件下,反应达到平衡时,CH4的转化率为60%,则平衡时容器内的压强与起始时压强之比为___________ (填最简整数比)。
(5)反应ⅱ的速率方程v=k·cm(CH4)·c0.5(H2O),k为速率常数(只受温度影响),m为CH4的反应级数。在某温度下进行实验,测得各组分的初始浓度和反应初始的瞬时速率如下表。
①m=___________ ,k=___________ (不要求写单位)。
②当实验2进行到c(H2O)=0.25 mol/L时,反应的瞬时速率v=___________ mol/(L·s)。
(6)恒温条件下,1 mol CH4(g)和1 molH2O(g)在体积为1L的密闭容器中发生反应ⅰ、反应ⅱ,反应达平衡时,CH4(g)的转化率为60%,CO2(g)的物质的量为0.3mol,则反应ⅰ的平衡常数K=___________ (保留两位有效数字)。
Ⅰ.CH4(g)和CO2(g)的一种催化反应历程如图所示:
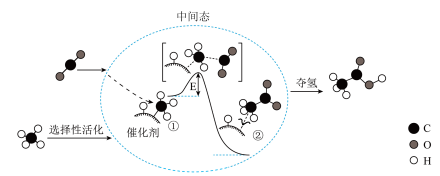
| 共价键 | C-H | C=O | O-H | C-O | C-C |
| 键能(kJ/mol) | 413 | 745 | 463 | 351 | 348 |
(1)已知产物均为气态,反应CO2(g)+CH4(g)=CH3COOH(g)的ΔH =
(2)若改用更高效的催化剂,该反应的ΔH
(3)将等物质的量的CO2(g)和CH4(g)置于恒容的绝热容器中发生上述反应,下列能说明该反应已达平衡状态的是
a.2 molC=O断裂的同时生成NA个CH3COOH b.容器中的温度不变
c.
 =1,且保持不变 d.混合气体的密度不变
=1,且保持不变 d.混合气体的密度不变e.v正(CO2)=v逆(CH3COOH) f.容器中的总压不变
Ⅱ.甲烷水蒸气催化重整是制备高纯氢的方法之一、反应如下:
反应ⅰ.CH4(g)+ H2O(g)
 CO(g)+3H2(g) ΔH=+206kJ/mol
CO(g)+3H2(g) ΔH=+206kJ/mol反应ⅱ.CH4(g)+2H2O(g)
 CO2(g)+4H2(g) ΔH=+165 kJ/mol
CO2(g)+4H2(g) ΔH=+165 kJ/mol(4)对于反应ⅰ,向体积为1 L的恒容密闭容器中,按n(CH4):n(H2O)=1:1投料。若在恒温条件下,反应达到平衡时,CH4的转化率为60%,则平衡时容器内的压强与起始时压强之比为
(5)反应ⅱ的速率方程v=k·cm(CH4)·c0.5(H2O),k为速率常数(只受温度影响),m为CH4的反应级数。在某温度下进行实验,测得各组分的初始浓度和反应初始的瞬时速率如下表。
| 实验序号 | c(H2O)/(mol/L) | CH4/(mol/L) | v/mol/(L·s) |
| 1 | 1.0 | 1.0 | 1.20 |
| 2 | 1.0 | 2.0 | 2.40 |
②当实验2进行到c(H2O)=0.25 mol/L时,反应的瞬时速率v=
(6)恒温条件下,1 mol CH4(g)和1 molH2O(g)在体积为1L的密闭容器中发生反应ⅰ、反应ⅱ,反应达平衡时,CH4(g)的转化率为60%,CO2(g)的物质的量为0.3mol,则反应ⅰ的平衡常数K=
您最近一年使用:0次
2024-09-04更新
|
140次组卷
|
2卷引用:四川省达州市通川区2024-2025学年高三上学期开学考试化学试题
解题方法
9 . “民以食为天”。下列说法错误的是
| A.料酒中含有乙醇,乙醇属于饱和一元醇 |
| B.鸡蛋富含蛋白质,蛋白质属于有机高分子化合物 |
| C.油脂是高能量物质,其中植物油的主要成分为不饱和脂肪酸 |
| D.烘焙糕点时用到碳酸氢钠,碳酸氢钠属于电解质 |
您最近一年使用:0次
2024-09-04更新
|
48次组卷
|
2卷引用:四川省达州市通川区2024-2025学年高三上学期开学考试化学试题
解题方法
10 . 以水锰矿[主要成分为MnO(OH),还含有少量的Fe2O3、Al2O3、SiO2及CaO]为原料制备马日夫盐[Mn(H2PO4)2·2H2O]的一种工艺流程如图所示。
回答下列问题:
(1)为增大步骤Ⅰ的浸出速率,可采取的措施有___________ (写出一条即可)。
(2)步骤Ⅰ中SO2的作用是___________ ,滤渣1的成分为___________ (填化学式)。
(3)步骤Ⅱ中MnO2发生反应的离子方程式为___________ 。
(4)“除钙”步骤中若要Ca2+完全沉淀,需控制溶液中的c(F-)≥___________ mol/L。
(5)“低温沉锰”得到MnCO3,“酸溶”时发生反应的化学方程式为___________ 。
(6)MnOx一种晶型的晶胞结构如图已知该晶胞的体积为v cm3,则该晶胞中“ ”球代表的原子的配位数为
”球代表的原子的配位数为___________ ,该晶体的密度为___________ g/cm3.(阿伏加德罗常数的值用NA表示)
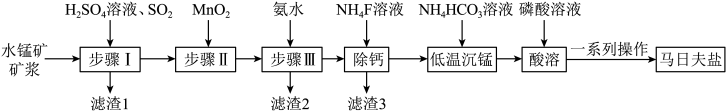
回答下列问题:
(1)为增大步骤Ⅰ的浸出速率,可采取的措施有
(2)步骤Ⅰ中SO2的作用是
(3)步骤Ⅱ中MnO2发生反应的离子方程式为
(4)“除钙”步骤中若要Ca2+完全沉淀,需控制溶液中的c(F-)≥
(5)“低温沉锰”得到MnCO3,“酸溶”时发生反应的化学方程式为
(6)MnOx一种晶型的晶胞结构如图已知该晶胞的体积为v cm3,则该晶胞中“
 ”球代表的原子的配位数为
”球代表的原子的配位数为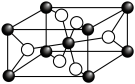
您最近一年使用:0次
2024-09-04更新
|
81次组卷
|
2卷引用:四川省达州市通川区2024-2025学年高三上学期开学考试化学试题