解题方法
1 . (一)某研究性学习小组为探究 Fe3+与 Ag 反应,进行如下实验:按下图连接装置并加入药品(盐桥中的物质不参与反应)。_______________ (填“正极”或“负极”)。
(2)盐桥中装有含有 KNO3饱和溶液的琼脂,K 闭合时,K+移向_______________ 溶液。
(3)结合上述实验,写出本原电池装置的负极反应:_______________ 。
(二)某研究性学习小组利用草酸(H2C2O4)溶液和酸性 KMnO4溶液之间的反应
来探究“外界条件改变对化学反应速率的影响”,实验设计如下:(假设溶液混合
时体积可以加和)
(4)写出草酸与酸性 KMnO4溶液反应的离子方程式:_______ 。
(5)乙同学欲通过实验①、②探究反应物浓度对该反应速率的影响,则a=_______ ,T=_______ 。若 t1<8 s,可以得出的结论是:_______ 。
(6)通过比较实验②、③的结果,可以探究_______ 变化对化学反应速率的影响。
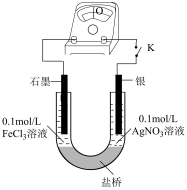
(2)盐桥中装有含有 KNO3饱和溶液的琼脂,K 闭合时,K+移向
(3)结合上述实验,写出本原电池装置的负极反应:
(二)某研究性学习小组利用草酸(H2C2O4)溶液和酸性 KMnO4溶液之间的反应
来探究“外界条件改变对化学反应速率的影响”,实验设计如下:(假设溶液混合
时体积可以加和)
| 实验序号 | 实验温度(K) | 酸性KMnO4溶液 | 草酸溶液 | 蒸馏水 | 褪色时间 | ||
| c(mol/L) | V(mL) | c(mol/L) | V(mL) | V(mL) | t(s) | ||
| ① | 298 | 0.02 | 2.0 | 0.10 | 4.0 | 0 | t1 |
| ② | T | 0.02 | 2.0 | 0.10 | 3.0 | a | 8.0 |
| ③ | 343 | 0.02 | 2.0 | 0.10 | 3.0 | a | t2 |
| ④ | 373 | 0.02 | 2.0 | 0.10 | 3.0 | a | t3 |
(4)写出草酸与酸性 KMnO4溶液反应的离子方程式:
(5)乙同学欲通过实验①、②探究反应物浓度对该反应速率的影响,则a=
(6)通过比较实验②、③的结果,可以探究
您最近一年使用:0次
解题方法
2 . 锰酸锂(LiMnO2)是锂电池的正极材料。以软锰矿粉(主要成分是MnO2,含少量Fe2O3、Al2O3、SiO2、MgO 等)为原料制备锰酸锂的流程如下:
请回答下列问题:
(1)“酸浸”时,常在高压下充入SO2 ,其目的是___________ 。
(2)过滤时需要的玻璃仪器有:烧杯、玻璃棒、________________ 。
(3)“滤渣 1”的主要成分是___________ (填化学式,下同),“酸浸”时,被氧化的物质是___________ 。
(4)“沉镁”时发生反应的离子方程式为___________ 。
(5)“调pH ”时发生反应: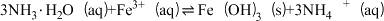 ,该反应的平衡常数K =
,该反应的平衡常数K =______ 。(已知:常温下,NH3·H2O 的电离常数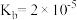 )
)
(6)测得“沉镁”后溶液中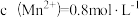 ,则残留的
,则残留的
________ mol·L-1。“沉锰”后的滤液与碱加热处理后可返回___________ (填步骤名称)步骤循环利用。

| 物质 | MgF2 | MnF2 | Mn(OH)2 | Fe(OH)3 |
| Ksp |  |  |  |  |
(1)“酸浸”时,常在高压下充入SO2 ,其目的是
(2)过滤时需要的玻璃仪器有:烧杯、玻璃棒、
(3)“滤渣 1”的主要成分是
(4)“沉镁”时发生反应的离子方程式为
(5)“调pH ”时发生反应:
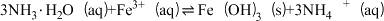 ,该反应的平衡常数K =
,该反应的平衡常数K =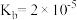 )
)(6)测得“沉镁”后溶液中
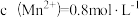 ,则残留的
,则残留的
您最近一年使用:0次
解题方法
3 . 中国科学家首次实现了二氧化碳到淀粉的全合成,相关成果于北京时间 9 月 24 日由国际知名学术期刊《科学》在线发表。CO2的捕集、利用与封存是科学家研究的重要课题,利用 CH4与 CO2制备“合成气”(CO、H2),合成气可直接制备甲醇,反应原理为:

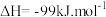 。
。
(1)已知:
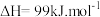 ,部分键能数据如下:(CO 的结构式为 C≡O)
,部分键能数据如下:(CO 的结构式为 C≡O)
计算 C—H 的键能 x= ______________ kJ/mol,(保留一位小数)。
(2)若要该反应自发进行,_______ (填“高温”或“低温”)更有利,该反应必须在高温下才能启动,原因是_______ 。
(3)已知:H2 (g)的燃烧热ΔH=-285.8kJ.mol-1,写出H2 (g)燃烧热的热化学反应方程式____________ 。
(4)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______(填字母序号)。
(5)T1℃下,在 2L 恒容密闭容器中充入 2molCO 和 6molH2合成 CH3OH(g),测得 CO 的物质的量浓度随反应时间的变化如图所示:_______ 。
②T1℃时,该反应的化学平衡常数 K=_______ 。
③10min 时,改变的外界条件可能是_______ 。
(6)T1℃下,在 1L 恒容密闭容器中充入 2molCO、2molH2和 3molCH3OH(g),此时反应将_______ (填“向左进行”“向右进行”“达到平衡”或“无法判断”)。

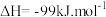 。
。(1)已知:

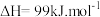 ,部分键能数据如下:(CO 的结构式为 C≡O)
,部分键能数据如下:(CO 的结构式为 C≡O)| 共价键 | C≡O | C—O | C—H | O—H | H—H |
| 键能/(kJ/mol) | 1072 | 326 | 464 | 436 |
(2)若要该反应自发进行,
(3)已知:H2 (g)的燃烧热ΔH=-285.8kJ.mol-1,写出H2 (g)燃烧热的热化学反应方程式
(4)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______(填字母序号)。
| A.混合气体的平均相对分子质量不再变化 |
| B.混合气体的密度不再变化 |
| C.CO 的百分含量不再变化 |
| D.CO、H2、CH3OH 的物质的量之比为 1∶2∶1 |
(5)T1℃下,在 2L 恒容密闭容器中充入 2molCO 和 6molH2合成 CH3OH(g),测得 CO 的物质的量浓度随反应时间的变化如图所示:
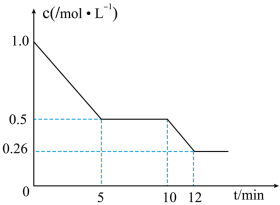
②T1℃时,该反应的化学平衡常数 K=
③10min 时,改变的外界条件可能是
(6)T1℃下,在 1L 恒容密闭容器中充入 2molCO、2molH2和 3molCH3OH(g),此时反应将
您最近一年使用:0次
4 . 物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,请回答:
(1)泡沫灭火剂包括Al2(SO4)3 溶液(约1mol/L ), NaHCO3溶液(约1mol/L )及起泡剂,使用时发生反应的离子方程式为_______ 。
(2)t℃时,某稀硫酸溶液中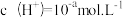 ,
,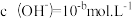 ,已知:
,已知: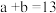 ,该温度下水的离子积常数 KW 的数值为
,该温度下水的离子积常数 KW 的数值为_______ 。
(3)含等物质的量的 NaHC2O4 和 Na 2C2O4 的溶液物料守恒式为_______ 。
(4)已知25℃时部分弱电解质的电离平衡常数数据如下表:
pH 相同的①CH3COONa 溶液、② NaClO溶液、③ NaHCO3溶液、④ NaOH 溶液,其物质的量浓度由大到小的顺序为_______ 。
(5)某溶液只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH 如下表所示:
为制备CuCl2·3H2O,除去Cu2+、Fe2+、Fe3+离子应该先加入_______ ,然后再加入_______ ,调节pH 范围为_______ 。
(1)泡沫灭火剂包括Al2(SO4)3 溶液(约1mol/L ), NaHCO3溶液(约1mol/L )及起泡剂,使用时发生反应的离子方程式为
(2)t℃时,某稀硫酸溶液中
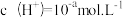 ,
,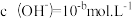 ,已知:
,已知: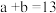 ,该温度下水的离子积常数 KW 的数值为
,该温度下水的离子积常数 KW 的数值为(3)含等物质的量的 NaHC2O4 和 Na 2C2O4 的溶液物料守恒式为
(4)已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 |  | 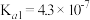 | 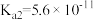 | 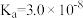 |
(5)某溶液只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH 如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
您最近一年使用:0次
解题方法
5 . 某学习小组为了探究 CH3COOH 的电离情况,进行了如下实验。
【实验一】配制并测定醋酸中 CH3COOH 的浓度。
将 0.2mol/L 醋酸稀释,并用 0.1000mol/L NaOH 溶液滴定 20.00mL 稀释后的溶液。4 次滴定消耗 NaOH 溶液的体积如下:
(1)该滴定涉及的离子反应方程式为__________________ 。
(2)滴定时量取 20.00ml 的待测液,选择的仪器为_______________ 。
A.酸式滴定管 B.碱式滴定管 C.量筒
(3)滴定时加入的指示剂为_______________ ,到达滴定终点的判断:_______________ 。
(4)该醋酸中 CH3COOH 的物质的量浓度为_______________ 。
(5)下列操作会导致测定 CH3COOH 的浓度偏低的是_______________。
【实验二】探究浓度对 CH3COOH 电离的影响。
用 PH 计测定 25℃时不同浓度的醋酸的 PH,结果如下:
(6)根据表中数据可以得出 CH3COOH 是弱电解质的结论,你认为得出此结论的依据是 _______________ 。
(7)根据表中数据还可以得出另一个结论:随着溶液中 CH3COOH 浓度的减小,CH3COOH 的电离程度将_______________ (填“增大”“减小”或“不变”)。
【实验一】配制并测定醋酸中 CH3COOH 的浓度。
将 0.2mol/L 醋酸稀释,并用 0.1000mol/L NaOH 溶液滴定 20.00mL 稀释后的溶液。4 次滴定消耗 NaOH 溶液的体积如下:
| 试验次数 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积/mL | 20.05 | 20.00 | 18.40 | 19.95 |
(2)滴定时量取 20.00ml 的待测液,选择的仪器为
A.酸式滴定管 B.碱式滴定管 C.量筒
(3)滴定时加入的指示剂为
(4)该醋酸中 CH3COOH 的物质的量浓度为
(5)下列操作会导致测定 CH3COOH 的浓度偏低的是_______________。
| A.酸式滴定管洗净后未用待装液润洗 |
| B.滴定前碱式滴定管尖端处有气泡,滴定后气泡消失 |
| C.摇动锥形瓶用力过猛,使少量溶液溅出 |
| D.滴定前仰视读数,滴定完毕俯视读数 |
【实验二】探究浓度对 CH3COOH 电离的影响。
用 PH 计测定 25℃时不同浓度的醋酸的 PH,结果如下:
| 浓度/(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.100 | 0.200 |
| PH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
(7)根据表中数据还可以得出另一个结论:随着溶液中 CH3COOH 浓度的减小,CH3COOH 的电离程度将
您最近一年使用:0次
6 . 室温时,向 20 mL 0.1 mol·L-1的 HA、HB 溶液中分别滴加 0.1 mol·L-1NaOH溶液,其 pH 变化分别对应如图中的Ⅰ、Ⅱ。下列说法不正确的是

| A.向 NaA 溶液中滴加 HB 溶液可产生 HA |
| B.加入 10mlNaOH 溶液时,HA 的导电性弱于 HB |
| C.滴加 NaOH 溶液至 pH=7 时,两种溶液中 c(A-)=c(B-) |
| D.滴加 20 mL NaOH 溶液时,Ⅰ中 H2O 的电离程度大于Ⅱ中 |
您最近一年使用:0次
解题方法
7 . 常温下 0.1mol/L 的四种盐溶液的 pH 如下表,下列叙述正确的是
| NaClO | Na2CO3 | NaHCO3 | NaHC2O4 | |
| pH | 10.3 | 11.6 | 8.3 | 2.7 |
| A.向 NaClO 溶液中滴加酚酞溶液,溶液变红后不会褪色 |
B.NaHCO3溶液中 HCO 的电离程度大于水解程度 的电离程度大于水解程度 |
C.Na2CO3和 NaHCO3溶液中均存在以下关系: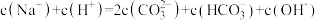 |
D.NaHC2O4溶液中,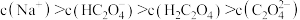 |
您最近一年使用:0次
解题方法
8 . 下列仪器在酸碱中和滴定不会使用到的是
| A.分液漏斗 | B.铁架台 | C.锥形瓶 | D.烧杯 |
您最近一年使用:0次
解题方法
9 . 工业废弃物铬钒渣中含有价格相对较高且稀缺的钒(V)、铬(Cr)元素,铬钒渣中铬、钒均以低价含氧酸盐(不溶于水,也不溶于碱性溶液)形式存在,杂质的成分主要为 、
、 、
、 以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示:
以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示: 与
与 固体能发生反应。
固体能发生反应。
②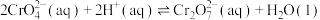 。
。
③25℃时, ,
,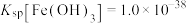 ;当溶液中离子浓度小于
;当溶液中离子浓度小于 时,可以认为完全沉淀。
时,可以认为完全沉淀。
(1)“煅烧”时为加快反应速率,可采取的措施为___________ ;“煅烧”时铬元素被氧化为相应的最高价含氧酸盐,则该最高价含氧酸盐中铬元素的化合价为___________ 价。
(2)写出“煅烧”时 与
与 固体反应的化学方程式:
固体反应的化学方程式:___________ 。
(3)试分析,将“浸取”步骤与“沉淀”步骤合并对产品纯度的影响:___________ 。
(4)“还原”时,发生反应的n(氧化剂)∶n(还原剂)=___________ 。
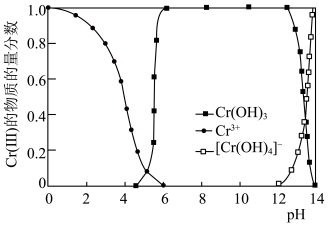
(5)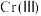 的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的
的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的 转化为
转化为 ,溶液中剩余
,溶液中剩余 的浓度小于
的浓度小于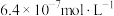 ,则调节pH的范围为
,则调节pH的范围为___________ {已知:25℃时,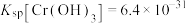 }。
}。 具有两性,溶解在NaOH溶液中得到
具有两性,溶解在NaOH溶液中得到 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ ; 在
在 时,转化为
时,转化为 ,向含
,向含 的溶液中加入氨水可得到微溶于水的
的溶液中加入氨水可得到微溶于水的 ,
, 受热最终会分解生成钒的余化物,取234g
受热最终会分解生成钒的余化物,取234g 焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为
焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为___________ 。
 、
、 、
、 以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示:
以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示: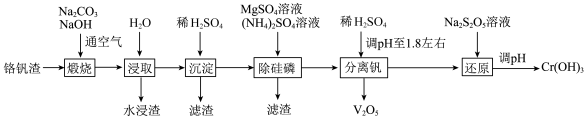
 与
与 固体能发生反应。
固体能发生反应。②
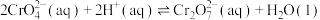 。
。③25℃时,
 ,
,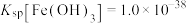 ;当溶液中离子浓度小于
;当溶液中离子浓度小于 时,可以认为完全沉淀。
时,可以认为完全沉淀。(1)“煅烧”时为加快反应速率,可采取的措施为
(2)写出“煅烧”时
 与
与 固体反应的化学方程式:
固体反应的化学方程式:(3)试分析,将“浸取”步骤与“沉淀”步骤合并对产品纯度的影响:
(4)“还原”时,发生反应的n(氧化剂)∶n(还原剂)=
(5)
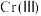 的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的
的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的 转化为
转化为 ,溶液中剩余
,溶液中剩余 的浓度小于
的浓度小于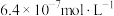 ,则调节pH的范围为
,则调节pH的范围为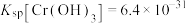 }。
}。
 具有两性,溶解在NaOH溶液中得到
具有两性,溶解在NaOH溶液中得到 ,写出该反应的离子方程式:
,写出该反应的离子方程式: 在
在 时,转化为
时,转化为 ,向含
,向含 的溶液中加入氨水可得到微溶于水的
的溶液中加入氨水可得到微溶于水的 ,
, 受热最终会分解生成钒的余化物,取234g
受热最终会分解生成钒的余化物,取234g 焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为
焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为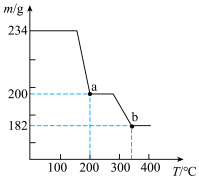
您最近一年使用:0次
10 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.含0.2mol 的浓硝酸与足量的Cu反应,转移的电子数大于 的浓硝酸与足量的Cu反应,转移的电子数大于 |
B.常温常压下,4.6g 中所含的原子总数为 中所含的原子总数为 |
C.10g46%的乙醇溶液中含有的氧原子总数为 |
D.3.36L 中含有的电子总数为 中含有的电子总数为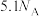 |
您最近一年使用:0次



