20-21高一上·全国·期末
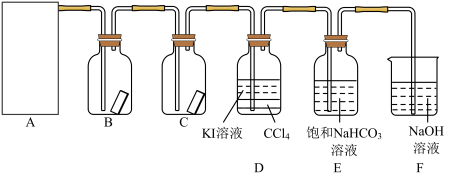
1 . 已知反应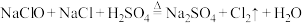 ,为探究氯气的性质,某同学设计了如图所示的实验装置。
,为探究氯气的性质,某同学设计了如图所示的实验装置。
试回答下列问题:
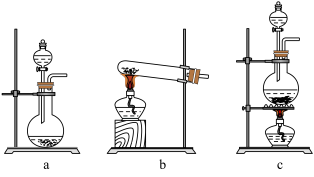
(1)在该实验中,以下可用于制取氯气的装置是_______ (填字母)。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是_______ ,请提出合理的改进方法:_______ 。
(3)写出氯气与 溶液反应的离子方程式:
溶液反应的离子方程式:_______ ,该反应中氧化剂与还原剂的物质的量之比为_______ 。为验证尾气吸收后的溶液中存在 ,正确的操作是
,正确的操作是_______ 。
(4)氯气通入饱和 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明
溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明 与
与 反应的产物中含有
反应的产物中含有_______ (填化学式)。
 ,为探究氯气的性质,某同学设计了如图所示的实验装置。
,为探究氯气的性质,某同学设计了如图所示的实验装置。
试回答下列问题:
(1)在该实验中,以下可用于制取氯气的装置是

(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是
(3)写出氯气与
 溶液反应的离子方程式:
溶液反应的离子方程式: ,正确的操作是
,正确的操作是(4)氯气通入饱和
 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明
溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明 与
与 反应的产物中含有
反应的产物中含有
您最近一年使用:0次
2024-03-04更新
|
52次组卷
|
7卷引用:四川省宜宾市叙州区第二中学校2022-2023学年高一下学期开学考试化学试题
四川省宜宾市叙州区第二中学校2022-2023学年高一下学期开学考试化学试题(已下线)期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)第二章单元检测 (测)--2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)重庆市巫山县官渡中学2020-2021学年高一下学期第一次月考化学试题四川省天府新区太平中学2022-2023学年高一上学期期末考试化学试题安徽省宿州市泗县第一中学2023-2024学年高一下学期开学考试化学试题内蒙古自治区通辽市科尔沁左翼中旗实验高级中学2023-2024学年高一上学期1月期末化学试题
解题方法
2 . 共价键的强弱可用键能来衡量。键能是指气态分子中1mol化学键解离成气态原子所吸收的能量。已知:
 ,
,
 ,则
,则 的键能为
的键能为

 ,
,
 ,则
,则 的键能为
的键能为| 化学键 |  |  |  |  |  |  |
键能 | 347.7 | a | 413.4 | 436.0 | 463.0 | b |
A.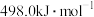 | B. |
C.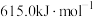 | D.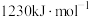 |
您最近一年使用:0次
3 . 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1molNO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)。反应相同时间后,测得各容器中NO2的转化率与容器体积的关系如图所示,下列说法正确的是
N2(g)+2CO2(g)。反应相同时间后,测得各容器中NO2的转化率与容器体积的关系如图所示,下列说法正确的是
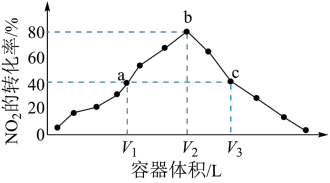
 N2(g)+2CO2(g)。反应相同时间后,测得各容器中NO2的转化率与容器体积的关系如图所示,下列说法正确的是
N2(g)+2CO2(g)。反应相同时间后,测得各容器中NO2的转化率与容器体积的关系如图所示,下列说法正确的是
| A.T℃时,a、b两点平衡常数Ka<Kb |
B.图中c点所示条件下, (正)= (正)= (逆) (逆) |
| C.容器内的压强:Pa∶Pb>6∶7 |
| D.图中b点所示条件下,再向体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡大 |
您最近一年使用:0次
2024-02-21更新
|
94次组卷
|
6卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高二上学期10月月考化学试题
4 . 已知碘化氢分解吸热,分以下两步完成: ;
; ,下列图像最符合上述反应历程的是
,下列图像最符合上述反应历程的是
 ;
; ,下列图像最符合上述反应历程的是
,下列图像最符合上述反应历程的是A.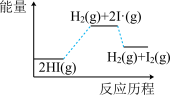 | B.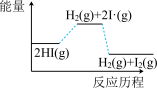 |
C.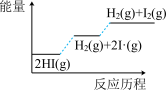 | D.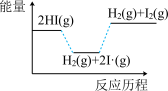 |
您最近一年使用:0次
名校
5 . 下列有关合成氨工业的说法正确的是
A.由于氨易液化, 、 、 在实际生产中可循环使用,所以总体来说合成氨的产率很高 在实际生产中可循环使用,所以总体来说合成氨的产率很高 |
| B.铁触媒作催化剂可加快反应速率,且有利于化学平衡向合成氨的方向移动 |
| C.合成氨工业的反应温度控制在400~500℃,目的是使化学平衡向正反应方向移动 |
D.从合成塔出来的混合气体中 只占15%,故合成氨厂的产率都很低 只占15%,故合成氨厂的产率都很低 |
您最近一年使用:0次
2024-02-20更新
|
88次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高二上学期1月期末化学试题
名校
6 . 下列物质中即含离子键又含共价键的是
A. | B. | C. | D. |
您最近一年使用:0次
名校
解题方法
7 . 前20号不同主族元素 的原子序数依次增大,它们的原子序数之和等于35,分析试剂
的原子序数依次增大,它们的原子序数之和等于35,分析试剂 常用于稀土金属分离的载体、陶瓷上釉等。加热
常用于稀土金属分离的载体、陶瓷上釉等。加热 固体
固体 ,剩余固体质量(m)与温度(T)的关系如图所示。下列叙述正确的是
,剩余固体质量(m)与温度(T)的关系如图所示。下列叙述正确的是

 的原子序数依次增大,它们的原子序数之和等于35,分析试剂
的原子序数依次增大,它们的原子序数之和等于35,分析试剂 常用于稀土金属分离的载体、陶瓷上釉等。加热
常用于稀土金属分离的载体、陶瓷上釉等。加热 固体
固体 ,剩余固体质量(m)与温度(T)的关系如图所示。下列叙述正确的是
,剩余固体质量(m)与温度(T)的关系如图所示。下列叙述正确的是
A.电负性: | B.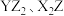 都是直线形分子 都是直线形分子 |
C. 段失去 段失去 分子 分子 | D. 生成的固体化合物为 生成的固体化合物为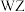 |
您最近一年使用:0次
2024-02-13更新
|
120次组卷
|
3卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高二上学期1月期末化学试题
名校
8 . 已知汽车尾气中的主要污染物为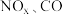 、超细颗粒(
、超细颗粒(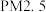 )等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.
)等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.
(1)工业上可采用 和
和 合成甲醇,发生反应为(Ⅰ)
合成甲醇,发生反应为(Ⅰ)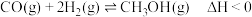
在恒容密闭容器里按体积比为 充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的
充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个 条件后,下列变化能说明平衡一定 向正反应方向移动的是___________ .
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小
(2)①汽车在行驶过程中有如下反应发生:i.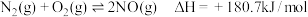
ii.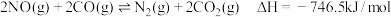
写出表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_____________________________________________ .
②在汽车上安装三元催化转化器可实现反应:
(Ⅱ)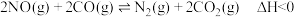 .
.
则该反应在___________ (填高温、低温或任何温度)下能自发进行.
(3)将 和
和 以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中
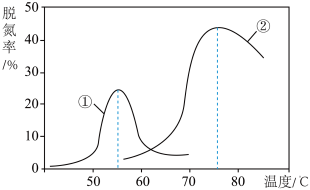
以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(脱氮率即
的含量,从而确定尾气脱氮率(脱氮率即 的转化率),结果如图所示.以下说法正确的是___________
的转化率),结果如图所示.以下说法正确的是___________
(4)用焦炭还原 的反应为:
的反应为: ,在恒温条件下,
,在恒温条件下,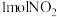 和足量C发生该反应,测得平衡时
和足量C发生该反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
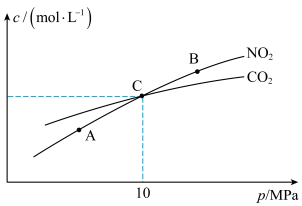
①A、B两点的浓度平衡常数关系: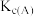
___________ 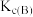 (填“<”或“>”或“=”).
(填“<”或“>”或“=”).
②A、B、C三点中 的转化率最高的是
的转化率最高的是___________ (填“A”或“B”或“C”)点.
③计算C点时该反应的压强平衡常数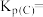
___________ ( 是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(5)在汽车尾气的净化装置中 和
和 发生如下反应:
发生如下反应: .实验测得,
.实验测得,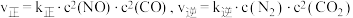 (
( 为速率常数,只与温度有关).
为速率常数,只与温度有关).
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数___________ (填“>”、“<”或“=”) 增大的倍数.
增大的倍数.
②若在 的密闭容器中充入
的密闭容器中充入 和
和 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为40%,则
的转化率为40%,则
___________ (保留2位有效数字).
 、超细颗粒(
、超细颗粒(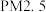 )等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.
)等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.(1)工业上可采用
 和
和 合成甲醇,发生反应为(Ⅰ)
合成甲醇,发生反应为(Ⅰ)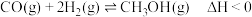
在恒容密闭容器里按体积比为
 充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的
充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小
(2)①汽车在行驶过程中有如下反应发生:i.
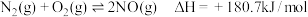
ii.
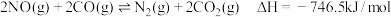
写出表示
 燃烧热的热化学方程式为
燃烧热的热化学方程式为②在汽车上安装三元催化转化器可实现反应:
(Ⅱ)
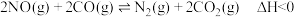 .
.则该反应在
(3)将
 和
和 以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中
以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(脱氮率即
的含量,从而确定尾气脱氮率(脱氮率即 的转化率),结果如图所示.以下说法正确的是___________
的转化率),结果如图所示.以下说法正确的是___________
| A.第②种催化剂比第①种催化剂脱氮率高 |
| B.相同条件下,改变压强对脱氮率没有影响 |
| C.曲线①、②最高点表示此时平衡转化率最高 |
D.两种催化剂分别适宜于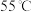 和 和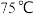 左右脱氮 左右脱氮 |
(4)用焦炭还原
 的反应为:
的反应为: ,在恒温条件下,
,在恒温条件下,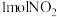 和足量C发生该反应,测得平衡时
和足量C发生该反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:
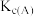
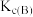 (填“<”或“>”或“=”).
(填“<”或“>”或“=”).②A、B、C三点中
 的转化率最高的是
的转化率最高的是③计算C点时该反应的压强平衡常数
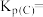
 是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).(5)在汽车尾气的净化装置中
 和
和 发生如下反应:
发生如下反应: .实验测得,
.实验测得,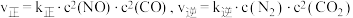 (
( 为速率常数,只与温度有关).
为速率常数,只与温度有关).①达到平衡后,仅升高温度,
 增大的倍数
增大的倍数 增大的倍数.
增大的倍数.②若在
 的密闭容器中充入
的密闭容器中充入 和
和 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为40%,则
的转化率为40%,则
您最近一年使用:0次
2024-02-11更新
|
84次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高二上学期1月期末化学试题
解题方法
9 . “碳中和”目标如期实现的关键技术之一是 的再资源化利用。
的再资源化利用。
(1)氨的饱和食盐水捕获 是其利用的方法之一,反应原理为:
是其利用的方法之一,反应原理为: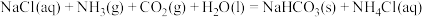 。该反应常温下能自发进行的原因是
。该反应常温下能自发进行的原因是___________ 。
(2)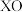 基掺杂
基掺杂 形成
形成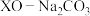 (
(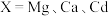 等),能用于捕获
等),能用于捕获 ,原理如下图所示。已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解。
,原理如下图所示。已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解。
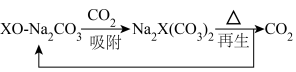
①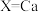 时,再生的化学方程式为
时,再生的化学方程式为___________ 。
②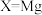 相比
相比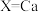 ,其优点有
,其优点有___________ 。
(3)催化电解吸收 的
的 溶液可将
溶液可将 转化为有机物。
转化为有机物。
① 在阴极放电生成
在阴极放电生成 的电极反应式为
的电极反应式为___________ 。
②碱性溶液有利于抑制阴极上副产物的产生,该副产物的化学式为___________ 。
(4)在催化剂作用下,以 和
和 为原料合成
为原料合成 ,主要反应为:
,主要反应为:
反应Ⅰ: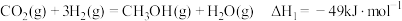
反应Ⅱ:
保持压强 ,将起始
,将起始 的混合气体匀速通过装有催化剂的反应管,测得出口处
的混合气体匀速通过装有催化剂的反应管,测得出口处 的转化率和甲醇的选择性
的转化率和甲醇的选择性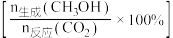 与温度的关系如题图1、题图2所示。
与温度的关系如题图1、题图2所示。
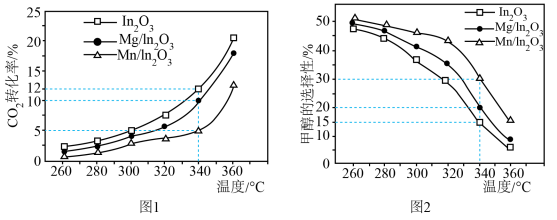
①随着温度的升高, 转化率增大、但甲醇选择性降低的原因是
转化率增大、但甲醇选择性降低的原因是___________ 。
②假设定义催化剂催化效率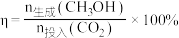 ,计算
,计算 时三种催化剂的催化效率之比
时三种催化剂的催化效率之比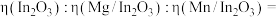
___________ (写出计算过程)。
 的再资源化利用。
的再资源化利用。(1)氨的饱和食盐水捕获
 是其利用的方法之一,反应原理为:
是其利用的方法之一,反应原理为: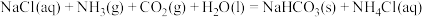 。该反应常温下能自发进行的原因是
。该反应常温下能自发进行的原因是(2)
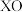 基掺杂
基掺杂 形成
形成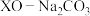 (
(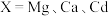 等),能用于捕获
等),能用于捕获 ,原理如下图所示。已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解。
,原理如下图所示。已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解。
①
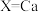 时,再生的化学方程式为
时,再生的化学方程式为②
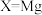 相比
相比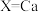 ,其优点有
,其优点有(3)催化电解吸收
 的
的 溶液可将
溶液可将 转化为有机物。
转化为有机物。①
 在阴极放电生成
在阴极放电生成 的电极反应式为
的电极反应式为②碱性溶液有利于抑制阴极上副产物的产生,该副产物的化学式为
(4)在催化剂作用下,以
 和
和 为原料合成
为原料合成 ,主要反应为:
,主要反应为:反应Ⅰ:
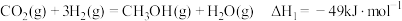
反应Ⅱ:

保持压强
 ,将起始
,将起始 的混合气体匀速通过装有催化剂的反应管,测得出口处
的混合气体匀速通过装有催化剂的反应管,测得出口处 的转化率和甲醇的选择性
的转化率和甲醇的选择性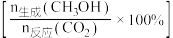 与温度的关系如题图1、题图2所示。
与温度的关系如题图1、题图2所示。
①随着温度的升高,
 转化率增大、但甲醇选择性降低的原因是
转化率增大、但甲醇选择性降低的原因是②假设定义催化剂催化效率
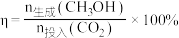 ,计算
,计算 时三种催化剂的催化效率之比
时三种催化剂的催化效率之比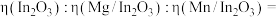
您最近一年使用:0次
2024-02-11更新
|
580次组卷
|
3卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高二上学期1月期末化学试题
名校
10 . 对可逆反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),则下列叙述中正确的是
| A.达到化学平衡时,5v正(O2)=4v逆(NO) |
| B.化学反应速率关系是:2v正(NH3)=3v正(H2O) |
| C.若NH3、O2、NO、H2O的分子数之比为4∶5∶4∶6时,反应达到化学平衡状态 |
| D.若单位时间内生成4nmolNO的同时,生成5nmolO2,则反应达到平衡状态 |
您最近一年使用:0次
2024-02-11更新
|
134次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高二上学期1月期末化学试题



