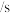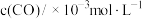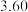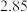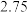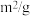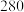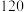23-24高二下·北京·期末
1 . 铁的多种化合物均为磁性材料,氮化铁(FexNy)是其中一种,某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe在元素周期表中的位置___________ 。
(2)丙酮(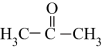 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是___________ ,1mol丙酮分子中含有σ键的数目为___________ mol。
(3)乙醇的晶体类型为___________ ,乙醇分子中C、O、H三种元素中电负性最大的元素是___________ 。
(4)乙醇的沸点(78.3℃)高于丙酮的沸点(56.5℃),原因是___________ 。
(1)Fe在元素周期表中的位置
(2)丙酮(
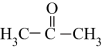 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是(3)乙醇的晶体类型为
(4)乙醇的沸点(78.3℃)高于丙酮的沸点(56.5℃),原因是
您最近一年使用:0次
23-24高二下·北京·期末
解题方法
2 . 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态F原子核外电子的运动状态有___________ 种。
(2)O、F、Cl电负性最小的是___________ ;HClO的电子式为___________ ;OF2的沸点低于Cl2O,原因是___________ 。
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为___________ 。XeF2与水反应时放出氧气和氙气,氟以化合态留在溶液中,该反应的化学方程式为___________ 。
(1)基态F原子核外电子的运动状态有
(2)O、F、Cl电负性最小的是
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
您最近一年使用:0次
23-24高一下·北京·期末
3 . 碳中和是目前社会备受关注的重要议题,碳中和是指 的排放总量和减少总量相当,对于改善环境,实现绿色发展至关重要。
的排放总量和减少总量相当,对于改善环境,实现绿色发展至关重要。
为发展低碳经济,科学家提出可以用氧化锆锌作催化剂,将 转化为重要有机原料
转化为重要有机原料 ,该反应的化学方程式为
,该反应的化学方程式为 。在容积为
。在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和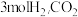 和
和 的物质的量随时间变化的曲线如图所示。分析图中数据,回答下列问题。
的物质的量随时间变化的曲线如图所示。分析图中数据,回答下列问题。 内,
内,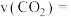
___________ mol·L-1·min-1.
(2) 时,反应是否达到化学平衡?
时,反应是否达到化学平衡?___________ (填“是”或“否”);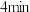 时,正反应速率
时,正反应速率___________ 逆反应速率(填“>”“<”或“=”); 时,将容器的容积变为
时,将容器的容积变为 ,此时化学反应速率
,此时化学反应速率___________ (填“增大”、“减小”或“不变”)。
(3)对于上述反应,下列叙述正确的是___________ 。
a.当各气体的物质的量不再改变时,该反应已达平衡状态。
b.当该反应达到平衡后,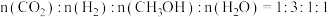 。
。
c.由图可知, 时
时 的生成速率大于
的生成速率大于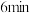 时
时 的分解速率。
的分解速率。
d.提高反应的温度,可以实现 的完全转化
的完全转化
 的排放总量和减少总量相当,对于改善环境,实现绿色发展至关重要。
的排放总量和减少总量相当,对于改善环境,实现绿色发展至关重要。为发展低碳经济,科学家提出可以用氧化锆锌作催化剂,将
 转化为重要有机原料
转化为重要有机原料 ,该反应的化学方程式为
,该反应的化学方程式为 。在容积为
。在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和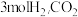 和
和 的物质的量随时间变化的曲线如图所示。分析图中数据,回答下列问题。
的物质的量随时间变化的曲线如图所示。分析图中数据,回答下列问题。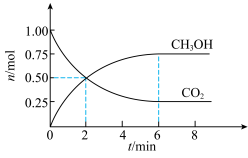
 内,
内,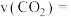
(2)
 时,反应是否达到化学平衡?
时,反应是否达到化学平衡?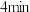 时,正反应速率
时,正反应速率 时,将容器的容积变为
时,将容器的容积变为 ,此时化学反应速率
,此时化学反应速率(3)对于上述反应,下列叙述正确的是
a.当各气体的物质的量不再改变时,该反应已达平衡状态。
b.当该反应达到平衡后,
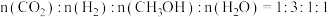 。
。c.由图可知,
 时
时 的生成速率大于
的生成速率大于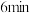 时
时 的分解速率。
的分解速率。d.提高反应的温度,可以实现
 的完全转化
的完全转化
您最近一年使用:0次
名校
4 . 利用催化技术可将汽车尾气中的CO和NO转化为 和
和 ,化学方程式:
,化学方程式: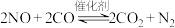 。
。
(1)某温度下,在恒容的密闭容器中通入CO和NO,测得不同时间CO的浓度如下表:
用CO的浓度变化表示0-2s的平均反应速率为______  。
。
(2)下列可说明反应达到平衡状态的是______ 。
a.CO的浓度不再改变
b.容器中的气体质量保持不变
c.NO、CO、 、
、 的浓度之比为2∶2∶2∶1
的浓度之比为2∶2∶2∶1
d.相同时间内,反应消耗2molNO同时消耗
(3)反应物初始浓度相同时,实验温度为280℃和360℃,进行以下实验:
【实验分析与结论】
①补全表格a.______ ,b.______ ,c.______ 。
②测得 ,对比实验Ⅰ、Ⅲ,可得结论:
,对比实验Ⅰ、Ⅲ,可得结论:______ 。
③通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验Ⅰ、Ⅱ,
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
 和
和 ,化学方程式:
,化学方程式: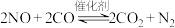 。
。(1)某温度下,在恒容的密闭容器中通入CO和NO,测得不同时间CO的浓度如下表:
时间 |
|
|
|
| …… |
|
|
|
|
| …… |
 。
。(2)下列可说明反应达到平衡状态的是
a.CO的浓度不再改变
b.容器中的气体质量保持不变
c.NO、CO、
 、
、 的浓度之比为2∶2∶2∶1
的浓度之比为2∶2∶2∶1d.相同时间内,反应消耗2molNO同时消耗

(3)反应物初始浓度相同时,实验温度为280℃和360℃,进行以下实验:
实验编号 | 实验目的 |
| 同种催化剂的比表面积 | 达平衡时所用的时间 |
Ⅰ | 对照实验 |
|
|
|
Ⅱ |
|
|
|
|
Ⅲ | 研究温度对尾气转化速率的影响 |
|
|
|
①补全表格a.
②测得
 ,对比实验Ⅰ、Ⅲ,可得结论:
,对比实验Ⅰ、Ⅲ,可得结论:③通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验Ⅰ、Ⅱ,

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
2024-05-08更新
|
179次组卷
|
6卷引用:北京市西城区2020-2021学年高一下学期期末联考化学试题
北京市西城区2020-2021学年高一下学期期末联考化学试题(已下线)重难点02 速率与平衡综合题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)北京市第十四中学2022-2023学年高一下学期期中化学试题北京市第三中学2022-2023学年高一下学期期中考试化学试题北京市第二十二中学2023-2024学年高一下学期期中考试化学试题名校期末好题汇编-化学反应与能量(非选择题)
解题方法
5 . 有以下6种元素,其中R、W、X、Y、M是原子序数依次增大的五种短周期元素,R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2.工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与X是同一主族的元素,且在元素周期表中与X相邻。Q是第4周期第Ⅷ族元素,它的一种复杂的化合物是具有磁性的黑色晶体。
(1)若R的一种原子中质子数和中子数相等,则R的原子组成符号为___________ ;R2Y、R2X都属于___________ (填“离子”或“共价”)化合物。W在元素周期表中的位置___________ 。
(2)M是生活中常见的一种元素,它能与很多元素形成化合物。
①用电子式表示RM的形成过程___________ 。
②如图所示,将M单质水溶液滴入试管中。试管中的实验现象为___________ 。___________ 。
③MX2是一种高效消毒剂,工业上用其处理中性废水中的锰,使 转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为
转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为___________ 。
(3)元素硒(Se)的原子结构示意图为
根据元素周期律,下列推断正确的是___________ (填字母序号)
a.Se位于第4周期、与Y同主族 b.Se的最低负化合价为-2价
c.SeO2具有还原性 d.H2Se的还原性比H2Y强
e.H2SeO3的酸性强于H2SO4 f.SeO2在一定条件下可与NaOH溶液反应
(4)下列事实能判断元素金属性强弱的是___________ (填字母)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(1)若R的一种原子中质子数和中子数相等,则R的原子组成符号为
(2)M是生活中常见的一种元素,它能与很多元素形成化合物。
①用电子式表示RM的形成过程
②如图所示,将M单质水溶液滴入试管中。试管中的实验现象为

③MX2是一种高效消毒剂,工业上用其处理中性废水中的锰,使
 转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为
转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为(3)元素硒(Se)的原子结构示意图为

根据元素周期律,下列推断正确的是
a.Se位于第4周期、与Y同主族 b.Se的最低负化合价为-2价
c.SeO2具有还原性 d.H2Se的还原性比H2Y强
e.H2SeO3的酸性强于H2SO4 f.SeO2在一定条件下可与NaOH溶液反应
(4)下列事实能判断元素金属性强弱的是
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
您最近一年使用:0次
名校
解题方法
6 . 下列装置用于实验室制氨气或验证氨气的化学性质,其中能达到实验目的的是
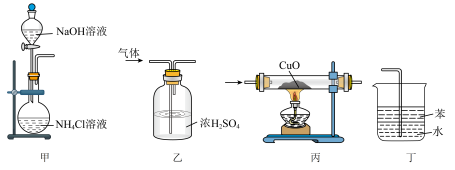
| A.用装置甲制取氨气 | B.用装置乙除去氨气中的水蒸气 |
| C.用装置丙验证氨气具有还原性 | D.用装置丁吸收尾气 |
您最近一年使用:0次
2024-05-05更新
|
300次组卷
|
13卷引用:北京市育英学校2023-2024学年高一上学期期末考试化学试题
北京市育英学校2023-2024学年高一上学期期末考试化学试题江苏省泰州市2023-2024学年高一上学期1月期末化学试题云南省开远市第一中学校2022-2023学年高一下学期期中考试化学试题四川省什邡中学2022-2023学年高一下学期第一次月考化学试题(已下线)专题03 常见气体的实验室制取(考点清单)(讲+练)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)湖北省武汉市第十二中学2023-2024学年高一下学期3月月考化学试题广东省潮州市饶平县第二中学2023-2024学年高一下学期第一次月考化学试题江西省南昌十九中2022-2023学年高一下学期3月第一次月考化学试卷山东省济宁市微山县第二中学2023-2024学年高一下学期第一次月考化学试题江苏省扬州中学2023-2024学年高一下学期4月期中考试化学试题安徽省淮南市第二中2023-2024学年高一下学期第一次月考化学试题四川省射洪中学校2023-2024学年高一下学期4月第一次月考化学试题湖北省咸宁市崇阳县第二高级中学2023-2024学年高一下学期3月月考化学试题
7 . 下列化学用语不正确 的是
A.氮分子的电子式:  |
B.基态 原子的价电子轨道表示式: 原子的价电子轨道表示式: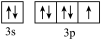 |
C.基态 的价电子排布式: 的价电子排布式: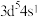 |
D. 分子的空间结构模型: 分子的空间结构模型: |
您最近一年使用:0次
8 . 二氧化氯(ClO2)具体以强氧化性,是一种比较安全的消毒剂。实验小组以氯气和亚氯酸钠(NaClO2)为原料制备二氧化氯(ClO2)并探究其性质。
资料:ⅰ.ClO2为黄绿色气体,易溶于水,难溶于CCl4;Cl2易溶于CCl4中,溶液呈黄绿色。
ⅱ.CCl4为无色液体,密度比水大,且与水不互溶。
ⅲ.NaClO2溶液呈弱碱性,在酸性溶液中,NaClO2易发生下列反应: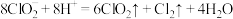 。
。
【实验一:制备ClO2】进行如下图所示实验,实验过程中,持续通入N2使C中生成的ClO2逸出。___________ 。
(2)装置B中饱和NaCl溶液的作用是___________ 。
(3)装置C中制备ClO2的反应为 ,由此得到此条件下的氧化性:Cl2
,由此得到此条件下的氧化性:Cl2___________ ClO2(填“>”或“<”)。
(4)装置C中Cl2还能发生的反应为___________ (用化学方程式表示)。
随着装置A中的Cl2持续产生,开始时装置D液面上方出现黄绿色气体,溶液较长一段时间保持无色,随后逐渐变为黄绿色,说明有Cl2进入D中。
【实验二:探究ClO2的性质】
将实验一中收集到的气体处理后得到纯净的ClO2,进行下表所示实验。
(5)实验二中,证明ClO2能氧化 产生Cl2的现象是
产生Cl2的现象是___________ 。
(6)由实验一、实验二得到的Cl2和ClO2氧化性强弱关系相反,可能的原因是___________ 。
【实验反思】
(7)甲同学从实验二推论实验一的装置D中Cl2的来源:实验进行一段时间后,装置C中的ClO2氧化 ,产生的Cl2进入装置D.乙同学提出还有其他以下可能的来源。
,产生的Cl2进入装置D.乙同学提出还有其他以下可能的来源。
来源1:部分Cl2未与C中NaClO2反应就进入了装置D。
来源2:Cl2通入装置C中一段时间后,___________ ,生成的Cl2进入了装置D.
资料:ⅰ.ClO2为黄绿色气体,易溶于水,难溶于CCl4;Cl2易溶于CCl4中,溶液呈黄绿色。
ⅱ.CCl4为无色液体,密度比水大,且与水不互溶。
ⅲ.NaClO2溶液呈弱碱性,在酸性溶液中,NaClO2易发生下列反应:
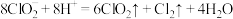 。
。【实验一:制备ClO2】进行如下图所示实验,实验过程中,持续通入N2使C中生成的ClO2逸出。
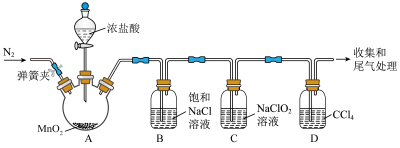
(2)装置B中饱和NaCl溶液的作用是
(3)装置C中制备ClO2的反应为
 ,由此得到此条件下的氧化性:Cl2
,由此得到此条件下的氧化性:Cl2(4)装置C中Cl2还能发生的反应为
随着装置A中的Cl2持续产生,开始时装置D液面上方出现黄绿色气体,溶液较长一段时间保持无色,随后逐渐变为黄绿色,说明有Cl2进入D中。
【实验二:探究ClO2的性质】
将实验一中收集到的气体处理后得到纯净的ClO2,进行下表所示实验。
| 实验ⅰ | 将ClO2通入NaCl溶液,溶液变为黄绿色、加入少量CCl4振荡,静置后溶液分层,上层溶液为黄绿色,下层溶液为无色。 |
| 实验ⅱ | 将ClO2通入HCl溶液,溶液变为黄绿色。加入少量CCl4振荡,静置。溶液分层,上层溶液为浅黄绿色,下层溶液为黄绿色。 |
(5)实验二中,证明ClO2能氧化
 产生Cl2的现象是
产生Cl2的现象是(6)由实验一、实验二得到的Cl2和ClO2氧化性强弱关系相反,可能的原因是
【实验反思】
(7)甲同学从实验二推论实验一的装置D中Cl2的来源:实验进行一段时间后,装置C中的ClO2氧化
 ,产生的Cl2进入装置D.乙同学提出还有其他以下可能的来源。
,产生的Cl2进入装置D.乙同学提出还有其他以下可能的来源。来源1:部分Cl2未与C中NaClO2反应就进入了装置D。
来源2:Cl2通入装置C中一段时间后,
您最近一年使用:0次
9 . 已知下述三个实验均能发生化学反应:
下列判断正确的是
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
| A.实验①中铁钉只作还原剂 | B.实验②中 既显氧化性又显还原性 既显氧化性又显还原性 |
| C.实验③中发生的是置换反应 | D.上述实验证明氧化性: |
您最近一年使用:0次
10 . 下列物质属于电解质的是
| A.氯水 | B.CO2 | C.NaCl溶液 | D.KOH |
您最近一年使用:0次