解题方法
1 . 温度分别为 、
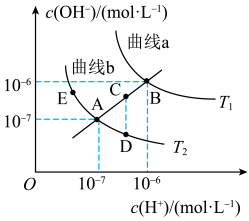
、 时,水的电离平衡曲线如图所示,曲线上的点都符合
时,水的电离平衡曲线如图所示,曲线上的点都符合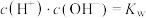 ,下列说法正确的是
,下列说法正确的是
 、
、 时,水的电离平衡曲线如图所示,曲线上的点都符合
时,水的电离平衡曲线如图所示,曲线上的点都符合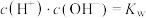 ,下列说法正确的是
,下列说法正确的是
A.图中温度: |
B.图中五点 间的关系: 间的关系: |
| C.曲线a、b均代表纯水的电离情况 |
D.B点时,将 的盐酸与 的盐酸与 的NaOH溶液等体积混合后,溶液呈中性 的NaOH溶液等体积混合后,溶液呈中性 |
您最近一年使用:0次
2 .  、CO是常见的气体污染物,将其进行无害化处理是保护环境的重要举措。回答下列问题:
、CO是常见的气体污染物,将其进行无害化处理是保护环境的重要举措。回答下列问题:
(1)对于反应 来说,“
来说,“ ”可作为此反应的催化剂。其总反应分两步进行,第一步反应为
”可作为此反应的催化剂。其总反应分两步进行,第一步反应为 ,则第二步反应为
,则第二步反应为_____ 。已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能_____ (填“大于”或“小于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中充入相应的气体,各气体的起始物质的量见下表。
发生反应: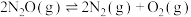 ,容器I、Ⅱ、Ⅲ中
,容器I、Ⅱ、Ⅲ中 的平衡转化率随温度变化的曲线如图所示。
的平衡转化率随温度变化的曲线如图所示。

①该反应为_____ (填“吸热”或“放热”)反应,容器I、Ⅱ、Ⅲ的容积由大到小的顺序为_____ (用I、Ⅱ、Ⅲ表示)。
②若容器I的体积为2L,反应在370℃下进行,10s后达到平衡,则0~10s内容器I中用 表示的反应速率为
表示的反应速率为_____  。B点对应的平衡常数
。B点对应的平衡常数
_____ (保留两位有效数字)。
③若容器Ⅳ的体积为1L,反应在370℃下进行,则起始时反应向_____ (填“正反应方向”或“逆反应方向”)进行。
 、CO是常见的气体污染物,将其进行无害化处理是保护环境的重要举措。回答下列问题:
、CO是常见的气体污染物,将其进行无害化处理是保护环境的重要举措。回答下列问题:(1)对于反应
 来说,“
来说,“ ”可作为此反应的催化剂。其总反应分两步进行,第一步反应为
”可作为此反应的催化剂。其总反应分两步进行,第一步反应为 ,则第二步反应为
,则第二步反应为(2)在四个不同容积的恒容密闭容器中充入相应的气体,各气体的起始物质的量见下表。
| 起始物质的量/mol 容器 |  |  |  |
| I | 0.1 | 0 | 0 |
| Ⅱ | 0.1 | 0 | 0 |
| Ⅲ | 0.1 | 0 | 0 |
| Ⅳ | 0.3 | 0.3 | 0.15 |
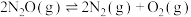 ,容器I、Ⅱ、Ⅲ中
,容器I、Ⅱ、Ⅲ中 的平衡转化率随温度变化的曲线如图所示。
的平衡转化率随温度变化的曲线如图所示。
①该反应为
②若容器I的体积为2L,反应在370℃下进行,10s后达到平衡,则0~10s内容器I中用
 表示的反应速率为
表示的反应速率为 。B点对应的平衡常数
。B点对应的平衡常数
③若容器Ⅳ的体积为1L,反应在370℃下进行,则起始时反应向
您最近一年使用:0次
解题方法
3 . 电离是电解质在水溶液中的主要行为之一。回答下列问题:
(1)室温下,现有a.盐酸,b.硫酸,c.醋酸三种酸。
①这三种酸溶液中存在两种电离平衡的是_____ (填名称);当这三种酸体积相同,物质的量浓度相同时,使其恰好完全反应所需NaOH的物质的量由大到小的顺序是_____ (用a、b、c表示,下同)。
②当这三种酸中的 均为
均为 且体积相同时,分别放入足量的锌,相同状况下产生
且体积相同时,分别放入足量的锌,相同状况下产生 的体积由大到小的顺序是
的体积由大到小的顺序是_____ 。
(2)现用中和滴定法测定某NaOH溶液的浓度,有关数据记录如表:
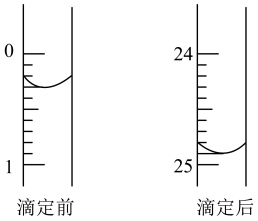
①用_____ 式滴定管盛装 盐酸标准液。如图表示第3次滴定前后50mL滴定管中液面的位置。该次滴定所用标准盐酸体积为
盐酸标准液。如图表示第3次滴定前后50mL滴定管中液面的位置。该次滴定所用标准盐酸体积为_____ mL。
②实验室中有石蕊和酚酞两种指示剂,该实验应选用_____ 作指示剂。
③根据实验1、2所给数据计算,该NaOH试样的物质的量浓度为_____ 。
④若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果_____ (填“偏低”“偏高”或“无影响”)。
(1)室温下,现有a.盐酸,b.硫酸,c.醋酸三种酸。
①这三种酸溶液中存在两种电离平衡的是
②当这三种酸中的
 均为
均为 且体积相同时,分别放入足量的锌,相同状况下产生
且体积相同时,分别放入足量的锌,相同状况下产生 的体积由大到小的顺序是
的体积由大到小的顺序是(2)现用中和滴定法测定某NaOH溶液的浓度,有关数据记录如表:
| 实验序号 | 待测液体积/mL | 所消耗盐酸标准液的体积/mL | ||
| 滴定前读数 | 滴定后读数 | 消耗的体积 | ||
| 1 | 20.00 | 0.50 | 26.80 | 26.30 |
| 2 | 20.00 | 5.00 | 31.34 | 26.34 |
| 3 | 20.00 | - | - | - |
 盐酸标准液。如图表示第3次滴定前后50mL滴定管中液面的位置。该次滴定所用标准盐酸体积为
盐酸标准液。如图表示第3次滴定前后50mL滴定管中液面的位置。该次滴定所用标准盐酸体积为
②实验室中有石蕊和酚酞两种指示剂,该实验应选用
③根据实验1、2所给数据计算,该NaOH试样的物质的量浓度为
④若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果
您最近一年使用:0次
2024-03-14更新
|
15次组卷
|
2卷引用:湖北省鄂州市部分高中教科研协作体2023-2024学年高二上学期11月期中考试化学试题
4 . 室温下,体积均为10mL、pH均为11的氨水和NaOH溶液分别加水稀释至原体积的100倍,溶液的pH随溶液体积变化的曲线如图所示。下列说法正确的是
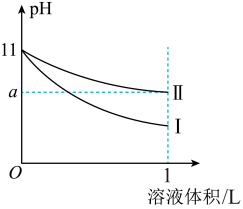

A. |
| B.Ⅱ为NaOH溶液稀释时溶液的pH变化曲线 |
| C.完全中和1L两溶液,消耗相同浓度的稀盐酸溶液的体积:NaOH溶液<氨水 |
| D.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大 |
您最近一年使用:0次
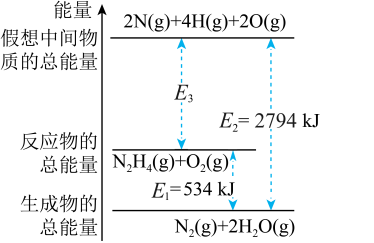
5 . 肼 是一种高能燃料,有关化学反应的能量变化如图所示(图中对应的能量数据是每摩尔反应的能量变化值)。已知断裂1mol化学键吸收的能量(kJ):
是一种高能燃料,有关化学反应的能量变化如图所示(图中对应的能量数据是每摩尔反应的能量变化值)。已知断裂1mol化学键吸收的能量(kJ): 为942、
为942、 为500、
为500、 为391,则形成
为391,则形成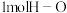 键放出的能量是
键放出的能量是
 是一种高能燃料,有关化学反应的能量变化如图所示(图中对应的能量数据是每摩尔反应的能量变化值)。已知断裂1mol化学键吸收的能量(kJ):
是一种高能燃料,有关化学反应的能量变化如图所示(图中对应的能量数据是每摩尔反应的能量变化值)。已知断裂1mol化学键吸收的能量(kJ): 为942、
为942、 为500、
为500、 为391,则形成
为391,则形成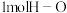 键放出的能量是
键放出的能量是
| A.194kJ | B.463kJ | C.391kJ | D.658kJ |
您最近一年使用:0次
解题方法
6 . 晶体硅是重要的半导体材料。工业上用石英砂作原料通过如下反应生产晶体硅:
①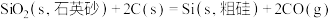
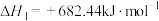
②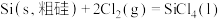

③
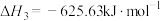
则用石英砂生产28g纯硅理论上放出的热量为
①
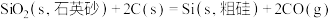
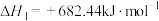
②
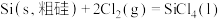

③

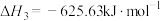
则用石英砂生产28g纯硅理论上放出的热量为
| A.21.44kJ | B.600.20kJ | C.1965.10kJ | D.21435.71kJ |
您最近一年使用:0次
解题方法
7 . 下列热化学方程式及有关应用的叙述中,正确的是
A. 的燃烧热为 的燃烧热为 ,则 ,则 燃烧的热化学方程式可表示为 燃烧的热化学方程式可表示为 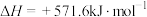 |
B.取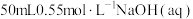 和 和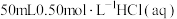 进行中和反应反应热的测定,用温度计测定 进行中和反应反应热的测定,用温度计测定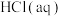 起始温度后,直接测定 起始温度后,直接测定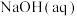 的温度,会使中和反应反应热 的温度,会使中和反应反应热 偏小 偏小 |
C.500℃、30MPa下,将 和 和 置于密闭的容器中充分反应生成 置于密闭的容器中充分反应生成 ,放热19.3kJ,其热化学方程式为 ,放热19.3kJ,其热化学方程式为 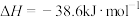 |
D.已知25℃、101KPa条件下: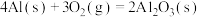  , ,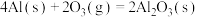 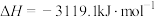 ,则 ,则 比 比 稳定 稳定 |
您最近一年使用:0次
8 . 化学与生产、生活密切相关。下列事实不能用平衡移动原理解释的是
| A.开启碳酸饮料瓶后,瓶内立即泛起大量泡沫 |
B.由 、 、 、 、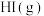 组成的平衡体系通过缩小体积加压后颜色变深 组成的平衡体系通过缩小体积加压后颜色变深 |
| C.实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出 |
| D.合成氨过程中使用过量的氮气以提高氢气的转化率 |
您最近一年使用:0次
名校
解题方法
9 . 下列关于溶液酸碱性说法中正确的是
A.100℃时,纯水的 ,呈酸性 ,呈酸性 |
B.室温下,由水电离的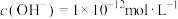 的溶液不一定显碱性 的溶液不一定显碱性 |
| C.室温下,将pH之和为14的酸和碱溶液等体积混合,所得混合溶液一定呈中性 |
D.某温度下, 、 、 的NaOH溶液,该温度下, 的NaOH溶液,该温度下,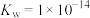 |
您最近一年使用:0次
2024-03-02更新
|
81次组卷
|
2卷引用:湖北省鄂州市部分高中教科研协作体2023-2024学年高二上学期11月期中考试化学试题
解题方法
10 . 现有四种阳离子Na+,Ba2+、Mg2+、H+和四种阴离子OH-、Cl-、 、
、 可分别组成A、B、C、D四种易溶于水易电离的物质(离子均不重复)。物质A、B、C、D有以下性质:
可分别组成A、B、C、D四种易溶于水易电离的物质(离子均不重复)。物质A、B、C、D有以下性质:
①溶液A能使紫色石蕊试液变红,且溶液中阴阳离子个数比为1:2;
②溶液B分别与A、C、D溶液混合,均有白色沉淀生成;
③溶液C能与溶液A反应产生无色无味气体。
已知: + OH-=
+ OH-= +H2O
+H2O
回答下列问题:
(1)物质A的化学式为_______ ,物质B溶于水显_______ 性。
(2)物质D中阳离子为_______ (填离子符号)。
(3)溶液B与溶液C反应生成的白色沉淀为_______ (填化学式,下同),溶液B与溶液D反应生成的白色沉淀为_______ 。
(4)验证溶液D中阴离子的方法为_______ 。
(5)溶液A与过量溶液B发生反应的离子方程式为_______ 。
 、
、 可分别组成A、B、C、D四种易溶于水易电离的物质(离子均不重复)。物质A、B、C、D有以下性质:
可分别组成A、B、C、D四种易溶于水易电离的物质(离子均不重复)。物质A、B、C、D有以下性质:①溶液A能使紫色石蕊试液变红,且溶液中阴阳离子个数比为1:2;
②溶液B分别与A、C、D溶液混合,均有白色沉淀生成;
③溶液C能与溶液A反应产生无色无味气体。
已知:
 + OH-=
+ OH-= +H2O
+H2O回答下列问题:
(1)物质A的化学式为
(2)物质D中阳离子为
(3)溶液B与溶液C反应生成的白色沉淀为
(4)验证溶液D中阴离子的方法为
(5)溶液A与过量溶液B发生反应的离子方程式为
您最近一年使用:0次



