名校
1 . 我国科学家将聚酰亚胺(组成元素为H、C、N、O等)介电聚合物与高绝缘纳米氧化镁(MgO)填料混合,成功制得聚酰亚胺/纳米氧化镁复合材料。该复合材料特点为具有高击穿强度、宽温度范围和低介电损耗。结合所学知识,回答下列问题。
(1)基态Mg原子的电子排布式为_________ 。
(2)C、N、O第一电离能由大到小的顺序为_________ ;C、N、O电负性由大到小的顺序为_________ ,理由是________________ 。
(3) 三种分子的空间结构和相应的键角如图1所示。
三种分子的空间结构和相应的键角如图1所示。 中O的未成对电子所在原子轨道的形状为
中O的未成对电子所在原子轨道的形状为_________ ; 的沸点比
的沸点比 的高,其主要原因是
的高,其主要原因是__________ ; 的键角大于
的键角大于 的键角,其原因是
的键角,其原因是________ 。
(1)基态Mg原子的电子排布式为
(2)C、N、O第一电离能由大到小的顺序为
(3)
 三种分子的空间结构和相应的键角如图1所示。
三种分子的空间结构和相应的键角如图1所示。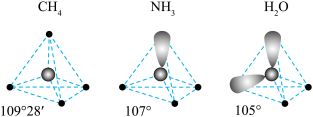
 中O的未成对电子所在原子轨道的形状为
中O的未成对电子所在原子轨道的形状为 的沸点比
的沸点比 的高,其主要原因是
的高,其主要原因是 的键角大于
的键角大于 的键角,其原因是
的键角,其原因是
您最近一年使用:0次
名校
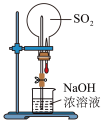
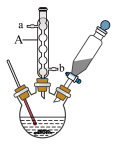
2 . 苯甲酸是一种重要原料。实验室可以用甲苯与高锰酸钾反应制得苯甲酸,反应装置图和有关数据如下:
合成步骤如下:
①在三颈烧瓶中加入5.4mL甲苯和30mL稀硫酸,放入碎瓷片,加热至沸腾时再迅速加入12.8g高锰酸钾固体,继续加热到甲苯层消失,过滤;
②反应后的溶液仍呈紫色,在容器中加入适量亚硫酸氢钠溶液,振荡,直到溶液变为无色,搅拌下向容器中加入足量浓盐酸;待反应完全后,将反应容器放在冰水浴中冷却,析出晶体,过滤,洗涤,干燥,称量。
(1)仪器A的名称是____________ ,它的作用是____________ 。
(2)加入碎瓷片的作用是____________ 。
(3)加入亚硫酸氢钠溶液使紫色褪去时发生反应的离子方程式为________________________ 。
(4)若得到的苯甲酸晶体产品不纯,则采用____________ 方法可得到纯度更高的产品。
(5)下列有关苯甲酸重结晶实验的说法正确的是_________ (填字母)。
A.粗苯甲酸溶解过程中,加热、玻璃棒搅拌均能提高苯甲酸的溶解度
B.在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还需加少量蒸馏水
C.冷却结晶时,温度过低将析出杂质,故此时温度不是越低越好
(6)若最后得到纯净的苯甲酸质量为4.0g,则该反应的产率是____________ (保留一位小数)。
物质 | 熔点/℃ | 沸点/℃ | 水中溶解度/g(25℃) | 相对分子质量 | 密度/( |
甲苯 |
| 110.6 | 难溶 | 92 | 0.85 |
苯甲酸 | 122.13 | 249 | 0.344 | 122 | 1.27 |
①在三颈烧瓶中加入5.4mL甲苯和30mL稀硫酸,放入碎瓷片,加热至沸腾时再迅速加入12.8g高锰酸钾固体,继续加热到甲苯层消失,过滤;
②反应后的溶液仍呈紫色,在容器中加入适量亚硫酸氢钠溶液,振荡,直到溶液变为无色,搅拌下向容器中加入足量浓盐酸;待反应完全后,将反应容器放在冰水浴中冷却,析出晶体,过滤,洗涤,干燥,称量。
已知: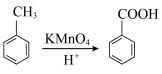 。
。
(1)仪器A的名称是
(2)加入碎瓷片的作用是
(3)加入亚硫酸氢钠溶液使紫色褪去时发生反应的离子方程式为
(4)若得到的苯甲酸晶体产品不纯,则采用
(5)下列有关苯甲酸重结晶实验的说法正确的是
A.粗苯甲酸溶解过程中,加热、玻璃棒搅拌均能提高苯甲酸的溶解度
B.在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还需加少量蒸馏水
C.冷却结晶时,温度过低将析出杂质,故此时温度不是越低越好
(6)若最后得到纯净的苯甲酸质量为4.0g,则该反应的产率是
您最近一年使用:0次
名校
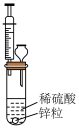
3 . 非金属单质A经下图所示的过程可转化为含氧酸D,已知D为强酸。请回答下列问题.

(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体;
①D的化学式为______________ ;
②在工业生产中,B气体大量排放,被雨水吸收后形成的______________ 会污染环境;
③98.3%的D溶液是常见的气体干燥剂,但它不能干燥 和
和 ,原因是
,原因是______________ ;
(2)若A在常温下为气体,C是红棕色的气体;
①A、C的化学式分别为_________ 、___________ ;
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为________ ,该反应_______ (填“属于”或“不属于”)氧化还原反应;
③工业上利用氨制备D,写出氨被催化氧化生成B气体的化学方程式:____________ 。

(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体;
①D的化学式为
②在工业生产中,B气体大量排放,被雨水吸收后形成的
③98.3%的D溶液是常见的气体干燥剂,但它不能干燥
 和
和 ,原因是
,原因是(2)若A在常温下为气体,C是红棕色的气体;
①A、C的化学式分别为
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为
③工业上利用氨制备D,写出氨被催化氧化生成B气体的化学方程式:
您最近一年使用:0次
名校
解题方法
4 . 下列实验操作合理且能达到相应目的的是
|
|
A.制备并收集 | B.测定Zn与稀硫酸反应的反应速率 |
|
|
C.制备适量 | D.进行喷泉实验 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-06-07更新
|
124次组卷
|
2卷引用:甘肃省白银市2023-2024学年高一下学期期中考试化学试题
名校
解题方法
5 . 下列化学用语或表述正确的是
A.生石膏的化学式: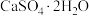 | B. 的电子式: 的电子式: |
C. 的结构式: 的结构式: | D. 中的共价键类型:非极性键 中的共价键类型:非极性键 |
您最近一年使用:0次
2024-05-08更新
|
80次组卷
|
2卷引用:甘肃省白银市2023-2024学年高一下学期期中考试化学试题
解题方法
6 . 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图中方式插入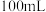 相同浓度的稀硫酸中一段时间,回答下列问题:
相同浓度的稀硫酸中一段时间,回答下列问题:___________ 。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的 均增大
均增大
②相同时间内,甲、乙中产生气泡的速度:甲___________ 乙(填“ ”“
”“ ”或“
”或“ ”)。
”)。
③请写出图中构成原电池的负极电极反应式:___________ 。 构成原电池的装置工作时,溶液中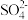 向
向 ___________ 极移动。
④当乙中产生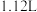 (标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至
(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至 ,测得溶液中
,测得溶液中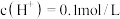 (设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为
(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为___________ 。
(2)当甲中产生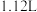 (标准状况)气体时,理论上通过导线的电子数目为
(标准状况)气体时,理论上通过导线的电子数目为___________ 。
(3)若将反应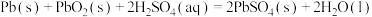 设计成原电池。用导线连接金属
设计成原电池。用导线连接金属 和
和 ,电解质为稀硫酸。
,电解质为稀硫酸。
①正极为___________ (填“ ”或“
”或“ ”)极。
”)极。
(1)将纯锌片和纯铜片按图中方式插入
 相同浓度的稀硫酸中一段时间,回答下列问题:
相同浓度的稀硫酸中一段时间,回答下列问题: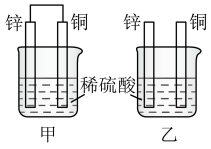
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的
 均增大
均增大②相同时间内,甲、乙中产生气泡的速度:甲
 ”“
”“ ”或“
”或“ ”)。
”)。③请写出图中构成原电池的负极电极反应式:
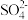 向
向 ④当乙中产生
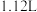 (标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至
(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至 ,测得溶液中
,测得溶液中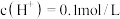 (设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为
(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为(2)当甲中产生
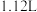 (标准状况)气体时,理论上通过导线的电子数目为
(标准状况)气体时,理论上通过导线的电子数目为(3)若将反应
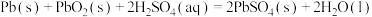 设计成原电池。用导线连接金属
设计成原电池。用导线连接金属 和
和 ,电解质为稀硫酸。
,电解质为稀硫酸。①正极为
 ”或“
”或“ ”)极。
”)极。
您最近一年使用:0次
7 . 下列关于价电子排布3s23p4的描述正确的是
| A.它的元素符号为O |
| B.它的核外电子排布式为1s22s22p63s23p4 |
| C.可以与H2化合生成液态化合物 |
D.其电子排布图为 |
您最近一年使用:0次
2024-04-13更新
|
232次组卷
|
44卷引用:甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(普通班)
甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(普通班)(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2011-2012学年内蒙古包头三十三中高二下学期期中考试化学试卷(已下线)2011-2012学年河南许昌鄢陵一高高二下学期期中考试化学试卷(已下线)2012-2013学年山东省淄博市沂源一中高二下学期期中模块检测化学卷(已下线)2012-2013学年山东省济南一中高二下学期期中考试理科化学试卷(已下线)2013-2014学年福建省厦门一中高二上学期期中考试化学试卷2013-2014山东省即墨市高二下学期期中考试化学试卷宁夏育才中学2016-2017学年高二下学期期中考试化学试题江苏省盘湾中学、陈洋中学2017-2018学年高二上学期期中联考(选修)化学试题新疆维吾尔自治区北京大学附属中学新疆分校2018-2019学年高二下学期期中考试化学试题广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题湖北省仙桃市汉江中学2018-2019学年高二下学期期中考试化学试题宁夏石嘴山市平罗中学2021-2022学年高二上学期期中考试化学试题(已下线)选择题6-10(已下线)吉林一中2009--2010学年度下学期期末考试第一次质量检测高二化学试卷(已下线)2012届浙江省杭州高中高三第二次月考化学试卷2015-2016学年西藏日喀则一中高二10月月考化学试卷2015-2016学年贵州省思南中学高二下第二次月考化学试卷2016-2017学年高中化学选修3(人教版)模块综合测评【全国校级联考】新疆昌吉市教育共同体四校2017-2018学年高二下学期期末联考化学试题云南省武定县第一中学2018-2019学年高二上学期12月份考试化学试题云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高二上学期期末考试化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题福建省长泰县第一中学2018-2019学年高二下学期期末考试化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题江苏省盐城市伍佑中学2019-2020学年高二下学期第一次阶段考试化学试题湖北省武汉市黄陂区第六中学2019-2020学年高二下学期三月线上考试化学试题新疆新源县第二中学2019-2020学年高二下学期期末考试化学试题(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)宁夏青铜峡市高级中学2021-2022学年高二上学期期末考试化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年高二下学期第一次月考化学试题宁夏吴忠市吴忠中学2022-2023学年高三上学期阶段性测试 化学试题河北省保定高碑店市崇德实验中学2022-2023学年高三上学期10月月考化学试题重庆市西南大学附属中学校2022-2023学年高二上学期开学定时训练化学试题(广延班)(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省南昌市八一中学2022-2023学年高二上学期1月期末考试化学试题(已下线)第01讲 原子结构-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)第一章章节专项提升贵州省遵义市桐梓县荣兴高级中学2023-2024学年高二下学期第一次(3月)月考化学试题
10-11高二上·河南新乡·阶段练习
名校
解题方法
8 . 下列溶液一定呈中性的是
A. mol⋅L mol⋅L 的溶液 的溶液 |
B. 的溶液 的溶液 |
| C.使石蕊试液呈紫色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |
您最近一年使用:0次
2024-04-12更新
|
89次组卷
|
55卷引用:甘肃省定西市文峰中学2021-2022学年高二上学期期中考试化学(理科)试题
甘肃省定西市文峰中学2021-2022学年高二上学期期中考试化学(理科)试题(已下线)2011—2012河北省南宫中学高二期中考试化学(理)试卷(已下线)2011-2012学年陕西省宝鸡中学高二下学期期中考试化学试题(已下线)2012-2013学年呼伦贝尔牙林一中高二上学期期中理科考试化学试卷(已下线)2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷【校级联考】浙江省温州市“十五校联合体”2018-2019学年高二上学期期中联考化学试题内蒙古自治区包头市第六中学2018-2019学年高二上学期期中考试化学试题甘肃省永昌四中2019-2020学年高二上学期期末考试化学试题宁夏贺兰县景博中学2019-2020学年高二上学期期中考试化学试题黑龙江省齐齐哈尔三立高级中学有限公司2019-2020学年高二上学期期中考试化学试题内蒙古自治区乌兰察布市集宁一中(西校区)2020-2021学年高二上学期期中考试化学试题广东省广州市第八十九中学2020-2021学年高二上学期期中考试化学试题湖北省宜城市第三高级中学2020-2021学年高二上学期期中考试化学试题重庆市朝阳中学高2020-2021学年高二上学期期中考试化学试题北京东城区2019-2020学年高二下学期期中考试化学试题山东省淄博市高青县第一中学2021-2022学年高二上学期期中考试化学试题甘肃省武威市凉州区2021-2022学年高二上学期期末考试化学试题浙江省嘉兴市第五高级中学2021-2022学年高二上学期期中考试化学试题浙江省北斗联盟2022-2023学年高二上学期期中联考化学试题湖北省十堰市汉江中学2021-2022学年高二上学期期中考试化学试题广东省广州市广雅集团2023-2024学年高二上学期11月期中考试化学试题山东省烟台爱华高级中学2023-2024学年高二上学期期中考试化学试题(已下线)2011年河南省卫辉市第一中学高二1月月考化学试卷(已下线)2010—2011学年湖北省黄冈中学高二上学期期末考试化学试卷(已下线)2010-2011年云南省玉溪一中高二下学期期末考试化学试卷(已下线)2011-2012学年天津市青光中学高二第一学期期末考试化学试卷(已下线)2012-2013学年陕西省宝鸡中学高二下学期期末考试化学试卷(已下线)2013-2014学年贵州省遵义四中高二上学期期末考试化学试卷(已下线)2013-2014学年安徽省宿州市高二上学期期末考试化学试卷2014-2015学年河北省高阳中学高二12月月考化学试卷河北省永年县第二中学2017-2018学年高二12月月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(理)10月月考化学试题【全国百强校】贵州省思南中学2018-2019学年高二上学期第二次月考化学试题吉林省白城市第一中学2018-2019学年高一6月月考化学试题河北省邢台市第八中学2017-2018学年高二上学期期末考试化学试题安徽省阜阳市颍上二中2019-2020学年高二上学期第二次段考化学试题黑龙江省安达市第七中学2019-2020学年高二3月月考化学试题广东省珠海市北京师范大学珠海分校附属外国语学校2019-2020学年高二上学期期末考试化学试题(已下线)【南昌新东方】4. 莲塘一中 孙晖洪(已下线)全册综合检测(一)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)山东省烟台市中英文学校2020-2021学年高二10月月考化学试题新疆乌鲁木齐市第四中学2020-2021学年高二上学期期末考试化学试题宁夏青铜峡市高级中学2020-2021学年高二上学期期末考试化学试题云南省保山第九中学2021届高三上学期开学考试化学试题江苏省南京市中华中学2020-2021学年高二上学期9月测试化学试题(已下线)【浙江新东方】高中化学20210304-002北京市平谷区2021-2022学年高二上学期期末化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期11月测试化学试题新疆乌苏市第一中学2021-2022学年高二12月月考化学试题新疆乌鲁木齐市第三十一中学2021-2022学年高二上学期期末考试化学试题 湖南省常德市西洞庭管理区第一中学2022-2023学年高二上学期第二次月考化学试题天津市河东区 2022-2023 学年高二上学期期末质量检测化学试题北京市清华大学附属中学2023-2024学年高二上学期第三单元化学统练青海省西宁市海湖中学2023-2024学年高二上学期第二次阶段考试化学试题天津北京师范大学静海附属学校2023-2024学年高二上学期第三次月考化学试题
13-14高二·全国·课后作业
名校
解题方法
9 . 在可逆反应:2A(g)+3B(g)=xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5 mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是
| A.2min末时A和B的浓度之比为5:3 |
| B.x=1 |
| C.2min末时B的浓度为1.5mol/L |
| D.2min末时A的消耗浓度为0.5mol/L |
您最近一年使用:0次
2024-04-04更新
|
740次组卷
|
50卷引用:甘肃省玉门市2021-2022学年高二上学期 “研课标读教材”期中学业质量监测化学试题
甘肃省玉门市2021-2022学年高二上学期 “研课标读教材”期中学业质量监测化学试题甘肃省玉门市2021-2022学年高二下学期 “研课标读教材”期中学业质量监测试化学试题(一)2014-2015福建省南安第一中学高二下学期期中考试化学试卷2015-2016学年福建省仙游一中高二上期中测试化学试卷黑龙江省大庆市东风中学2017-2018学年高二上学期期中考试化学试题甘肃省张掖市高台县第一中学2018-2019学年高二上学期期末考试理科化学试题北京市朝阳区陈经纶中学 2019-2020学年高二下学期期中自主检测化学试题黑龙江省双鸭山市第一中学2020-2021学年高二上学期期中考试化学试题湖南省长沙市雅礼中学2020-2021学年高一下学期期中考试化学试题辽宁省阜新市第二高级中学2020-2021学年高一下学期期中考试化学试题山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题四川省泸州市泸县第五中学2023-2024学年高二上学期11月期中考试化学试题云南省保山市腾冲市第八中学2022-2023学年高一下学期期中考试化学试卷四川省德阳外国语学校2023-2024学年高一下学期期中考试化学试题内蒙古呼和浩特市回民区2023-2024学年高一下学期期中考试化学试题(已下线)2014年高二化学人教版选修四 5化学反应速率练习卷2015届河北省邯郸市高三上学期1月教学质量检测化学试卷2015届湖南省长沙市长郡中学高三上学期第五次月考化学试卷2016-2017学年湖北沙市中学高二上第一次双周练化学卷2016-2017学年湖北省武钢三中高二上月考一化学卷黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第三中学2018届高三上学期(10月)第二次验收考试化学试题【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期10月月考化学试题河北省香河县第三中学2018-2019学年高二上学期第一次(10月)月考化学试题河北省承德第一中学2019-2020学年高二上学期开学考试化学试题福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期12月月考化学试题新疆哈密市第十五中学2019-2020学年高一上学期期末考试化学试题江西省上饶市横峰中学2019-2020学年高一(自招班)下学期入学考试化学试题辽宁省锦州市凌海市第三高级中学2019-2020学年高一6月月考化学试题(已下线)2.1.1 化学反应速率的表示方法(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)广东省深圳市第七高级中学2020-2021学年高二上学期第一学段考试化学试题山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题河北省黄骅中学2020-2021学年高二上学期第一次月考化学试题陕西省汉中市五校2020-2021学年高二上学期第一次月考化学试题山西省沁县中学2020-2021学年高二上学期第一次月考化学试题内蒙古自治区土默特左旗第三中学2020-2021学年高二上学期期末考试化学试题内蒙古通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二下学期开学考试化学试题辽宁省大石桥市第三高级中学2020-2021学年高一4月月考化学试题(已下线)2.1 化学反应速率-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)专题21 化学反应速率(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练江西省宜春市第九中学2021-2022学年高二上学期第一次月考化学试题(已下线)6.2.1 化学反应的速率-2021-2022学年高一化学课后培优练(人教版2019必修第二册)山东省滨州市沾化区实验高级中学2022-2023学年高二上学期开学考试化学试题河南省南阳市第六完全学校高级中学2021-2022学年高一下学期第三次考试化学试题山西省太原市山西现代双语学校2021-2022学年高一下学期5月月考化学试题海南省琼海市嘉积中学2023-2024学年高二上学期期末考试化学试题A卷山东省青岛市平度第一中学2023-2024学年高一下学期4月月考化学试题6.2.1 化学反应的速率 随堂练习6.2.2 化学反应的限度 随堂练习
名校
解题方法
10 . A、B、C、D、E是原子序数依次增大的短周期主族元素,B、C同周期,C的电负性数值最大,A、D同主族,E元素原子最外层的p能级电子数是s能级电子数的一半。A、B能形成一种液态高能燃料,其分子中含有18个电子。根据以上信息回答下列问题:
(1)A、B形成的液态高能燃料分子的电子式是____ ;其中B原子的杂化方式为____ 。
(2)基态D原子的核外电子排布式为[Ne]______ 。
(3)C、D、E的离子半径由大到小的顺序为_______ (填离子符号)。
(4)E的单质与D的最高价氧化物对应的水化物发生反应的化学方程式是______ ;该反应涉及的物质中不存在的晶体类型是_______ (填序号)。
①金属晶体 ②离子晶体 ③共价晶体 ④分子晶体
(5)C、D、E可组成离子化合物,其晶胞结构如图所示,每个晶胞中阳离子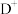 有
有_____ 个,阴离子 有
有______ 个。该化合物的化学式是____ 。
(1)A、B形成的液态高能燃料分子的电子式是
(2)基态D原子的核外电子排布式为[Ne]
(3)C、D、E的离子半径由大到小的顺序为
(4)E的单质与D的最高价氧化物对应的水化物发生反应的化学方程式是
①金属晶体 ②离子晶体 ③共价晶体 ④分子晶体
(5)C、D、E可组成离子化合物,其晶胞结构如图所示,每个晶胞中阳离子
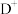 有
有 有
有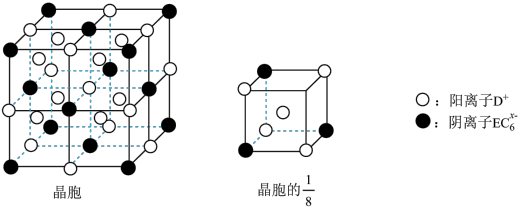
您最近一年使用:0次
2024-04-01更新
|
58次组卷
|
2卷引用:甘肃省武威市2023-2024学年高二下学期期中考试化学试卷

 )
)