名校
解题方法
1 . 某化学实验室产生的废液中含有 Fe3+、Cu2+、Ag+三种金属离子,甲同学设计了如图所示的方案对废液进行处理,以回收金属,下列说法正确的是
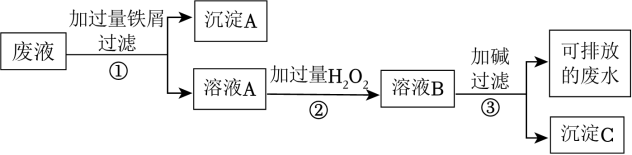

| A.沉淀A中含有2种金属单质 |
| B.可用KSCN溶液来检验溶液B中所含的金属离子 |
| C.溶液A若只经过操作③最终将无法得到沉淀C |
| D.操作①②③中都需要用到玻璃棒、漏斗 |
您最近一年使用:0次
2024-03-19更新
|
130次组卷
|
20卷引用:浙江省温州市新力量联盟2018-2019学年高一上学期期末考试化学试题
浙江省温州市新力量联盟2018-2019学年高一上学期期末考试化学试题贵州省思南中学2018-2019学年高一下学期期末考试化学试题江苏省盐城市大丰区新丰中学2019-2020学年高一上学期期末考试化学试题河北省廊坊市第一中学2022~2023 学年高一上学期期末考试化学试题广东省广州天省实验学校2022-2023学年高一上学期期末考试化学试卷江西省上高县第二中学2019-2020学年高一上学期第三次月考化学试题河北省安平中学2019-2020学年高一上学期第四次月考化学试题河北省保定市涞水波峰中学2019-2020学年高一下学期第三次质检考试化学试题山西省太原市第五中学2020-2021学年高一上学期12月阶段性检测化学试题宁夏石嘴山市第三中学2020-2021学年高一上学期第二次月考化学试题(已下线)【浙江新东方】在线化学 (14)(已下线)练习9 铁的多样性-2020-2021学年【补习教材·寒假作业】高一化学(鲁科版2019)(已下线)【浙江新东方】在线化学33浙江省淳安县汾口中学2020-2021学年高二12月月考化学试题云南省楚雄天人中学2019-2020学年高一上学期12月月考化学试题四川师范大学附属中学2020-2021学年高一上学期12月月考化学试题云南省玉溪师范学院附属中学2021-2022学年高一下学期开学测试化学试题湖南省常德市桃源县第一中学2022-2023学年高三上学期9月月考化学试题甘肃省张掖市高台县第一中学2022-2023学年高一下学期开学检测化学试题浙江省淳安县汾口中学2023-2024学年高二上学期12月检测化学试题
解题方法
2 . 恒容密闭容器中,加入 和
和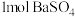 ,发生反应:
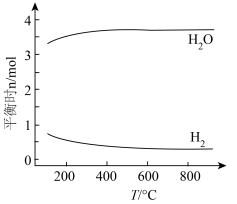
,发生反应: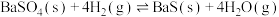 ,在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法
,在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法不正确 的是
 和
和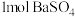 ,发生反应:
,发生反应: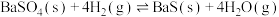 ,在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法
,在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法
A.该反应的 |
B.向平衡体系中加入 , , 的平衡转化率增大 的平衡转化率增大 |
C.该反应的平衡常数表达式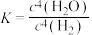 |
| D.向平衡体系中充入稀有气体,平衡不移动 |
您最近一年使用:0次
2024-02-01更新
|
84次组卷
|
2卷引用:浙江省温州市2023-2024学年高二上学期1月期末化学试题
解题方法
3 . 下列化学用语表示不正确 的是
A.基态F原子的核外电子排布式: | B. 的空间填充模型: 的空间填充模型: |
C. 的VSEPR模型: 的VSEPR模型: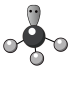 | D. 的电子式: 的电子式: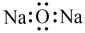 |
您最近一年使用:0次
解题方法
4 . 一定温度下,在
恒容 密闭容器中充入3种气体M、N和Q,它们的物质的量随时间变化如图所示。下列说法不正确 的是
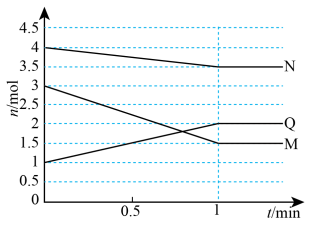


A.该反应的化学方程式: |
B. 内N的平均反应速率为 内N的平均反应速率为 |
C. |
| D.升高体系温度,正反应速率减小,逆反应速率增大 |
您最近一年使用:0次
解题方法
5 . 甲醇是重要的化工原料,应用前景广阔。研究表明,二氧化碳与氢气可以合成甲醇:

一般认为可通过如下两个步骤来实现:
步骤①

步骤②
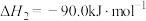
(1)
__________  ,该反应在
,该反应在__________ 条件下能自发进行(填“高温”、“低温”、“任意温度”)。
(2)步骤①为慢反应,下列示意图中能体现上述反应能量变化的是__________。
(3)在恒温恒压条件下,若 和
和 的物质的量之比为
的物质的量之比为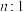 ,相应平衡体系中
,相应平衡体系中 的物质的量分数为x,请在下图中绘制x随n变化的示意图
的物质的量分数为x,请在下图中绘制x随n变化的示意图__________ (不考虑副反应)

(4)恒压条件下,按 和
和 的物质的量之比为
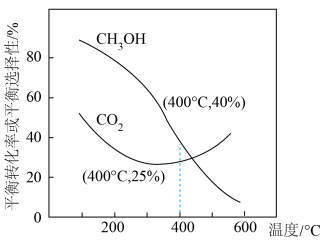
的物质的量之比为 投料,发生反应Ⅰ、Ⅱ。实验测得
投料,发生反应Ⅰ、Ⅱ。实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度的变化如下图所示。
的选择性随温度的变化如下图所示。
Ⅰ.

Ⅱ.

已知: 的选择性=
的选择性= ×100%
×100%
①下列能说明体系已达到平衡状态的是__________ 。
A.混合气体的密度不再变化
B.混合气体的总压强不再变化
C. 的物质的量不再变化
的物质的量不再变化
②温度高于300℃时, 平衡转化率随温度升高而上升的原因:
平衡转化率随温度升高而上升的原因:__________ 。
(5)常温常压下,甲醇作为燃料,每 完全燃烧生成二氧化碳和水时放出的热量为
完全燃烧生成二氧化碳和水时放出的热量为 ,请写出甲醇燃烧热的热化学方程式
,请写出甲醇燃烧热的热化学方程式__________ 。


一般认为可通过如下两个步骤来实现:
步骤①


步骤②

(1)

 ,该反应在
,该反应在(2)步骤①为慢反应,下列示意图中能体现上述反应能量变化的是__________。
A.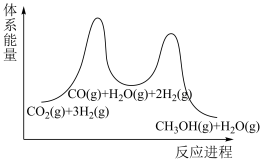 | B.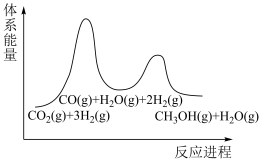 | C.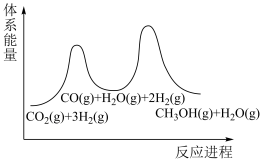 | D.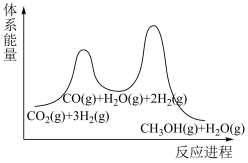 |
(3)在恒温恒压条件下,若
 和
和 的物质的量之比为
的物质的量之比为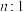 ,相应平衡体系中
,相应平衡体系中 的物质的量分数为x,请在下图中绘制x随n变化的示意图
的物质的量分数为x,请在下图中绘制x随n变化的示意图
(4)恒压条件下,按
 和
和 的物质的量之比为
的物质的量之比为 投料,发生反应Ⅰ、Ⅱ。实验测得
投料,发生反应Ⅰ、Ⅱ。实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度的变化如下图所示。
的选择性随温度的变化如下图所示。Ⅰ.


Ⅱ.



已知:
 的选择性=
的选择性= ×100%
×100%①下列能说明体系已达到平衡状态的是
A.混合气体的密度不再变化
B.混合气体的总压强不再变化
C.
 的物质的量不再变化
的物质的量不再变化②温度高于300℃时,
 平衡转化率随温度升高而上升的原因:
平衡转化率随温度升高而上升的原因:(5)常温常压下,甲醇作为燃料,每
 完全燃烧生成二氧化碳和水时放出的热量为
完全燃烧生成二氧化碳和水时放出的热量为 ,请写出甲醇燃烧热的热化学方程式
,请写出甲醇燃烧热的热化学方程式
您最近一年使用:0次
6 . Ⅰ.无水 与
与 作用会生成
作用会生成 。现有
。现有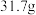 无水
无水 ,吸收
,吸收 后变成
后变成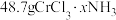 ,试回答下列问题:
,试回答下列问题:
(1) 中
中
______ 。
(2) 为配合物,其中
为配合物,其中 的配位数为6,经测定
的配位数为6,经测定 该配合物和足量
该配合物和足量 溶液反应得到
溶液反应得到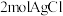 沉淀,则该配合物的化学式可表示为
沉淀,则该配合物的化学式可表示为______ 。
Ⅱ.将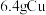 溶于
溶于 过量的硝酸溶液中,假设硝酸的还原产物只有
过量的硝酸溶液中,假设硝酸的还原产物只有 和
和 。反应结束后,将所得的溶液加水稀释至
。反应结束后,将所得的溶液加水稀释至 ,测得
,测得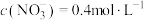 。(假设生成气体完全逸出)。请计算:
。(假设生成气体完全逸出)。请计算:
(3)稀释后溶液中 的物质的量浓度
的物质的量浓度______ 
(4)生成的气体中 物质的量
物质的量______  (用含有
(用含有 的表达式表示)
的表达式表示)
 与
与 作用会生成
作用会生成 。现有
。现有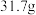 无水
无水 ,吸收
,吸收 后变成
后变成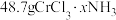 ,试回答下列问题:
,试回答下列问题:(1)
 中
中
(2)
 为配合物,其中
为配合物,其中 的配位数为6,经测定
的配位数为6,经测定 该配合物和足量
该配合物和足量 溶液反应得到
溶液反应得到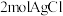 沉淀,则该配合物的化学式可表示为
沉淀,则该配合物的化学式可表示为Ⅱ.将
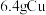 溶于
溶于 过量的硝酸溶液中,假设硝酸的还原产物只有
过量的硝酸溶液中,假设硝酸的还原产物只有 和
和 。反应结束后,将所得的溶液加水稀释至
。反应结束后,将所得的溶液加水稀释至 ,测得
,测得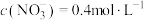 。(假设生成气体完全逸出)。请计算:
。(假设生成气体完全逸出)。请计算:(3)稀释后溶液中
 的物质的量浓度
的物质的量浓度
(4)生成的气体中
 物质的量
物质的量 (用含有
(用含有 的表达式表示)
的表达式表示)
您最近一年使用:0次
7 . 铁及其化合物在生产生活中有重要应用。 的某种硫化物的晶胞如图所示,该晶胞为立方体,晶胞棱长为
的某种硫化物的晶胞如图所示,该晶胞为立方体,晶胞棱长为 。
。
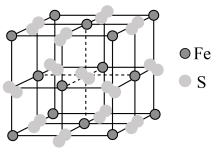
(1)该晶体化学式为______ ;写出其阴离子的电子式______ 。
(2)下列说法正确的是______ 。
A.该晶胞与 晶胞结构相似
晶胞结构相似
B.该晶胞中的阴离子存在两种不同取向
C.该晶体结构中存在 和
和
D.该物质中含有离子键、共价键和分子间作用力
E.铁原子之间最短距离为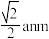
(3)已知阿伏加德罗常数的值为 ,该晶胞密度为
,该晶胞密度为______  。
。
(4)在该晶胞中,每个 周围与它最近且等距的
周围与它最近且等距的 有
有______ 个;下列属于从该晶体结构中分割出的部分结构图的是______ 。(白球、黑球分别代表题中阴、阳离子)
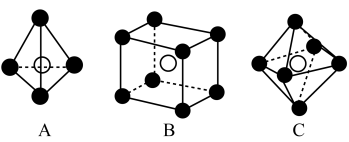
 的某种硫化物的晶胞如图所示,该晶胞为立方体,晶胞棱长为
的某种硫化物的晶胞如图所示,该晶胞为立方体,晶胞棱长为 。
。
(1)该晶体化学式为
(2)下列说法正确的是
A.该晶胞与
 晶胞结构相似
晶胞结构相似B.该晶胞中的阴离子存在两种不同取向
C.该晶体结构中存在
 和
和
D.该物质中含有离子键、共价键和分子间作用力
E.铁原子之间最短距离为
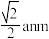
(3)已知阿伏加德罗常数的值为
 ,该晶胞密度为
,该晶胞密度为 。
。(4)在该晶胞中,每个
 周围与它最近且等距的
周围与它最近且等距的 有
有
您最近一年使用:0次
8 . 亚硝酸钠( )是一种无色、无味晶体,具有防腐和抗氧化作用,常用作食品添加剂,但在使用时必须严格控制其用量。
)是一种无色、无味晶体,具有防腐和抗氧化作用,常用作食品添加剂,但在使用时必须严格控制其用量。
为了测定某样品中 的含量,某同学进行如下实验:①称取样品
的含量,某同学进行如下实验:①称取样品 ,加水溶解,配制成
,加水溶解,配制成 溶液;②取
溶液;②取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 标准溶液进行滴定,滴定结束后消耗
标准溶液进行滴定,滴定结束后消耗 溶液
溶液 。
。
(1)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还需______ ;在进行滴定操作时, 溶液盛装在如图中的
溶液盛装在如图中的______ (填“甲”或“乙”)滴定管中。
(2)用 标准溶液滴定可分为如下几步,按实验操作先后顺序排序
标准溶液滴定可分为如下几步,按实验操作先后顺序排序______ (填字母)。
A.用标准溶液润洗滴定管 次
次
B.固定盛有标准溶液的滴定管,赶出尖嘴处气泡
C.用标准溶液滴定至终点,读数
D.取标准溶液注入滴定管至“0”刻度线以上
E.调节液面至“0”刻度线以下,读数
(3)滴定过程中发生反应的离子方程式是______ 。
(4)当滴入最后半滴溶液,______ ,即到达滴定终点。以下操作造成测定结果偏高的是______ (填字母)。
A.滴定管未用酸性 标准溶液润洗
标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前平视,滴定后俯视读数
(5)测得该样品中 的质量分数为
的质量分数为______ 。
 )是一种无色、无味晶体,具有防腐和抗氧化作用,常用作食品添加剂,但在使用时必须严格控制其用量。
)是一种无色、无味晶体,具有防腐和抗氧化作用,常用作食品添加剂,但在使用时必须严格控制其用量。为了测定某样品中
 的含量,某同学进行如下实验:①称取样品
的含量,某同学进行如下实验:①称取样品 ,加水溶解,配制成
,加水溶解,配制成 溶液;②取
溶液;②取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 标准溶液进行滴定,滴定结束后消耗
标准溶液进行滴定,滴定结束后消耗 溶液
溶液 。
。
(1)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还需
 溶液盛装在如图中的
溶液盛装在如图中的(2)用
 标准溶液滴定可分为如下几步,按实验操作先后顺序排序
标准溶液滴定可分为如下几步,按实验操作先后顺序排序A.用标准溶液润洗滴定管
 次
次B.固定盛有标准溶液的滴定管,赶出尖嘴处气泡
C.用标准溶液滴定至终点,读数
D.取标准溶液注入滴定管至“0”刻度线以上
E.调节液面至“0”刻度线以下,读数
(3)滴定过程中发生反应的离子方程式是
(4)当滴入最后半滴溶液,
A.滴定管未用酸性
 标准溶液润洗
标准溶液润洗B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前平视,滴定后俯视读数
(5)测得该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
9 . 氧族元素及其化合物在生产、生活中发挥着重要的作用。回答如下问题:
(1)氧元素在元素周期表中的位置______ ,电子占据最高能级的电子云轮廓图为______ 形。
(2)硫为______ 区元素,同周期第一电离能小于硫的元素有______ 种。
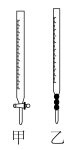
(3)下列氧原子的电子排布图表示的状态中,电离最外层一个电子所需能量最大的是______ 。
A. B.
B.
C.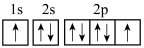 D.
D.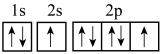
当氧从 状态变到
状态变到 状态,形成的是
状态,形成的是______ 光谱(选填“发射”或“吸收”)。
(4)硫酸的结构式如图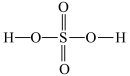 ,比较酸性:
,比较酸性: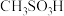
______ 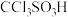 (填“大于”“小于”或“等于”),并说明原因:
(填“大于”“小于”或“等于”),并说明原因:______ 。
(1)氧元素在元素周期表中的位置
(2)硫为
(3)下列氧原子的电子排布图表示的状态中,电离最外层一个电子所需能量最大的是
A.
 B.
B.
C.
 D.
D.
当氧从
 状态变到
状态变到 状态,形成的是
状态,形成的是(4)硫酸的结构式如图
 ,比较酸性:
,比较酸性: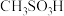
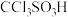 (填“大于”“小于”或“等于”),并说明原因:
(填“大于”“小于”或“等于”),并说明原因:
您最近一年使用:0次
解题方法
10 . 下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将铁钉与电源正极相连,铜片与电源负极相连,放入硫酸铜溶液中,接通直流电源 | 铁钉表面附着一层红色固体 | 铁钉表面镀上一层铜 |
B |  下,测定纯水和 下,测定纯水和 的 的 溶液的 溶液的 |  均为7 均为7 | 纯水和 溶液中,水的电离程度相同 溶液中,水的电离程度相同 |
C | 向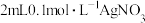 溶液中先滴加4滴 溶液中先滴加4滴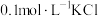 溶液,再滴加4滴 溶液,再滴加4滴 溶液 溶液 | 先产生白色沉淀,再产生黄色沉淀 |  溶解度小于 溶解度小于 溶解度 溶解度 |
D | 向 溶液中加入 溶液中加入 溶液 溶液 | 有白色沉淀生成 |  结合 结合 的能力比 的能力比 强 强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



