1 . 研发二氧化碳的利用技术,将二氧化碳转化为能源是减轻环境污染和解决能源问题的方案之一、回答下列问题:
(1)利用CO2合成二甲醚有两种工艺。
工艺1:
涉及以下主要反应:
反应Ⅰ.甲醇的合成:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
反应Ⅱ.逆水汽变换:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.0kJ/mol
CO(g)+H2O(g) △H2=+41.0kJ/mol
反应Ⅲ.甲醇脱水:2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H3=-23.5kJ/mol
工艺2:反应Ⅳ.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H
CH3OCH3(g)+3H2O(g) △H
①△H=___________ kJ/mol,反应Ⅳ在___________ (填“低温”“高温”或“任意温度”)下自发进行。
②反应Ⅳ的活化能Ea(正)___________ (填“>”“<"或“=”)Ea(逆)。
③在恒温恒容的密闭容器中,下列说法能判断反应Ⅳ达到平衡的是___________ (填标号)。
A.气体物质中碳元素与氧元素的质量比不变
B.容器内CH3OCH3浓度保持不变
C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
(2)在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇(反应Ⅰ),实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图甲、乙所示。___________ (填标号)。
A.图甲纵坐标表示CH3OH的平衡产率
B.p1<p2<p3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压条件
D.一定温度、压强下,提高CO2的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是___________ 。
(3)在T1温度下,将3molCO2和7molH2充入2L的恒容密闭容器中发生反应Ⅰ和Ⅳ,达到平衡状态时CH3OH(g)和CH3OCH3(g)的物质的量分别为1mol和0.5mol。
①反应经过10min达到平衡,0~10min内CO2的平均反应速率v(CO2)=___________ mol/(L·min)。
②T1温度时反应Ⅰ的平衡常数K=___________ 。
(1)利用CO2合成二甲醚有两种工艺。
工艺1:
涉及以下主要反应:
反应Ⅰ.甲醇的合成:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol反应Ⅱ.逆水汽变换:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.0kJ/mol
CO(g)+H2O(g) △H2=+41.0kJ/mol反应Ⅲ.甲醇脱水:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H3=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H3=-23.5kJ/mol工艺2:反应Ⅳ.2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H
CH3OCH3(g)+3H2O(g) △H①△H=
②反应Ⅳ的活化能Ea(正)
③在恒温恒容的密闭容器中,下列说法能判断反应Ⅳ达到平衡的是
A.气体物质中碳元素与氧元素的质量比不变
B.容器内CH3OCH3浓度保持不变
C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
(2)在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇(反应Ⅰ),实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图甲、乙所示。
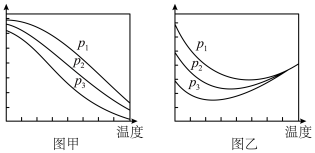
A.图甲纵坐标表示CH3OH的平衡产率
B.p1<p2<p3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压条件
D.一定温度、压强下,提高CO2的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是
(3)在T1温度下,将3molCO2和7molH2充入2L的恒容密闭容器中发生反应Ⅰ和Ⅳ,达到平衡状态时CH3OH(g)和CH3OCH3(g)的物质的量分别为1mol和0.5mol。
①反应经过10min达到平衡,0~10min内CO2的平均反应速率v(CO2)=
②T1温度时反应Ⅰ的平衡常数K=
您最近一年使用:0次
解题方法
2 . 某实验小组以含铁污泥(主要成分为 、
、 及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾
及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾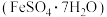 和柠檬酸铁铵。
和柠檬酸铁铵。
(1)写出“酸浸”时, 与硫酸反应的离子方程式:
与硫酸反应的离子方程式:___________ 。
(2)“滤液X”中含有的阳离子为___________ 。
(3)路线I中,加入 溶液的目的是
溶液的目的是___________ 。
(4)写出加入氨水“沉淀”时的离子方程式:___________ 。
(5)写出加入过量铁粉时发生反应的离子方程式:___________ 、___________ 。
(6)“酸浸”时加入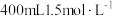 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为___________ g。
 、
、 及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾
及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾 和柠檬酸铁铵。
和柠檬酸铁铵。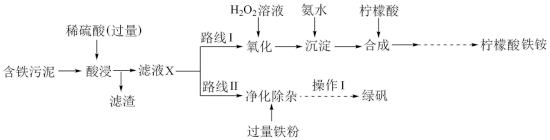
(1)写出“酸浸”时,
 与硫酸反应的离子方程式:
与硫酸反应的离子方程式:(2)“滤液X”中含有的阳离子为
(3)路线I中,加入
 溶液的目的是
溶液的目的是(4)写出加入氨水“沉淀”时的离子方程式:
(5)写出加入过量铁粉时发生反应的离子方程式:
(6)“酸浸”时加入
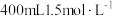 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
您最近一年使用:0次
解题方法
3 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y最外层只有1个电子,Z原子的最外层电子数是X原子最外层电子数的一半,W与X同主族。下列说法正确的是
A.原子半径: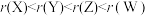 |
| B.Y的最高价氧化物对应水化物的碱性比Z的强 |
| C.W的简单气态氢化物的热稳定性比X的强 |
| D.由X、Y组成的化合物只含离子键,不可能含有共价键 |
您最近一年使用:0次
解题方法
4 . 下列有关钠、铁、铝性质的说法中错误的是
| A.均能与氧气反应 |
B.均能与氯气反应,生成物中金属元素化合价数值: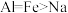 |
| C.均能从溶液中置换出铜 |
| D.均能与盐酸反应置换出氢气 |
您最近一年使用:0次
解题方法
5 . 价类二维图是学习元素及其化合物知识的重要模型。铁元素的价类二维图如图,下列有关说法不正确的是
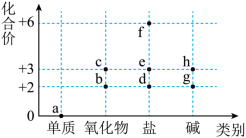
| A.a能导电,能被磁体吸引 | B.铁的氧化物只有b、c |
| C.e转化为f需加入氧化剂 | D.物质g在空气中不能长时间稳定存在 |
您最近一年使用:0次
6 .  是一种高效多功能水处理剂,应用前景十分看好。一种制备
是一种高效多功能水处理剂,应用前景十分看好。一种制备 的方法可用化学方程式表示为:
的方法可用化学方程式表示为: ,对此反应下列说法中不正确的是
,对此反应下列说法中不正确的是
 是一种高效多功能水处理剂,应用前景十分看好。一种制备
是一种高效多功能水处理剂,应用前景十分看好。一种制备 的方法可用化学方程式表示为:
的方法可用化学方程式表示为: ,对此反应下列说法中不正确的是
,对此反应下列说法中不正确的是A. 既作氧化剂又作还原剂 既作氧化剂又作还原剂 |
B.2  发生反应时,反应中共有8 发生反应时,反应中共有8 电子转移 电子转移 |
C.每生成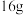 氧气就有 氧气就有  被氧化 被氧化 |
D. 既是还原产物又是氧化产物 既是还原产物又是氧化产物 |
您最近一年使用:0次
解题方法
7 . 用NA表示阿伏加德罗常数,下列说法错误的是
A.将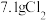 通入足量氢氧化钠溶液中,转移电子数为 通入足量氢氧化钠溶液中,转移电子数为 |
B.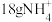 所含的电子数目为 所含的电子数目为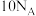 |
C.含0.2mol FeCl3的氯化铁饱和溶液滴入沸水充分反应形成的 胶体粒子数小于0.2NA 胶体粒子数小于0.2NA |
D. 在空气中完全燃烧生成MgO和Mg3N2的混合物,转移的电子数为 在空气中完全燃烧生成MgO和Mg3N2的混合物,转移的电子数为 |
您最近一年使用:0次
8 . 某学习小组用0.1000mol/LNaOH标准溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
(1)若滴定开始和结束时,该仪器中溶液读数如图所示,所用NaOH标准溶液的体积为___________ mL。
依据表中数据计算该盐酸的物质的量浓度为___________ mol/L。
(3)下列操作会使所测结果偏高的是___________ (填字母)。
A.滴定前用蒸馏水冲洗锥形瓶
B.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
C.滴定过程中不慎将数滴碱液滴在锥形瓶外
D.碱式滴定管在滴定前有气泡,滴定后气泡消失
E.读取NaOH体积时,开始仰视读数,滴定结束时俯视读数
(4)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。___________ (填“I”或“Ⅱ”)。
② 和
和 的关系:
的关系:
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
③M点对应溶液中,各离子的物质的量浓度由大到小的顺序是___________ 。
(1)若滴定开始和结束时,该仪器中溶液读数如图所示,所用NaOH标准溶液的体积为
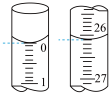
| 滴定次数 | 待测盐酸的体积 | 标准NaOH溶液体积 | |
| 滴定前的刻度 | 滴定后的刻度mL | ||
| 第一次 | 25.00mL | 0.00mL | 26.11mL |
| 第二次 | 25.00mL | 1.56mL | 30.30mL |
| 第三次 | 25.00mL | 0.22mL | 26.31mL |
(3)下列操作会使所测结果偏高的是
A.滴定前用蒸馏水冲洗锥形瓶
B.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
C.滴定过程中不慎将数滴碱液滴在锥形瓶外
D.碱式滴定管在滴定前有气泡,滴定后气泡消失
E.读取NaOH体积时,开始仰视读数,滴定结束时俯视读数
(4)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

②
 和
和 的关系:
的关系:
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。③M点对应溶液中,各离子的物质的量浓度由大到小的顺序是
您最近一年使用:0次
解题方法
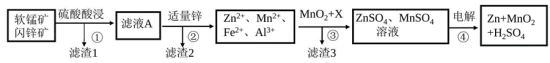
9 . 软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下:
Ⅱ.常温下各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)为了加快矿石的酸浸速率,通常采用的方法有___________ (写出两种)。
(2)滤渣2的成分有___________ (填化学式)。
(3)步骤①中发生多个反应,其中 、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出
、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出 、FeS与硫酸共热发生反应的离子方程式
、FeS与硫酸共热发生反应的离子方程式___________ 。
(4)步骤③中 的作用可以用
的作用可以用___________ 溶液(填化学式)来代替,有关反应的离子方程式为___________ ;另外一种物质X用来调节溶液的pH,X可以是下列的___________ (填序号)。
A. B.ZnO C.
B.ZnO C. D.
D.
(5)当金属离子浓度为 时认为该离子完全沉淀,则
时认为该离子完全沉淀,则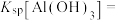
___________ 。
(6)步骤④以锂离子电池作电源,用惰性电极进行电解,其阳极的电极反应式为___________ ;用 可以制取锂离子电池的正极材料
可以制取锂离子电池的正极材料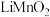 ,该电池充电时的反应为:
,该电池充电时的反应为: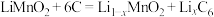 ,写出充电时阳极的电极反应式
,写出充电时阳极的电极反应式___________ 。
Ⅱ.常温下各种金属离子完全沉淀的pH如下表:
 |  |  |  |  | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)为了加快矿石的酸浸速率,通常采用的方法有
(2)滤渣2的成分有
(3)步骤①中发生多个反应,其中
 、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出
、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出 、FeS与硫酸共热发生反应的离子方程式
、FeS与硫酸共热发生反应的离子方程式(4)步骤③中
 的作用可以用
的作用可以用A.
 B.ZnO C.
B.ZnO C. D.
D.
(5)当金属离子浓度为
 时认为该离子完全沉淀,则
时认为该离子完全沉淀,则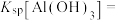
(6)步骤④以锂离子电池作电源,用惰性电极进行电解,其阳极的电极反应式为
 可以制取锂离子电池的正极材料
可以制取锂离子电池的正极材料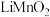 ,该电池充电时的反应为:
,该电池充电时的反应为: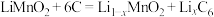 ,写出充电时阳极的电极反应式
,写出充电时阳极的电极反应式
您最近一年使用:0次
10 . 研究含氮化合物对消除环境污染,能源结构的改变,食品添加剂的研究等有重要意义。
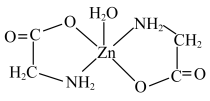
(1)甘氨酸锌常用于食品的添加剂,也可代替甘油作烟丝的加香、防冻。一水合甘氨酸锌结构简式如图所示。___________ 。
②N、O、C、Zn元素的第一电离能由大到小的顺序为___________ 。
(2)“中国制造2025”是中国政府实施制造强国战略第一个十年行动领。氮化铬在现代工业中发挥了重要作用。
①基态N原子的价层电子排布图为___________ 。
②基态Cr原子的价层电子排布式为___________ 。
(3)NO在空气中存在如下反应: ,该反应分两步完成,其反应历程如图所示。决定总反应速率的这一步反应的热化学方程式为
,该反应分两步完成,其反应历程如图所示。决定总反应速率的这一步反应的热化学方程式为___________ 。 、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
I.

Ⅱ.

若CO的燃烧热为283.5kJ/mol,则反应I的
___________ kJ/mol。
(5)室温下,用氨水将 转化为
转化为 ,实验测得
,实验测得 溶液中
溶液中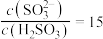 ,则溶液的pH为
,则溶液的pH为___________ 。(已知: 的
的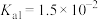 ,
,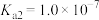 )
)
(6)若T℃时,pH=2的醋酸溶液中由水电离出的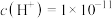 ,将此温度下
,将此温度下 的HCl溶液与
的HCl溶液与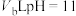 的NaOH溶液混合后pH=3,则
的NaOH溶液混合后pH=3,则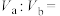
___________ 。
(1)甘氨酸锌常用于食品的添加剂,也可代替甘油作烟丝的加香、防冻。一水合甘氨酸锌结构简式如图所示。
②N、O、C、Zn元素的第一电离能由大到小的顺序为
(2)“中国制造2025”是中国政府实施制造强国战略第一个十年行动领。氮化铬在现代工业中发挥了重要作用。
①基态N原子的价层电子排布图为
②基态Cr原子的价层电子排布式为
(3)NO在空气中存在如下反应:
 ,该反应分两步完成,其反应历程如图所示。决定总反应速率的这一步反应的热化学方程式为
,该反应分两步完成,其反应历程如图所示。决定总反应速率的这一步反应的热化学方程式为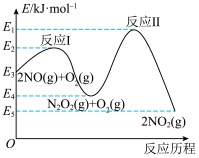
 、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:I.


Ⅱ.


若CO的燃烧热为283.5kJ/mol,则反应I的

(5)室温下,用氨水将
 转化为
转化为 ,实验测得
,实验测得 溶液中
溶液中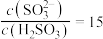 ,则溶液的pH为
,则溶液的pH为 的
的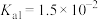 ,
,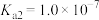 )
)(6)若T℃时,pH=2的醋酸溶液中由水电离出的
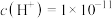 ,将此温度下
,将此温度下 的HCl溶液与
的HCl溶液与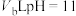 的NaOH溶液混合后pH=3,则
的NaOH溶液混合后pH=3,则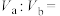
您最近一年使用:0次



