1 . 下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
(1)可以证明醋酸是弱酸的事实是_____ (填字母序号)
A.醋酸和水能以任意比例混溶
B.在醋酸水溶液中还含有未电离的醋酸分子
C.醋酸与 溶液反应放出
溶液反应放出 气体
气体
D. 的醋酸水溶液能使紫色石蕊溶液变红色
的醋酸水溶液能使紫色石蕊溶液变红色
E.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,最强的酸是_____ (用化学式表示)。
②下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是_____ 。
A.升高温度 B.加水稀释 C.加少量的 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式_____ 。
(3)已知水溶液中 和
和 的关系如图所示:
的关系如图所示:
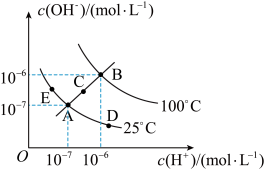
①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是_____ 。
②若A点到E点,可采用的措施是_____ (填序号,下同);促进水的电离平衡正向移动的措施是_____ 。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH
③室温下,在由水电离产生的 浓度为
浓度为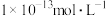 的溶液中,一定能大量共存的离子组是
的溶液中,一定能大量共存的离子组是_____ 。
a. 、
、 、
、 、
、 b.
b. 、
、 、
、 、
、
c. 、
、 、
、 、
、 d.
d. 、
、 、
、 、
、
e. 、
、 、
、 、
、
| 酸 |  |  | HCN | HClO |
电离平衡常数( ) ) |  |  | 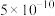 |  |
(1)可以证明醋酸是弱酸的事实是
A.醋酸和水能以任意比例混溶
B.在醋酸水溶液中还含有未电离的醋酸分子
C.醋酸与
 溶液反应放出
溶液反应放出 气体
气体D.
 的醋酸水溶液能使紫色石蕊溶液变红色
的醋酸水溶液能使紫色石蕊溶液变红色E.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,最强的酸是
②下列能使醋酸溶液中
 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是A.升高温度 B.加水稀释 C.加少量的
 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式
(3)已知水溶液中
 和
和 的关系如图所示:
的关系如图所示:
①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是
②若A点到E点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NaOH
③室温下,在由水电离产生的
 浓度为
浓度为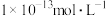 的溶液中,一定能大量共存的离子组是
的溶液中,一定能大量共存的离子组是a.
 、
、 、
、 、
、 b.
b. 、
、 、
、 、
、
c.
 、
、 、
、 、
、 d.
d. 、
、 、
、 、
、
e.
 、
、 、
、 、
、
您最近一年使用:0次
2 . Ⅰ.
(1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水放出热量222.5kJ,则甲烷燃烧的热化学方程式为_____ 。
(2)已知:
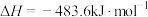 ,查阅文献资料,化学键的键能如下表:
,查阅文献资料,化学键的键能如下表:
氨分解反应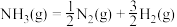 的活化能
的活化能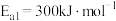 ,则合成氨反应
,则合成氨反应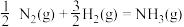 的活化能
的活化能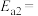
_____  。
。
Ⅱ.氨在国民经济生产中占有重要地位。下图是合成氨的简要流程和反应方程式:

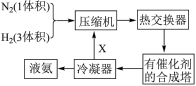
(3)图中X是_____ ,这样操作的目的是_____ 。
(4)T℃时在容积为2L的密闭恒容容器中充入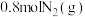 和
和 ,5min后达到平衡,测得
,5min后达到平衡,测得 的浓度为0.2mol/L。
的浓度为0.2mol/L。
①计算此段时间的反应速率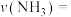
_____ 。
②若向平衡后的体系中同时加入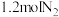 、
、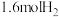 、
、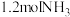 ,平衡将
,平衡将_____ (填“正向移动”、“不移动”或“逆向移动”)。
(5)下列措施可提高 平衡转化率的是
平衡转化率的是_____ (填序号)。
a.恒容时充入 ,使体系总压强增大 b.恒容时将
,使体系总压强增大 b.恒容时将 从体系中分离
从体系中分离
c.恒容时充入He,使体系总压强增大 d.加入合适的催化剂
(6)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在低温、常压、光照条件下, 在催化剂(掺有少量
在催化剂(掺有少量 的
的 )表面与水发生反应:
)表面与水发生反应: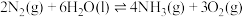
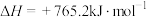 。进一步研究
。进一步研究 生成量与温度的关系,部分实验数据见下表(光照、压强
生成量与温度的关系,部分实验数据见下表(光照、压强 、反应时间3h):
、反应时间3h):
当温度高于323K时, 的生成量反而降低的可能原因是
的生成量反而降低的可能原因是_____ 。
(1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水放出热量222.5kJ,则甲烷燃烧的热化学方程式为
(2)已知:

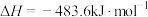 ,查阅文献资料,化学键的键能如下表:
,查阅文献资料,化学键的键能如下表:| 化学键 | H-H键 | N≡N键 | N-H键 |
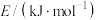 | 436 | 946 | 391 |
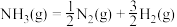 的活化能
的活化能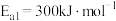 ,则合成氨反应
,则合成氨反应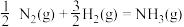 的活化能
的活化能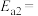
 。
。Ⅱ.氨在国民经济生产中占有重要地位。下图是合成氨的简要流程和反应方程式:



(3)图中X是
(4)T℃时在容积为2L的密闭恒容容器中充入
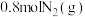 和
和 ,5min后达到平衡,测得
,5min后达到平衡,测得 的浓度为0.2mol/L。
的浓度为0.2mol/L。①计算此段时间的反应速率
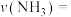
②若向平衡后的体系中同时加入
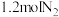 、
、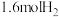 、
、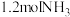 ,平衡将
,平衡将(5)下列措施可提高
 平衡转化率的是
平衡转化率的是a.恒容时充入
 ,使体系总压强增大 b.恒容时将
,使体系总压强增大 b.恒容时将 从体系中分离
从体系中分离c.恒容时充入He,使体系总压强增大 d.加入合适的催化剂
(6)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在低温、常压、光照条件下,
 在催化剂(掺有少量
在催化剂(掺有少量 的
的 )表面与水发生反应:
)表面与水发生反应: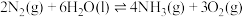
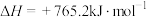 。进一步研究
。进一步研究 生成量与温度的关系,部分实验数据见下表(光照、压强
生成量与温度的关系,部分实验数据见下表(光照、压强 、反应时间3h):
、反应时间3h):| T/K | 303 | 313 | 323 | 353 |
 生成量 生成量 | 4.8 | 5.9 | 6.0 | 2.0 |
 的生成量反而降低的可能原因是
的生成量反而降低的可能原因是
您最近一年使用:0次
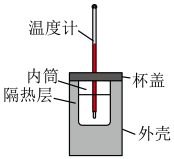
3 . 用如图所示的装置测定中和反应反应热。
实验药品:100mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液、50mL0.50mol/L氨水。
已知弱碱电离时吸热。回答下列问题。
(1)从实验装置上看,还缺少_____ ,其能否用铜质材料替代?_____ (填“能”或“不能”),理由是_____ 。
(2)装置中隔热层的作用是_____ 。
(3)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容 ,测得温度如下:
,测得温度如下:
①两组实验结果存在差异的原因是_____ 。
②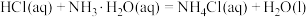 的
的
_____ (保留一位小数)。
③某同学利用上述装置重新做甲组实验,测得反应热 偏大,则可能的原因是
偏大,则可能的原因是_____ (填序号)。
A.测完盐酸的温度直接测NaOH溶液温度 B.做该实验时室温较高
C.杯盖未盖严 D.NaOH溶液一次性迅速倒入
④若实验中若改用60mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____ (填“相等”“不相等”),若实验操作均正确,则所求中和热_____ (填“相等”“不相等”)。

实验药品:100mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液、50mL0.50mol/L氨水。
已知弱碱电离时吸热。回答下列问题。
(1)从实验装置上看,还缺少
(2)装置中隔热层的作用是
(3)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容 ,测得温度如下:
,测得温度如下:| 反应物 | 起始温度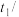 ℃ ℃ | 最高温度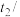 ℃ ℃ |
| 甲组(HCl+NaOH) | 15.0 | 18.3 |
乙组( ) ) | 15.0 | 18.1 |
②
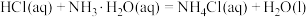 的
的
③某同学利用上述装置重新做甲组实验,测得反应热
 偏大,则可能的原因是
偏大,则可能的原因是A.测完盐酸的温度直接测NaOH溶液温度 B.做该实验时室温较高
C.杯盖未盖严 D.NaOH溶液一次性迅速倒入
④若实验中若改用60mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量
您最近一年使用:0次
解题方法
4 . 铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2•12H2O]的工艺流程如图所示:
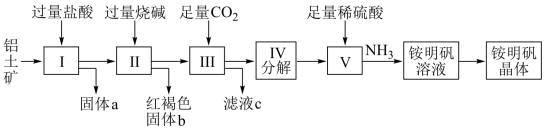
请回答下列问题:
(1)固体a的化学式为___________ 。
(2)加快I的反应速率的措施有___________ (任写两点即可)。
(3)写出Ⅱ中加过量的烧碱涉及的反应离子方程式:___________ ,___________ 。
(4)由I中得到固体a的实验操作为___________ ,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)___________ 、___________ 、过滤、洗涤。
(5)向铵明矾NH4Al(SO4)2中加氢氧化钡使硫酸根离子刚好完全沉淀的化学反应方程式为___________ 。

请回答下列问题:
(1)固体a的化学式为
(2)加快I的反应速率的措施有
(3)写出Ⅱ中加过量的烧碱涉及的反应离子方程式:
(4)由I中得到固体a的实验操作为
(5)向铵明矾NH4Al(SO4)2中加氢氧化钡使硫酸根离子刚好完全沉淀的化学反应方程式为
您最近一年使用:0次
5 . 载人航天器中,可将航天员呼出的CO2转化为 H2O,再通过电解 H2O 获得 O2,实现 O2的再 生,同时还能制备CH4。
已知:①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H =-252.9kJ/mol
②2H2O(l)=2H2(g)+O2(g) ∆H=+571.6kJ/mol
请回答下列问题:
(1)反应①属于___________ (填“吸热”或“放热”)反应。
(2)反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) ∆H=___________ kJ/mol。
(3)利用CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
已知:①2CH4(g)=C2H4(g)+2H2(g) ΔH=+167kJ/mol,则a=___________ 。
②已知5C2H4(g)+12 (aq)+36H+(aq)=12Mn2+(aq)+10CO2 (g)+28H2O(l) ΔH=-m kJ·mol-1,当放出的热量为m kJ时,该反应转移电子的物质的量为
(aq)+36H+(aq)=12Mn2+(aq)+10CO2 (g)+28H2O(l) ΔH=-m kJ·mol-1,当放出的热量为m kJ时,该反应转移电子的物质的量为___________ mol。
③制备合成气反应历程分两步,步骤I:CH4(g) C(ads)+2H2(g);步骤Ⅱ:C(ads)+CO2(g)⇌2CO(g)。上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图:
C(ads)+2H2(g);步骤Ⅱ:C(ads)+CO2(g)⇌2CO(g)。上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图:
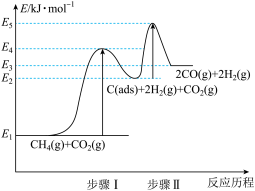
E4-E1表示步骤I正反应的___________ ,制备合成气反应可在___________ (填“高温” 或“低温”)下自发进行。
已知:①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H =-252.9kJ/mol
②2H2O(l)=2H2(g)+O2(g) ∆H=+571.6kJ/mol
请回答下列问题:
(1)反应①属于
(2)反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) ∆H=
(3)利用CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
| 化学键 | H-H | C=C | C-C | C-H |
| E(kJ/mol) | 436 | a | 348 | 413 |
②已知5C2H4(g)+12
 (aq)+36H+(aq)=12Mn2+(aq)+10CO2 (g)+28H2O(l) ΔH=-m kJ·mol-1,当放出的热量为m kJ时,该反应转移电子的物质的量为
(aq)+36H+(aq)=12Mn2+(aq)+10CO2 (g)+28H2O(l) ΔH=-m kJ·mol-1,当放出的热量为m kJ时,该反应转移电子的物质的量为③制备合成气反应历程分两步,步骤I:CH4(g)
 C(ads)+2H2(g);步骤Ⅱ:C(ads)+CO2(g)⇌2CO(g)。上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图:
C(ads)+2H2(g);步骤Ⅱ:C(ads)+CO2(g)⇌2CO(g)。上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图:
E4-E1表示步骤I正反应的
您最近一年使用:0次
6 . 食醋(约含3%~5%的CH3COOH)、纯碱(Na2CO3)和84消毒液(主要成分为NaClO)是生活中常见的化学用品,回答下列问题:
(1)醋酸(CH3COOH)属于___________ 电解质(填“强”、“弱”或“非”),在84消毒液中加入少量食醋可以增强其杀菌、消毒的能力,请用离子方程式表示其原因___________ 。
(2)用离子方程式表示纯碱溶液呈碱性的原因___________ 。
(3)将少量NaOH溶液滴入醋酸溶液中,溶液中 的值变化趋势为
的值变化趋势为___________ (填“增大”、“减小”或“不变”)。
(4)常温下,pH=4的醋酸溶液与pH=10的纯碱溶液中,水电离出的c(OH-)之比为___________ 。
(1)醋酸(CH3COOH)属于
(2)用离子方程式表示纯碱溶液呈碱性的原因
(3)将少量NaOH溶液滴入醋酸溶液中,溶液中
 的值变化趋势为
的值变化趋势为(4)常温下,pH=4的醋酸溶液与pH=10的纯碱溶液中,水电离出的c(OH-)之比为
您最近一年使用:0次
7 . 对SO2、NOx、CO2和CO进行回收利用是节能减排的重要课题。某温度下,向恒容密闭容器中充入NO2、SO2发生反应:NO2(g)+SO2(g)⇌SO3(g)+NO(g)。
(1)①只改变下列某一反应条件时,能使上述反应速率加快的是___________ (填序号)。
a.使用高效催化剂 b.向容器中充入氩气 c.降低温度 d.减小NO的物质的量
②下列能说明反应达到平衡状态的是___________ (填字母)。
a.混合气体的密度保持不变
b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变
d.每生成1molSO3的同时消耗1molNO
(2)在体积为 密闭容器中充入
密闭容器中充入 和
和 ,发生反应
,发生反应 ,测得
,测得 、
、 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
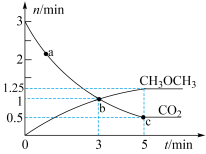
①反应到达3min时,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②0~5min内,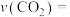
___________  。
。
③反应达到平衡状态时, 的体积分数为
的体积分数为___________ %(保留1位小数)。
④a、b、c三点中代表达到平衡的是___________ ,a点的正反应速率___________ (填>、<或=)b点的逆反应速率。
(1)①只改变下列某一反应条件时,能使上述反应速率加快的是
a.使用高效催化剂 b.向容器中充入氩气 c.降低温度 d.减小NO的物质的量
②下列能说明反应达到平衡状态的是
a.混合气体的密度保持不变
b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变
d.每生成1molSO3的同时消耗1molNO
(2)在体积为
 密闭容器中充入
密闭容器中充入 和
和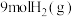 ,发生反应
,发生反应 ,测得
,测得 、
、 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
①反应到达3min时,

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②0~5min内,
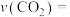
 。
。③反应达到平衡状态时,
 的体积分数为
的体积分数为④a、b、c三点中代表达到平衡的是
您最近一年使用:0次
8 . 下列有关电解质的判断正确的是
| A.CaCO3难溶于水,所以CaCO3不是电解质 |
| B.CO2的水溶液能够导电,所以CO2是电解质 |
| C.NaCl固体溶于水后能导电,所以NaCl是电解质 |
| D.银、铜导电性好,可用作导线,所以银、铜是电解质 |
您最近一年使用:0次
9 . 某化学小组欲定量探究含I-对H2O2溶液发生分解时化学反应速率的影响,该小组先取10mL0.40mol•L-1H2O2溶液利用如图装置进行实验,得到了如表数据:

说明:①表中V(O2)是折合成标准状况下O2的体积:
②假设反应过程中溶液体积的变化忽略不计。
(1)检查该装置气密性的操作为_______ 。
(2)0~6min的平均反应速率:v(H2O2)=_______ (保留两位有效数字),0~6min的平均反应速率_______ 10min的平均反应速率(填“>”“<”或“=”)
(3)已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,在含少量I-的溶液中,H2O2的分解机理为:
①H2O2+I-→H2O+IO- 慢
②H2O2+IO-→H2O+O2+I- 快
下列说法错误的是_______ (填标号)。
A.该反应活化能等于98kJ•mol-1
B.IO-是该反应的催化剂
C.反应速率与I-的浓度有关
D.2v(H2O2)=2v(H2O)=v(O2)
E.反应①的活化能高于反应②
(4)对于H2O2的分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图所示的实验,发现滴加FeCl3溶液的试管产生的气泡史剧烈,研究小组得出了“Fe3+的催化效果一定比Cu2+更好”的结论,你认为利用该现象得出的该结论_______ (填“合理”或“不合理”),原因是_______ 。某同学将0.1mol•L-1CuSO4溶液改为0.15mol•L-1CuCl2溶液进行实验,现象与上述实验一致,故研究小组得出了“Fe3+催化效果更好”的结论,其理由是_______ 。


| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
②假设反应过程中溶液体积的变化忽略不计。
(1)检查该装置气密性的操作为
(2)0~6min的平均反应速率:v(H2O2)=
(3)已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,在含少量I-的溶液中,H2O2的分解机理为:
①H2O2+I-→H2O+IO- 慢
②H2O2+IO-→H2O+O2+I- 快
下列说法错误的是
A.该反应活化能等于98kJ•mol-1
B.IO-是该反应的催化剂
C.反应速率与I-的浓度有关
D.2v(H2O2)=2v(H2O)=v(O2)
E.反应①的活化能高于反应②
(4)对于H2O2的分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图所示的实验,发现滴加FeCl3溶液的试管产生的气泡史剧烈,研究小组得出了“Fe3+的催化效果一定比Cu2+更好”的结论,你认为利用该现象得出的该结论

您最近一年使用:0次
10 . 已知实验室制取氯气的反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:
(1)氧化剂是___________ (填写化学式);还原剂是___________ (填写化学式);氧化产物是___________ (填化学式),HCl在反应中体现的性质___________ 。氧化剂和还原剂个数比是 ___________ 。
(2)该实验室制取氯气反应的离子方程式为___________ 。
(3)用单线桥法表示电子转移的方向和数目:KClO3+6HCl(浓) KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O ___________
(4)请配平反应
①___________ ____H++____ +____
+____ = ____Cr3++____
= ____Cr3++____ +____H2O
+____H2O
②___________ ____Fe2++____H++____ =____Fe3++____N2O↑+____H2O
=____Fe3++____N2O↑+____H2O
 MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:(1)氧化剂是
(2)该实验室制取氯气反应的离子方程式为
(3)用单线桥法表示电子转移的方向和数目:KClO3+6HCl(浓)
 KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O (4)请配平反应
①
 +____
+____ = ____Cr3++____
= ____Cr3++____ +____H2O
+____H2O②
 =____Fe3++____N2O↑+____H2O
=____Fe3++____N2O↑+____H2O
您最近一年使用:0次



