1 . 木犀草素(Luteolin)是有良好抗菌活性和抗氧化能力的黄酮类化合物,以从植物中提取的芦丁(Rutin)为原料制取木犀草素是比较实用的一条工艺路线:在微波辅助下,芦丁与Na2S2O4在NaOH溶液中回流1.5小时生成木犀草素,产率83%。

(1)实验测得,40℃时木犀草素在乙醇(EtOH)中的溶解度(以摩尔分数x计)为2.68×10-3。已知20~60℃木犀草素在乙醇中的溶解焓为20.28kJ·mol-1。请估算25℃时木犀草素在乙醇中的溶解度_______ 。
(2)40℃时,芦丁和木犀草素在乙醇-水混合溶剂中的溶解度曲线如图。根据图示,设计提纯木犀草素的具体方案_______ 。

(3)木犀草素有α和β两种晶相,在热力学上,β相比α相稳定。在恒压下,液态、α相和β相的摩尔Gibbs自由能Gm随温度T的变化关系如图所示。

①请回答哪条线对应α相、β相,说明理由_______ 。
②在相同温度下,α相和β相哪个熵更大_______ ?简述理由_______ 。

(1)实验测得,40℃时木犀草素在乙醇(EtOH)中的溶解度(以摩尔分数x计)为2.68×10-3。已知20~60℃木犀草素在乙醇中的溶解焓为20.28kJ·mol-1。请估算25℃时木犀草素在乙醇中的溶解度
(2)40℃时,芦丁和木犀草素在乙醇-水混合溶剂中的溶解度曲线如图。根据图示,设计提纯木犀草素的具体方案

(3)木犀草素有α和β两种晶相,在热力学上,β相比α相稳定。在恒压下,液态、α相和β相的摩尔Gibbs自由能Gm随温度T的变化关系如图所示。

①请回答哪条线对应α相、β相,说明理由
②在相同温度下,α相和β相哪个熵更大
您最近一年使用:0次
2 . 塑料的发明为现代生活提供了极大的便利,但同时带来了白色污染等诸多环境问题。为了解决可回收问题,研究人员尝试将各种动态共价键作为高分子的交联剂,致力于发展“绿色”的可循环高分子经济。例如,烷基取代的三嗪衍生物中的C-O键,可被作为“休眠”的共价键交联点用于制备完全可回收的热固性聚合物。反应物A在TBD(一种胺,可作为反应的催化剂)存在下与甲醇会发生反应:___________ 。
(2)研究该反应的动力学,研究人员将反应物A与氘代甲醇在TBD存在下发生反应,其中氘代甲醇同时起到溶剂的作用,其密度为0.888g/mL。表征结果如图所示。确定该反应条件下的反应级数。计算至少2个温度下的反应速率常数并计算反应的活化能________ 。___________ 。请提出一种可能的降解回收方式___________ 。
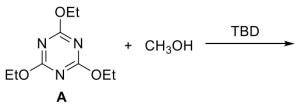
(2)研究该反应的动力学,研究人员将反应物A与氘代甲醇在TBD存在下发生反应,其中氘代甲醇同时起到溶剂的作用,其密度为0.888g/mL。表征结果如图所示。确定该反应条件下的反应级数。计算至少2个温度下的反应速率常数并计算反应的活化能


您最近一年使用:0次
解题方法
3 . 为了实现“碳达峰”和“碳中和”的目标,将CO2转化成可利用的化学能源的“负碳”技术是世界各国关注的焦点。
方法Ⅰ:CO2催化加氢制甲醇。
以CO2、H2为原料合成CH3OH涉及的反应如下:
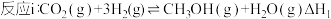
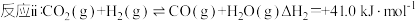

(1)计算反应i的ΔH1=___________ 。
(2)一定温度和催化剂条件下,0.73molH2、0.24molCO2和0.03molN2(已知N2不参与反应)在总压强为3.0MPa的密闭容器中进行上述反应,平衡时CO2的转化率、CH3OH和CO的选择性随温度的变化曲线如图所示。___________ 的变化(填“CO2”、“CH3OH”或“CO”)。
②上述反应体系在一定条件下建立平衡后,下列说法不正确的有___________ (填字母)。
A.降低温度,反应i~iii的正、逆反应速率都减小
B.向容器中再通入少量N2,CO2的平衡转化率下降
C.移去部分H2O(g),反应iii平衡不移动
D.选择合适的催化剂能提高CO2的平衡转化率
E.平衡时CH3OH的体积分数一定小于50%
③某温度下,t1min反应到达平衡,测得容器中CH3OH的体积分数为12.5%。此时用CH3OH的分压表示0~t1时间内的反应速率v(CH3OH)=___________ MPa·min-1。设此时n(CO)=amol,计算该温度下反应ii的平衡常数Kx=___________ (用含有a的代数式表示)。[分压=总压×该组分物质的量分数;对于反应 ,
, 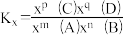 ,x为物质的量分数。]
,x为物质的量分数。]
方法Ⅱ:CO2电解法制聚乙烯
(3)常温常压下,以纳米二氧化钛(TiO2)膜为工作电极,酸性条件下电解CO2可以得到聚乙烯,该电极反应方程式为___________ 。
方法Ⅲ:CO2催化加氢制低碳烯烃(2~4个C的烯烃)
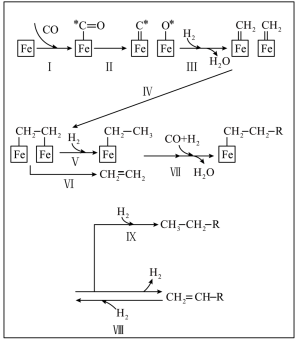
某研究小组使用Zn-Ga-O/SAPO-34双功能催化剂实现了CO2直接合成低碳烯烃,并给出了其可能的反应历程(如图所示)。H2首先在Zn-Ga-O表面解离成2个H*,随后参与到CO2的还原过程;SAPO-34则催化生成的甲醇转化为低碳烯烃。
(4)理论上,反应历程中生成的甲醇与消耗的H*的物质的量之比为___________ 。
方法Ⅰ:CO2催化加氢制甲醇。
以CO2、H2为原料合成CH3OH涉及的反应如下:
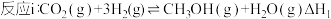
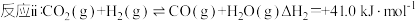

(1)计算反应i的ΔH1=
(2)一定温度和催化剂条件下,0.73molH2、0.24molCO2和0.03molN2(已知N2不参与反应)在总压强为3.0MPa的密闭容器中进行上述反应,平衡时CO2的转化率、CH3OH和CO的选择性随温度的变化曲线如图所示。

②上述反应体系在一定条件下建立平衡后,下列说法不正确的有
A.降低温度,反应i~iii的正、逆反应速率都减小
B.向容器中再通入少量N2,CO2的平衡转化率下降
C.移去部分H2O(g),反应iii平衡不移动
D.选择合适的催化剂能提高CO2的平衡转化率
E.平衡时CH3OH的体积分数一定小于50%
③某温度下,t1min反应到达平衡,测得容器中CH3OH的体积分数为12.5%。此时用CH3OH的分压表示0~t1时间内的反应速率v(CH3OH)=
 ,
, 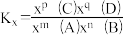 ,x为物质的量分数。]
,x为物质的量分数。]方法Ⅱ:CO2电解法制聚乙烯
(3)常温常压下,以纳米二氧化钛(TiO2)膜为工作电极,酸性条件下电解CO2可以得到聚乙烯,该电极反应方程式为
方法Ⅲ:CO2催化加氢制低碳烯烃(2~4个C的烯烃)
某研究小组使用Zn-Ga-O/SAPO-34双功能催化剂实现了CO2直接合成低碳烯烃,并给出了其可能的反应历程(如图所示)。H2首先在Zn-Ga-O表面解离成2个H*,随后参与到CO2的还原过程;SAPO-34则催化生成的甲醇转化为低碳烯烃。

(4)理论上,反应历程中生成的甲醇与消耗的H*的物质的量之比为
您最近一年使用:0次
解题方法
4 . 海水中锂的提取
随着锂电池的广泛应用,锂已成为重要的战略资源,被称为白色石油。据估计,海水中锂的总含量为陆地锂总含量的5000倍以上,但海水中锂的质量浓度仅为0.1-0.2ppm,从海水提取锂首先需要对低浓度的Li+进行选择性富集。Li+能够嵌入某些氧化物并在一定条件下脱出,据此可以进行Li+的富集。
(1)以Li2CO3和MnO2为原料,充分混合后在720°C下煅烧3h,冷至室温后即可得到复合氧化物LiMn2O4(LMO)。用1molL-1的HCl在60°C处理LMO,将其中所有Li+置换后得到HMO,HMO可以和Li+反应再生成LMO,然后LMO与酸作用脱出Li+从而实现Li+富集。如此,可以循环处理。
①写出合成LiMn2O4的方程式_____ 。
②用酸处理LMO时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中Mn的平均氧化态有所升高,写出副反应对应的化学方程式。这一副反应对再生后的HMO的锂富集性能有何影响_____ ?
(2)利用电化学富集锂也是有效的方法之一、某电化学系统如图所示,其包含两个电池单元,中间区域置有具有一维孔道结构的λ-MnO2,该孔道可以容纳合适的阳离子进出。MnO2电极通过阳离子交换膜与两个电化学池中的对电极隔开,腔室1和2中的电解质分别为0.5M的Na2SO4.和0.1M的LiOH.该电化学系统的工作步骤如下:

i.向MnO2所在腔室通入海水,启动电源1,使海水中的Li+进入MnO2结构而形成LixMn2O4;
ii.关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使LixMn2O4中的Li+脱出进入腔室2。
①为衡量MnO2对Li+的富集效果,将0.50M的LiC1溶液通入MnO2(4.8mg)所在腔室,启动电源1,使电流恒定在5.0mA,累计工作325s后发现MnO2的电极电势快速下降,计算所得LixMn2O4中的x_____ 。
②写出上述过程中发生腔室2中阴极和阳极上的电极反应_____ 。
随着锂电池的广泛应用,锂已成为重要的战略资源,被称为白色石油。据估计,海水中锂的总含量为陆地锂总含量的5000倍以上,但海水中锂的质量浓度仅为0.1-0.2ppm,从海水提取锂首先需要对低浓度的Li+进行选择性富集。Li+能够嵌入某些氧化物并在一定条件下脱出,据此可以进行Li+的富集。
(1)以Li2CO3和MnO2为原料,充分混合后在720°C下煅烧3h,冷至室温后即可得到复合氧化物LiMn2O4(LMO)。用1molL-1的HCl在60°C处理LMO,将其中所有Li+置换后得到HMO,HMO可以和Li+反应再生成LMO,然后LMO与酸作用脱出Li+从而实现Li+富集。如此,可以循环处理。
①写出合成LiMn2O4的方程式
②用酸处理LMO时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中Mn的平均氧化态有所升高,写出副反应对应的化学方程式。这一副反应对再生后的HMO的锂富集性能有何影响
(2)利用电化学富集锂也是有效的方法之一、某电化学系统如图所示,其包含两个电池单元,中间区域置有具有一维孔道结构的λ-MnO2,该孔道可以容纳合适的阳离子进出。MnO2电极通过阳离子交换膜与两个电化学池中的对电极隔开,腔室1和2中的电解质分别为0.5M的Na2SO4.和0.1M的LiOH.该电化学系统的工作步骤如下:

i.向MnO2所在腔室通入海水,启动电源1,使海水中的Li+进入MnO2结构而形成LixMn2O4;
ii.关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使LixMn2O4中的Li+脱出进入腔室2。
①为衡量MnO2对Li+的富集效果,将0.50M的LiC1溶液通入MnO2(4.8mg)所在腔室,启动电源1,使电流恒定在5.0mA,累计工作325s后发现MnO2的电极电势快速下降,计算所得LixMn2O4中的x
②写出上述过程中发生腔室2中阴极和阳极上的电极反应
您最近一年使用:0次
5 . 二氧化碳( )的高值化利用是解决全球气候变暖和能源短缺问题的重要举措,
)的高值化利用是解决全球气候变暖和能源短缺问题的重要举措,低碳烯烃 作为基础化工原料,是 加氢转化的主要产品之一、
加氢转化的主要产品之一、
请回答:
(1)以合成 为例,其合成反应为:
为例,其合成反应为:

①已知 的燃烧热为
的燃烧热为 ;
;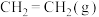 的燃烧热为
的燃烧热为 ;
; 的热效应为
的热效应为 ,则
,则
___________ (请用 、
、 、
、 表示)
表示)
②该反应在较低温度时能自发进行,可能原因为___________ 。
③在体积为V L的恒容密闭容器中,以 的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为
的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为___________ , 温度下该反应的平衡常数
温度下该反应的平衡常数 为
为___________ 。 加氢制低碳烯烃主要包含以下两步反应:
加氢制低碳烯烃主要包含以下两步反应:
第一步: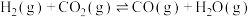

第二步: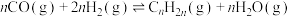

第二步的机理及可能的副反应如图: 的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol
的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol
①下列说法不正确的是___________ 。
A.第一步反应中,在催化剂表面, 倾向于通过给出电子的方式进行活化
倾向于通过给出电子的方式进行活化
B.Fe基催化剂的反应活性位点间不宜相距太远,否则不利于碳链的增长
C.Fe基催化剂对C原子吸附能力越强,越有利提高短链烯烃的比例
D.该过程中可能产生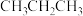 等副产品
等副产品
②在其他条件恒定的情况下,适当降低原料气的流速, 的转化率将
的转化率将___________ (填“增大”或“减小”),原因为___________ ;产物中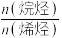 将
将___________ ,原因为___________ 。(结合反应机理中的步骤来回答)
 )的高值化利用是解决全球气候变暖和能源短缺问题的重要举措,
)的高值化利用是解决全球气候变暖和能源短缺问题的重要举措, 加氢转化的主要产品之一、
加氢转化的主要产品之一、请回答:
(1)以合成
 为例,其合成反应为:
为例,其合成反应为:

①已知
 的燃烧热为
的燃烧热为 ;
;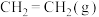 的燃烧热为
的燃烧热为 ;
; 的热效应为
的热效应为 ,则
,则
 、
、 、
、 表示)
表示)②该反应在较低温度时能自发进行,可能原因为
③在体积为V L的恒容密闭容器中,以
 的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为
的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为 温度下该反应的平衡常数
温度下该反应的平衡常数 为
为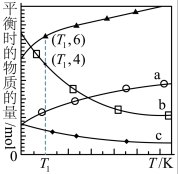
 加氢制低碳烯烃主要包含以下两步反应:
加氢制低碳烯烃主要包含以下两步反应:第一步:
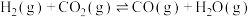

第二步:
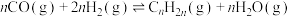

第二步的机理及可能的副反应如图:
 的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol
的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol①下列说法不正确的是
A.第一步反应中,在催化剂表面,
 倾向于通过给出电子的方式进行活化
倾向于通过给出电子的方式进行活化B.Fe基催化剂的反应活性位点间不宜相距太远,否则不利于碳链的增长
C.Fe基催化剂对C原子吸附能力越强,越有利提高短链烯烃的比例
D.该过程中可能产生
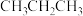 等副产品
等副产品②在其他条件恒定的情况下,适当降低原料气的流速,
 的转化率将
的转化率将 将
将
您最近一年使用:0次
6 . 为了实现“碳达峰”和“碳中和”的目标,将CO2转化成可利用的化学能源的“负碳”技术是世界各国关注的焦点。
方法Ⅰ:CO2催化加氢制甲醇。
以CO2、H2为原料合成CH3OH涉及的反应如下:
反应i:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1=-49.0 kJ·mol-1
CH3OH(g) + H2O(g) ΔH1=-49.0 kJ·mol-1
反应ii:CO2(g) + H2(g) CO(g) + H2O(g) ΔH2= +41.0 kJ·mol-1
CO(g) + H2O(g) ΔH2= +41.0 kJ·mol-1
反应iii:CO(g) + 2H2(g) CH3OH(g) ΔH3=
CH3OH(g) ΔH3=
(1)计算反应iii的ΔH3=___________ 。
(2)一定温度和催化剂条件下,0.73mol H2、0.24mol CO2和0.03mol N2(已知N2不参与反应)在总压强为3.0MPa的密闭容器中进行上述反应,平衡时CO2的转化率、CH3OH和CO的选择性随温度的变化曲线如图所示。
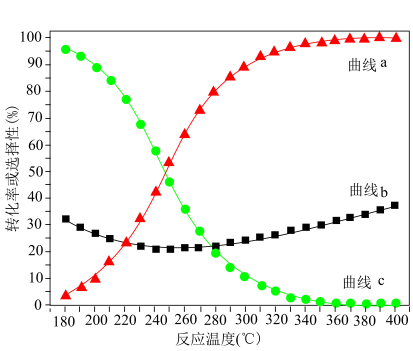
①图中曲线c表示物质___________ 的变化(填“CO2”“CH3OH”或“CO”)。
②上述反应体系在一定条件下建立平衡后,下列说法不正确 的有___________ (填字母)。
A.降低温度,反应i~iii的正、逆反应速率都减小
B.向容器中再通入少量N2,CO2的平衡转化率下降
C.移去部分H2O(g),反应iii向正反应方向衡移动
D.选择合适的催化剂能提高CO2的平衡转化率
③某温度下,t1 min反应到达平衡,测得容器中CH3OH的体积分数为12.5%。此时用CH3OH的分压表示0-t1时间内的反应速率v(CH3OH)=___________ MPa·min-1。设此时n(CO) = a mol,计算该温度下反应ii的平衡常数Kx=___________ (用含有a的代数式表示)。[已知:分压=总压 × 该组分物质的量分数;对于反应mA(g) + nB(g) pC(g) + qD(g),
pC(g) + qD(g),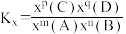 ,x为物质的量分数。]
,x为物质的量分数。]
方法Ⅱ:CO2电解法制甲醇
利用电解原理,可将CO2转化为CH3OH,其装置如图所示:
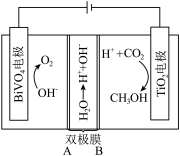
(3)双极膜B侧为___________ (填“阴离子”或“阳离子”)交换膜。
(4)TiO2电极上电极反应方程式:___________ 。
方法Ⅲ:CO2催化加氢制低碳烯烃(2~4个C的烯烃)
某研究小组使用Zn-Ga-O/SAPO-34双功能催化剂实现了CO2直接合成低碳烯烃,并给出了其可能的反应历程(如图所示)。H2首先在Zn-Ga-O表面解离成2个H*,随后参与到CO2的还原过程;SAPO-34则催化生成的甲醇转化为低碳烯烃。
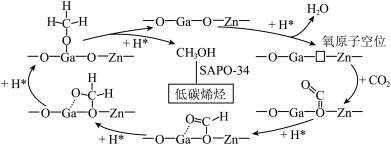
注:☐表示氧原子空位,*表示吸附在催化剂上的微粒。
(5)理论上,反应历程中消耗的H*与生成的甲醇的物质的量之比为___________ 。
方法Ⅰ:CO2催化加氢制甲醇。
以CO2、H2为原料合成CH3OH涉及的反应如下:
反应i:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH1=-49.0 kJ·mol-1
CH3OH(g) + H2O(g) ΔH1=-49.0 kJ·mol-1反应ii:CO2(g) + H2(g)
 CO(g) + H2O(g) ΔH2= +41.0 kJ·mol-1
CO(g) + H2O(g) ΔH2= +41.0 kJ·mol-1反应iii:CO(g) + 2H2(g)
 CH3OH(g) ΔH3=
CH3OH(g) ΔH3=(1)计算反应iii的ΔH3=
(2)一定温度和催化剂条件下,0.73mol H2、0.24mol CO2和0.03mol N2(已知N2不参与反应)在总压强为3.0MPa的密闭容器中进行上述反应,平衡时CO2的转化率、CH3OH和CO的选择性随温度的变化曲线如图所示。

①图中曲线c表示物质
②上述反应体系在一定条件下建立平衡后,下列说法
A.降低温度,反应i~iii的正、逆反应速率都减小
B.向容器中再通入少量N2,CO2的平衡转化率下降
C.移去部分H2O(g),反应iii向正反应方向衡移动
D.选择合适的催化剂能提高CO2的平衡转化率
③某温度下,t1 min反应到达平衡,测得容器中CH3OH的体积分数为12.5%。此时用CH3OH的分压表示0-t1时间内的反应速率v(CH3OH)=
 pC(g) + qD(g),
pC(g) + qD(g),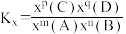 ,x为物质的量分数。]
,x为物质的量分数。] 方法Ⅱ:CO2电解法制甲醇
利用电解原理,可将CO2转化为CH3OH,其装置如图所示:

(3)双极膜B侧为
(4)TiO2电极上电极反应方程式:
方法Ⅲ:CO2催化加氢制低碳烯烃(2~4个C的烯烃)
某研究小组使用Zn-Ga-O/SAPO-34双功能催化剂实现了CO2直接合成低碳烯烃,并给出了其可能的反应历程(如图所示)。H2首先在Zn-Ga-O表面解离成2个H*,随后参与到CO2的还原过程;SAPO-34则催化生成的甲醇转化为低碳烯烃。

注:☐表示氧原子空位,*表示吸附在催化剂上的微粒。
(5)理论上,反应历程中消耗的H*与生成的甲醇的物质的量之比为
您最近一年使用:0次
解题方法
7 . 三四氢呋喃合氯化铬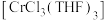 是一种重要的有机反应的催化剂。某研究小组以
是一种重要的有机反应的催化剂。某研究小组以 (绿色固体)、
(绿色固体)、 、THF(四氢呋喃,液体)等物质为原料制备三四氢呋喃合氯化铬的装置如下图。
、THF(四氢呋喃,液体)等物质为原料制备三四氢呋喃合氯化铬的装置如下图。
I.无水 (紫色固体,易升华)的制备装置如图甲所示(夹持装置略)。
(紫色固体,易升华)的制备装置如图甲所示(夹持装置略)。
(1)仪器a的名称为___________ 。
(2)本实验持续通入 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、___________ 。
(3)反应管的温度升到660℃时发生反应,生成 和
和 (光气),其化学方程式为
(光气),其化学方程式为___________ 。
(4) 有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是
有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是___________ (填化学式)。
(5)反应管右端有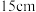 在加热炉外,其作用是
在加热炉外,其作用是___________ 。
II. 的合成装置如图乙所示(搅拌和夹持装置略):
的合成装置如图乙所示(搅拌和夹持装置略):
将制备的无水 和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF.制备反应的原理为
和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF.制备反应的原理为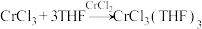
实验时烧瓶中THF受热蒸发,蒸气沿“索氏提取器”导管2上升至球形冷凝管,冷凝后滴入滤纸套筒内与套简内的固体物质接触进发生反应。当液面达到“索氏提取器”虹吸管3顶端时,经虹吸管3返回双颈烧瓶。
从而实现了THF与 的连续反应及产物的连续萃取
的连续反应及产物的连续萃取
(6)合成中加入Zn的目的是___________ (用离子方程式表示)。
(7) 和
和 在THF中的溶解性分别为
在THF中的溶解性分别为___________ 、___________ (填“溶”或“不溶”)。
(8)合成反应完成后,取下双颈烧瓶,蒸发THF得到固体产品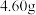 。则该实验的产率为
。则该实验的产率为___________ %(保留小数点后两位)。[已知: 的摩尔质量为
的摩尔质量为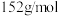 ;
; 的摩尔质量为
的摩尔质量为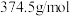 ]
]
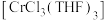 是一种重要的有机反应的催化剂。某研究小组以
是一种重要的有机反应的催化剂。某研究小组以 (绿色固体)、
(绿色固体)、 、THF(四氢呋喃,液体)等物质为原料制备三四氢呋喃合氯化铬的装置如下图。
、THF(四氢呋喃,液体)等物质为原料制备三四氢呋喃合氯化铬的装置如下图。

I.无水
 (紫色固体,易升华)的制备装置如图甲所示(夹持装置略)。
(紫色固体,易升华)的制备装置如图甲所示(夹持装置略)。(1)仪器a的名称为
(2)本实验持续通入
 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、(3)反应管的温度升到660℃时发生反应,生成
 和
和 (光气),其化学方程式为
(光气),其化学方程式为(4)
 有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是
有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是(5)反应管右端有
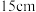 在加热炉外,其作用是
在加热炉外,其作用是II.
 的合成装置如图乙所示(搅拌和夹持装置略):
的合成装置如图乙所示(搅拌和夹持装置略):将制备的无水
 和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF.制备反应的原理为
和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF.制备反应的原理为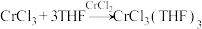
实验时烧瓶中THF受热蒸发,蒸气沿“索氏提取器”导管2上升至球形冷凝管,冷凝后滴入滤纸套筒内与套简内的固体物质接触进发生反应。当液面达到“索氏提取器”虹吸管3顶端时,经虹吸管3返回双颈烧瓶。
从而实现了THF与
 的连续反应及产物的连续萃取
的连续反应及产物的连续萃取(6)合成中加入Zn的目的是
(7)
 和
和 在THF中的溶解性分别为
在THF中的溶解性分别为(8)合成反应完成后,取下双颈烧瓶,蒸发THF得到固体产品
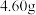 。则该实验的产率为
。则该实验的产率为 的摩尔质量为
的摩尔质量为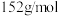 ;
; 的摩尔质量为
的摩尔质量为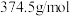 ]
]
您最近一年使用:0次
2023-10-13更新
|
250次组卷
|
4卷引用:江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题
8 . 亚硫酰氯( ,熔点
,熔点 ,沸点
,沸点 ,易水解生成
,易水解生成 和
和 )是一种重要的化学试剂,广泛用于有机合成。制备亚硫酰氯的两种方法:
)是一种重要的化学试剂,广泛用于有机合成。制备亚硫酰氯的两种方法:
方法1:以五氯化磷和二氧化硫为原料,发生反应:
方法2:以三氧化硫和二氯化硫为原料。
(1)方法1反应的过程中是否存在电子转移_______ ?
(2)写出方法2的化学方程式_______ 。
(3)某科研小组测定亚硫酰氯产品的纯度。步骤如下:
步骤一、用分析天平准确称取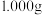 样品,小心地将样品溶于
样品,小心地将样品溶于 的氢氧化钠溶液中,充分反应后,配成
的氢氧化钠溶液中,充分反应后,配成 试样溶液。
试样溶液。
步骤二、用移液管吸取 试样溶液于
试样溶液于 碘量瓶中,加入两滴对硝基苯酚指示剂,滴加
碘量瓶中,加入两滴对硝基苯酚指示剂,滴加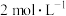 盐酸至黄色刚好消失,加入
盐酸至黄色刚好消失,加入 碘标准溶液,避光放置
碘标准溶液,避光放置 。
。
步骤三、用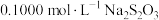 标准溶液返滴定过量的
标准溶液返滴定过量的 ,近终点时加入淀粉溶液,继续滴定至终点,消耗标准溶液
,近终点时加入淀粉溶液,继续滴定至终点,消耗标准溶液 。
。
①指出步骤一中“配成 试样溶液”所必需的定量玻璃仪器的名称
试样溶液”所必需的定量玻璃仪器的名称_______ 。
②指出步骤二中滴加盐酸的目的_______ 。
③叙述步骤三中滴定终点的现象_______ 。
④计算样品的纯度(用含有V的代数式表示)_______ 。
 ,熔点
,熔点 ,沸点
,沸点 ,易水解生成
,易水解生成 和
和 )是一种重要的化学试剂,广泛用于有机合成。制备亚硫酰氯的两种方法:
)是一种重要的化学试剂,广泛用于有机合成。制备亚硫酰氯的两种方法:方法1:以五氯化磷和二氧化硫为原料,发生反应:

方法2:以三氧化硫和二氯化硫为原料。
(1)方法1反应的过程中是否存在电子转移
(2)写出方法2的化学方程式
(3)某科研小组测定亚硫酰氯产品的纯度。步骤如下:
步骤一、用分析天平准确称取
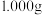 样品,小心地将样品溶于
样品,小心地将样品溶于 的氢氧化钠溶液中,充分反应后,配成
的氢氧化钠溶液中,充分反应后,配成 试样溶液。
试样溶液。步骤二、用移液管吸取
 试样溶液于
试样溶液于 碘量瓶中,加入两滴对硝基苯酚指示剂,滴加
碘量瓶中,加入两滴对硝基苯酚指示剂,滴加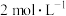 盐酸至黄色刚好消失,加入
盐酸至黄色刚好消失,加入 碘标准溶液,避光放置
碘标准溶液,避光放置 。
。步骤三、用
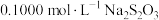 标准溶液返滴定过量的
标准溶液返滴定过量的 ,近终点时加入淀粉溶液,继续滴定至终点,消耗标准溶液
,近终点时加入淀粉溶液,继续滴定至终点,消耗标准溶液 。
。①指出步骤一中“配成
 试样溶液”所必需的定量玻璃仪器的名称
试样溶液”所必需的定量玻璃仪器的名称②指出步骤二中滴加盐酸的目的
③叙述步骤三中滴定终点的现象
④计算样品的纯度(用含有V的代数式表示)
您最近一年使用:0次
名校
解题方法
9 . 含氮化合物在生产生活中有重要的应用。请回答:
(1) 与含硫化合物的热化学方程式如下:
与含硫化合物的热化学方程式如下:
反应I: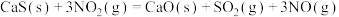
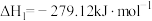

反应II:
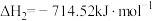

反应III:



_______  ,三个反应的平衡常数的
,三个反应的平衡常数的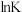 随温度变化关系如图所示,则表示
随温度变化关系如图所示,则表示 的曲线是
的曲线是_______ 。
(2)合成氨工厂以“水煤气”和 为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、
为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、 、
、 、
、 的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:
的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:
 ,装置如图。
,装置如图。
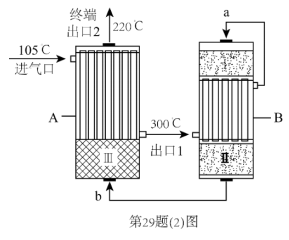
①温度比较:气流a_______ 气流b(填“>”“<”或“=”)。
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:_______ 。
③下列说法正确的是_______ 。
A.焦炭与水蒸气制水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.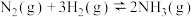
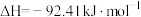 反应器温度越低,终端出口2收率越高
反应器温度越低,终端出口2收率越高
C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出
D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
(3)已知水中存在电离平衡 ,称为自偶电离。-33℃液氨中也存在自偶电离,请写出液氨中的自偶电离方程式:
,称为自偶电离。-33℃液氨中也存在自偶电离,请写出液氨中的自偶电离方程式:_______ ,液氨自偶电离平衡常数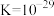 ,在100mL液氨中加入0.0001 mol
,在100mL液氨中加入0.0001 mol  固体,溶解,并完全电离(忽略体积变化),则
固体,溶解,并完全电离(忽略体积变化),则
_______  。金属钾能溶解于液氨中形成蓝色的液氨溶液,反应的化学方程式为
。金属钾能溶解于液氨中形成蓝色的液氨溶液,反应的化学方程式为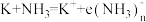 (电子的氨合物,显蓝色),加入
(电子的氨合物,显蓝色),加入 固体后生成氢气,请写出离子方程式
固体后生成氢气,请写出离子方程式_______ 。
(1)
 与含硫化合物的热化学方程式如下:
与含硫化合物的热化学方程式如下:反应I:
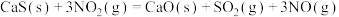
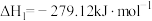

反应II:

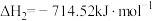

反应III:




 ,三个反应的平衡常数的
,三个反应的平衡常数的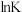 随温度变化关系如图所示,则表示
随温度变化关系如图所示,则表示 的曲线是
的曲线是
(2)合成氨工厂以“水煤气”和
 为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、
为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、 、
、 、
、 的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:
的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:
 ,装置如图。
,装置如图。
①温度比较:气流a
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:
③下列说法正确的是
A.焦炭与水蒸气制水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.
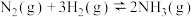
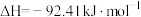 反应器温度越低,终端出口2收率越高
反应器温度越低,终端出口2收率越高C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出

D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
(3)已知水中存在电离平衡
 ,称为自偶电离。-33℃液氨中也存在自偶电离,请写出液氨中的自偶电离方程式:
,称为自偶电离。-33℃液氨中也存在自偶电离,请写出液氨中的自偶电离方程式: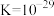 ,在100mL液氨中加入0.0001 mol
,在100mL液氨中加入0.0001 mol  固体,溶解,并完全电离(忽略体积变化),则
固体,溶解,并完全电离(忽略体积变化),则
 。金属钾能溶解于液氨中形成蓝色的液氨溶液,反应的化学方程式为
。金属钾能溶解于液氨中形成蓝色的液氨溶液,反应的化学方程式为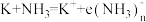 (电子的氨合物,显蓝色),加入
(电子的氨合物,显蓝色),加入 固体后生成氢气,请写出离子方程式
固体后生成氢气,请写出离子方程式
您最近一年使用:0次
10 . Ni-Cd蓄电池是一类重要的电池,其具有使用寿命长、放电电压稳定、机械性能好等优点,广泛应用于现代军事及航天事业等领域。其中,Ni-Cd蓄电池的正极活性物质为 。资料显示,目前T业上常用化学沉淀法和粉末金属法等方法来制备
。资料显示,目前T业上常用化学沉淀法和粉末金属法等方法来制备 。
。
Ⅰ.化学沉淀法的生产流程图如下所示:
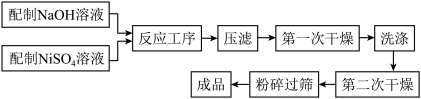
(1)写出该合成方法的化学反应方程式。_______
(2)该反应若在弱碱性条件下进行,则得到碱式硫酸盐 沉淀,请写出该化学反应方程式。
沉淀,请写出该化学反应方程式。_______
(3)在“反应工序”中, 溶液以喷淋形式加入到不断搅拌的过量的NaOH溶液中,搅拌的主要目的是什么?
溶液以喷淋形式加入到不断搅拌的过量的NaOH溶液中,搅拌的主要目的是什么?_______
(4)蒸汽干燥时,干燥温度不能超过200℃,为什么?_______
(5)“洗涤”过程的目的是洗去什么离子?可用什么溶液检验该离子是否洗净?_______
Ⅱ.粉末金属法是以粉末状金属镍为原料,通过镍粉在适当物理化学条件下的氧化水解反应来制备 。
。
(6)写出该方法的化学反应方程式。_______
(7)从动力学角度考虑,通常条件下该反应速度很小,请写出提高反应速率的方法(一条即可)。_______
 。资料显示,目前T业上常用化学沉淀法和粉末金属法等方法来制备
。资料显示,目前T业上常用化学沉淀法和粉末金属法等方法来制备 。
。Ⅰ.化学沉淀法的生产流程图如下所示:

(1)写出该合成方法的化学反应方程式。
(2)该反应若在弱碱性条件下进行,则得到碱式硫酸盐
 沉淀,请写出该化学反应方程式。
沉淀,请写出该化学反应方程式。(3)在“反应工序”中,
 溶液以喷淋形式加入到不断搅拌的过量的NaOH溶液中,搅拌的主要目的是什么?
溶液以喷淋形式加入到不断搅拌的过量的NaOH溶液中,搅拌的主要目的是什么?(4)蒸汽干燥时,干燥温度不能超过200℃,为什么?
(5)“洗涤”过程的目的是洗去什么离子?可用什么溶液检验该离子是否洗净?
Ⅱ.粉末金属法是以粉末状金属镍为原料,通过镍粉在适当物理化学条件下的氧化水解反应来制备
 。
。(6)写出该方法的化学反应方程式。
(7)从动力学角度考虑,通常条件下该反应速度很小,请写出提高反应速率的方法(一条即可)。
您最近一年使用:0次



