名校
解题方法
1 . 下列各组性质比较中,正确的是( )
①沸点:HF>HCl>HBr>HI ②离子还原性:S2->Cl->Br->I- ③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al ⑤气态氢化物稳定性:HF>HCl>H2S ⑥半径:O2->F->Na+>Mg2+
①沸点:HF>HCl>HBr>HI ②离子还原性:S2->Cl->Br->I- ③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al ⑤气态氢化物稳定性:HF>HCl>H2S ⑥半径:O2->F->Na+>Mg2+
| A.③④⑤⑥ | B.①②③ | C.②③④ | D.①③④⑤⑥ |
您最近一年使用:0次
2020-05-12更新
|
289次组卷
|
28卷引用:天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题
天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题2016-2017学年河北省邯郸市成安县第一中学高一下学期第一次月考化学试卷安徽省淮北市第一中学2016-2017学年高二下学期期中考试化学试题陕西省西安中学2016-2017学年高一(实验班)下学期期中考试化学试题河南省林州一中分校(林虑中学)2017-2018学年高一4月调研考试化学试题【全国百强校】浙江省余姚中学2018-2019学年高一下学期3月月考化学试题湖北省襄阳市东风中学2018-2019学年高一下学期3月月考化学试题【全国百强校】安徽省黄山市屯溪第一中学2018-2019学年高一下学期期中考试化学试题【全国百强校】安徽省铜陵市第一中学2018-2019学年高一5月月考化学试题内蒙古北京八中乌兰察布分校2018-2019学年高一下学期期中考试化学试题河北省秦皇岛市六校2020届高三上学期期初检测联考化学试题湖北名师联盟(人教版)2019-2020学年高三上学期第二次月考精编仿真金卷化学试题辽宁省大连市第三中学2019-2020学年高三上学期第三次月考化学试题辽宁省锦州市滨海实验中学2019-2020学年高一上学期期末考试化学试题(2019新人教版)人教版高一化学必修2同步练习:第一章第二节第一课时《元素周期律》江苏省南通市如皋市白蒲高级中学2019-2020学年高二下学期第一周测试化学试题山东省临朐县实验中学2020年高一下学期第一次月结学情考试化学试题山东省济南外国语学校2019-2020学年高一3月份月考化学试题江苏省宿迁市宿豫中学2019-2020学年高一下学期四月调研试(奥赛班)化学试题天津滨海新区2020届高三4月份统考化学试题四川省仁寿县文宫中学2019-2020学年高一5月月考化学试题(已下线)【南昌新东方】2020 新建二中 高一(下) 第一次月考 005新疆维吾尔自治区喀什第二中学2019-2020学年高一4月月考化学试题(已下线)【南昌新东方】2019-2020 雷氏中学 高一下 周练江西省抚州市2020-2021学年高一下学期期末考试化学试题内蒙古包头市第四中学2020-2021学年高一下学期4月月考化学试题广西贺州市钟山县钟山中学2020-2021学年高一下学期第一次月考理科化学试题河北省邢台市第二中学2022-2023学年高一上学期期末考试化学试题
真题
名校
2 . 下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中 减小 减小 |
B.将CH3COONa溶液从20℃升温至30℃,溶液中 增大 增大 |
C.向盐酸中加入氨水至中性,溶液中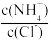 >1 >1 |
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 不变 不变 |
您最近一年使用:0次
2020-04-02更新
|
5594次组卷
|
44卷引用:天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题
天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题【全国百强校】内蒙古自治区鄂尔多斯市第一中学2018-2019学年高二下学期开学考试化学试题云南省马关县二中2020届高三上学期开学考试化学试题2016年全国普通高等学校招生统一考试化学(新课标3卷精编版)2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届四川省成都七中高三上学期10月阶段测化学卷2017届湖北省荆州中学高三上第四次质检化学试卷河北省邯郸市(大名县、永年区、磁县、邯山区)四县2016-2017学年高二下学期期中联考化学试题湖北省荆州中学2018届高三第二次月考化学试题福建省福州市2016-2017学年高二上学期期中考试化学试题安徽省淮北市第一中学2017-2018学年高二上学期第四次月考(12月)化学试题河南省中原名校(即豫南九校)2017-2018学年高二上学期第二次联考化学试题天津市和平区2017-2018学年高二上学期期末考试化学试题天津市静海县第一中学2017-2018学年高二上学期期末终结性检测化学试题江西省南昌市第二中学2017-2018学年高二上学期期末考试化学试题(已下线)《考前20天终极攻略》6月1日 专项一 四大平衡常数及其应用内蒙古北京八中乌兰察布分校2017-2018学年高二下学期第二次调研考试化学试题【全国校级联考】内蒙古赤峰市重点高中(赤峰二中,平煤高级中学等)2017-2018学年高二下学期期末联考(A)化学试题(已下线)解密13 沉淀溶解平衡——备战2018年高考化学之高频考点解密广东省蓝精灵中学2018-2019学年高二上学期联考化学试题四川省成都市七中实验学校2019届高三上学期10月月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(理)上学期期中考试化学试题吉林省松原市扶余市第一中学2018-2019学年高二上学期期末考试化学试题2016年全国普通高等学校招生统一考试化学(全国3卷参考版)河北省秦皇岛市六校2020届高三上学期期初检测联考化学试题陕西省榆林市第二中学2019-2020学年高二上学期期中考试化学试题(已下线)专题8.3 盐类水解(练)-《2020年高考一轮复习讲练测》北京市2019—2020学年高二上学期期末考试模拟试题(选修4人教版 )2019—2020学年高二上学期化学期末复习—选择题专题训练一西藏自治区日喀则市南木林高级中学2020届高三上学期第四次月考理综化学试题重庆市云阳江口中学校2019-2020学年高二上学期第二次月考化学试题江西省南昌市八一中学、洪都中学等六校2019-2020学年高二上学期期末联考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 水解平衡常数的应用(强化练习)重庆市江北中学2019-2020学年高二上学期期末模拟考试化学试题河南省南阳市2019-2020学年高二上学期期终质量评估化学试题安徽省黄山市2019-2020学年高二上学期期末质量检测 化学(理)试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训江西省吉安市省重点中学2020-2021学年高二上学期期中联合考试化学试题江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题河北省安平中学2019-2020学年高二上学期第四次月考化学试题(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)陕西省西安市长安区第一中学2017-2018学年高二上学期第四次教学质量检测化学试题江西省抚州市金溪县第一中学2021-2022学年高二下学期第二次月考化学试题江西省宜春市丰城市第九中学2023-2024学年高一下学期第一次月考化学试题(日新班)
名校
3 . 氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如图。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T·F菌作用下,酸性环境中脱硫过程示意图如图。
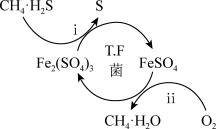
过程i的离子反应方程式为_____ 。
已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T·F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
在转化脱硫中,请在表中选择最佳pH范围是____ <pH<____ ,这样选择的原因是:______ 。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。
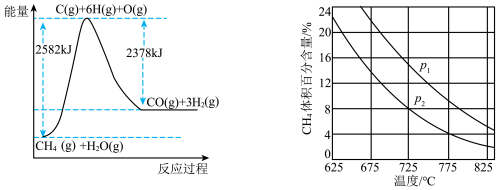
(3)①该过程的热化学方程式是_____ 。
②比较压强P1和P2的大小关系:P1____ P2(选填“<”、“>”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.提纯:将CO2和H2分离得到H2的过程如示意图如图。
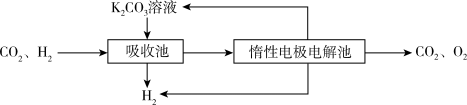
(4)吸收池中发生反应的离子方程式是______ 。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T·F菌作用下,酸性环境中脱硫过程示意图如图。

过程i的离子反应方程式为
已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T·F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
| pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
| Fe2+的氧化速率 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。

(3)①该过程的热化学方程式是
②比较压强P1和P2的大小关系:P1
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.提纯:将CO2和H2分离得到H2的过程如示意图如图。

(4)吸收池中发生反应的离子方程式是
您最近一年使用:0次
2019-09-27更新
|
289次组卷
|
2卷引用:天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题
名校
4 . 砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
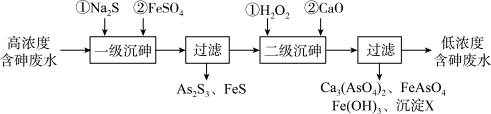
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____ ;砷酸的第一步电离方程式为______ 。
(2)“一级沉砷”中FeSO4的作用是_____ ;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______ 。
(3)沉淀X为____ (填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______ 。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2AsS33-(aq);
2AsS33-(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为
(2)“一级沉砷”中FeSO4的作用是
(3)沉淀X为
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为
您最近一年使用:0次
2019-09-27更新
|
339次组卷
|
2卷引用:天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题
名校
5 . 原子结构与性质
(1)元素As与N同族。As的氢化物沸点比NH3的___ (填“高”或“低”),其判断理由是______ 。
(2)铜原子在基态时的价电子排布式为______ 。
(3)Fe是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:_____ 。与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系____ 。某同学所画基态镁原子的核外电子排布图如图 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了______ 。
(4)K元素处于元素周期表的____ 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有____ 个。
(1)元素As与N同族。As的氢化物沸点比NH3的
(2)铜原子在基态时的价电子排布式为
(3)Fe是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(4)K元素处于元素周期表的
您最近一年使用:0次
2019-09-27更新
|
204次组卷
|
2卷引用:天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题
名校
6 . 设NA为阿伏加 德罗常数值,下列有关叙述正确的是( )
| A.常温常压下,30g乙烷气体中所含有的共价键数目为6NA |
| B.常温下,1LpH=12的氨水溶液中含有NH4+数目为0.01NA |
| C.常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA |
| D.1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
您最近一年使用:0次
2019-09-27更新
|
165次组卷
|
2卷引用:天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题
7 . 我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
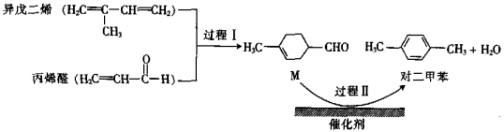
下列说法不正确 的是

下列说法
| A.异戊二烯所有碳原子可能共平面 |
| B.可用溴水鉴别M和对二甲苯 |
| C.对二甲苯的一氯代物有2种 |
| D.M的某种同分异构体含有苯环且能与钠反应放出氢气 |
您最近一年使用:0次
2019-05-26更新
|
1953次组卷
|
16卷引用:天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题
天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题【市级联考】河南省新乡市2019届高三下学期第三次模拟测试理科综合化学试题河北省秦皇岛市六校2020届高三上学期期初检测联考化学试题四川省南充高级中学2019-2020学年高二3月线上月考理综化学试题天津市大港一中2020届高三4月在线测试化学试题天津市六校(静海一中、宝坻一中、杨村一中等)2020届高三下学期第二次联考化学试题宁夏银川唐徕回民中学2020届高三下学期第三次模拟考试理综化学试题河南省驻马店市2019-2020学年高三下学期模拟考试理科综合化学试题湖南省郴州市2020届高三第二次教学质量监测理科综合化学试题广西壮族自治区南宁市第二中学2020届高三下学期模拟考试理综化学试题(已下线)山东省泰安市2019届高三5月全真模拟理综化学试题(已下线)【浙江新东方】高中化学20210304-006湖北省武汉市部分重点中学2020-2021学年高二上学期期末考试化学试题广西南宁市第十中学2020-2021学年高二下学期3月月考化学试题(已下线)【浙江新东方】高三化学20210527-003【2021】【高二下】【期中考】【浙大附玉泉+丁兰】【高中化学】【赵燕丽收集】江西省抚州市七校2021-2022学年高二下学期期中考试化学试题
名校
解题方法
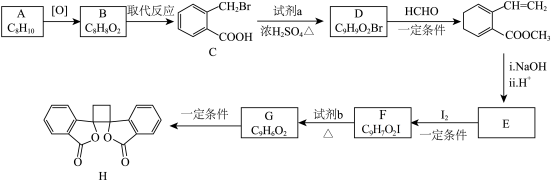
8 . 具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
已知:i.RCH2Br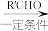 R﹣HC═CH﹣R′
R﹣HC═CH﹣R′
ii.R﹣HC═CH﹣R′

iii.R﹣HC═CH﹣R′

(以上R、R'、R''代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是_______________________ 。
(2)D的结构简式是_______________________________ 。
(3)由F生成G的反应类型是________________________________________ 。
(4)由E与I2在一定条件下反应生成F的化学方程式是_____________________ ;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是_______________________________ 。
(5)下列说法正确的是___________ (选填字母序号)。
A. G存在顺反异构体
B. 由G生成H的反应是加成反应
C. 1 mol G最多可以与1 mol H2发生加成反应
D. 1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 molNaOH
(6)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________

已知:i.RCH2Br
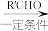 R﹣HC═CH﹣R′
R﹣HC═CH﹣R′ii.R﹣HC═CH﹣R′


iii.R﹣HC═CH﹣R′


(以上R、R'、R''代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是
(2)D的结构简式是
(3)由F生成G的反应类型是
(4)由E与I2在一定条件下反应生成F的化学方程式是
(5)下列说法正确的是
A. G存在顺反异构体
B. 由G生成H的反应是加成反应
C. 1 mol G最多可以与1 mol H2发生加成反应
D. 1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 molNaOH
(6)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成
 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
您最近一年使用:0次
2019-02-14更新
|
884次组卷
|
8卷引用:天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题
天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题【校级联考】湖北省荆州中学、宜昌一中等“荆、荆、襄、宜四地七校考试联盟”2019届高三上学期期末考试理科综合化学试题【校级联考】“荆 、荆、襄、宜四地七校考试联盟”2019届高三下学期2月联考化学试题【全国百强校】江西省宜春市上高二中2019届高三下学期第七次月考理科综合化学试题河北省秦皇岛市六校2020届高三上学期期初检测联考化学试题湖北名师联盟(人教版)2019-2020学年高三上学期第二次月考精编仿真金卷化学试题2020届高三化学二轮冲刺新题专练——有机化学基础选做题专题4.2 有机化学基础(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升
真题
名校
9 . 足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60mL | B.45mL | C.30mL | D.15mL |
您最近一年使用:0次
2019-01-30更新
|
3317次组卷
|
97卷引用:天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题
天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题2016-2017学年辽宁省六校协作体高一下学期期初化学试卷辽宁省葫芦岛市六校协作体2016-2017学年高一下学期期初考试化学试题河北省邢台市第一中学2017-2018学年高一下学期开学考试化学试题辽宁省实验中学东戴河分校2020届高三上学期期初摸底考试化学试题云南省金平县一中2019-2020学年高二上学期开学考试化学试题河南省南阳市内乡县菊潭高级中学2022届高三入学考试化学试题江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题云南省富宁县第一中学校2021-2022学年高三下学期开学考试理综化学试题云南省开远市第一中学校2023-2024学年高一下学期开学考试化学试题2007年普通高等学校招生全国统一考试(四川卷)理综化学部分(已下线)2010—2011学年黑龙江大庆铁人中学高一下学期期中考试化学试卷(已下线)2012届天津市天津一中高三第二次月考化学试卷(已下线)2012-2013学年黑龙江省庆安三中高一上学期期末考试化学试卷(已下线)2015届甘肃省天水市秦安县二中高三上学期期中考试化学试卷2014-2015学年河南省方城县一中高一12月月考理综化学试卷2014-2015学年山东省菏泽市单县五中高一上学期实验班考试化学试卷2014-2015学年山东省淄博市高二下学期期末统考化学试卷2016届山西省曲沃中学高三上学期11月阶段性测试化学试卷2016届四川省广元市广元中学高三上学期第二次阶段测理综化学试卷2016届江西省临川区第二中学高三上学期期中测试化学试卷2015-2016学年河北省武邑中学高一下学期周考化学试卷2016届宁夏银川二中高三模拟考试二理综化学试卷2015-2016学年江苏省前黄高中高一下期末化学试卷2017届河北省邯郸市大名一中高三上学期第一次月考化学试卷2017届河北省武邑中学高三上学期9.18周考化学试卷2017届湖南省长沙市长郡中学高三上月考二化学试卷2017届安徽省淮南二中高三上第二次月考化学试卷2017届辽宁省六校协作体高三上学期期中化学试卷2017届山东省泰安市高三上学期期中化学试卷2016-2017学年湖南省常德市第一中学高一下学期第一次月考(3月)化学试卷2016-2017学年黑龙江省虎林市高级中学高一下学期第二次月考化学试卷天津市静海县第一中学2016-2017学年高一6月月考(文)化学试题河北省故城县高级中学2018届高三9月月考化学试题江西省吉安市新干县第二中学2018届高三上学期第一次月考化学试题山东省济宁市微山县第二中学2018届高三上学期第一次月考化学试题河北省鸡泽县第一中学2018届高三上学期第一次月考化学试题【全国百强校】天津市第一中学2017-2018学年高一下学期期中考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高二下学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【押题专练】福建省厦门市湖滨中学2019届高三上学期第一次阶段检测化学试题(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第3讲 化学计算中常用的几种方法【押题专练】【全国百强校】新疆维吾尔自治区乌鲁木齐市第一中学2019届高三上学期第一次月考(9月)化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》 第四单元 非金属及其化合物单元测试 B卷【全国百强校】宁夏回族自治区吴忠中学2019届高三上学期第三次月考(期中)化学试题山东省德州一中2018-2019学年高一第一学期第三次月考化学试题【全国百强校】四川省成都市成都外国语学校2018-2019学年高二上学期12月月考化学试题【全国百强校】山东省招远市第一中学2018-2019学年高一上学期12月月考化学试题江苏省姜堰第二中学2018-2019学年高二上学期期末考试化学试题内蒙古通辽市实验中学2018-2019学年高一下学期第一次月考化学试题【全国百强校】安徽省黄山市屯溪第一中学2018-2019学年高一下学期期中考试化学试题(已下线)专题2.3 氧化还原反应(讲)-《2020年高考一轮复习讲练测》河北省秦皇岛市六校2020届高三上学期期初检测联考化学试题江西省赣州市寻乌中学2020届高三上学期第一阶段考试化学试题海南省嘉积中学2020届高三上学期第二次月考化学试题(已下线)【新东方】高中化学151陕西省咸阳市三原南郊中学2020届高三第四次月考化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高一上学期期末考试化学试题2020届高三化学二轮冲刺新题专练——硝酸的性质及应用(提升练)夯基提能2020届高三化学选择题对题专练——化学计算中的常见方法和应用(提升练)云南省曲靖市陆良县第八中学2019-2020学年高二上学期12月月考化学试题浙江省宁波市慈溪中学2019届高三化学二轮复习:化学计算(已下线)广西桂林中学2015届高三上学期8月月考理综化学试题广西壮族自治区桂林中学2015年高三上学期第一次月考化学试题广西壮族自治区来宾市金秀县民族中学2019-2020学年高一上学期期末考试化学试题(已下线)上海市奉贤区2010届高三第二次模拟考试化学试题河北省沧州市河间市第四中学2019-2020学年高一下学期期中考试化学试题(已下线)第09讲 氧化还原反应的计算及方程式的配平(精讲)——2021年高考化学一轮复习讲练测福建省厦门第一中学2019-2020学年高一上学期12月月考化学试题浙江省宁波市余姚中学2019-2020学年高二下学期期中考试化学试题福建省泰宁第一中学2020届高三上学期第一阶段考试化学试题福建省龙岩市武平县第一中学2021届高三上学期第一单元过关考试化学试题福建省三明市泰宁一中学2021届高三上学期第二阶段考试化学试题天津市第一中学2021届高三上学期第一次月考化学试题山东省临沂市费县第二中学2019-2020学年高一下学期第三次检测化学试题(已下线)练习16 生活中的含氮化合物-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)专题7 本专题复习提升-高中化学必修第二册苏教版2019黑龙江省哈尔滨市哈师大附中2020-2021学年高一下学期期中考试化学试题吉林江城中学2020-2021学年高一下学期期末考试化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)云南省昆明市云南师范大学附属中学2021-2022学年高一下学期期中考试化学试题广州大学附属中学2021-2022学年高一下学期5月月考化学试题四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(强基班)安徽省青阳县第一中学2021-2022学年高一下学期3月月考化学试题贵州省铜仁市松桃苗族自治县第三高级中学2021-2022学年高一下学期第一次月考化学试题湖南省长沙同升湖实验学校2022-2023学年高三上学期第二次月考化学试题第一章 化学物质及其变化 第5讲 氧化还原反应的计算与方程式的配平河北阜城中学2021-2022学年高一下学期5月月考化学试题(已下线)第5讲 氧化还原反应方程式的配平与计算辽宁省抚顺市六校协作体2022-2023学年高一下学期期末考试化学试题河南省驻马店高级中学2022-2023学年高一下学期第二次月考化学试题(已下线)专题03 物质的量在化学方程式计算中的应用(一题多问)上海市吴淞中学2023-2024学年高一上学期期末质量检测 化学试题05 2024年苏州黄埭高一3月月考山东省淄博市高青县第一中学2023-2024学年高一下学期期中考试化学试题福建省南安市侨光中学2023-2024学年高一下学期4月月考化学试题
11-12高三·湖南岳阳·阶段练习
名校
10 . 2SO2(g) + O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
| n(O2) / mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 / % | 80 | α1 | α2 | |
| A.甲中反应的平衡常数小于乙 |
| B.平衡时,丙中c(SO3)是甲中的2倍 |
| C.该温度下,平衡常数值为400 |
| D.平衡时,甲中O2的转化率大于乙中O2的转化率 |
您最近一年使用:0次
2018-09-29更新
|
462次组卷
|
15卷引用:天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题
天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题(已下线)2013届湖南省岳阳市一中高三第一次质量检测化学试卷(已下线)2012-2013学年陕西省南郑中学高二下学期期中考试化学试卷2015届北京市第66中学高三上学期期中考试化学试卷2015-2016学年福建省厦门市海沧中学高一下学期期末化学试卷2016-2017学年四川省新津中学高二上10月月考化学试卷北京市昌平区2018届高三化学12月月考试题安徽省滁州市民办高中2017-2018学年高二下学期第一次联考化学试题【全国百强校】天津市静海县第一中学2018-2019学年高二上学期9月学生学业能力调研化学试题【全国百强校】吉林省实验中学2018-2019学年高二上学期期中考试化学试题【全国百强校】云南省玉溪市第一中学2018-2019学年高二上学期第二次月考化学试题河北省秦皇岛市六校2020届高三上学期期初检测联考化学试题吉林公主岭范家屯一中2020-2021学年高二上学期期中考试化学试题广东省珠海市第二中学2021-2022学年高二上学期期中考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题



