名校
解题方法
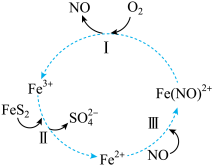
1 . 在酸性条件下,黄铁矿(FeS2)催化氧化反应的离子方程式为:2FeS2+7O2+2H2O=2Fe2++4 +4H+。实现该反应的物质间转化如图。下列分析正确的是
+4H+。实现该反应的物质间转化如图。下列分析正确的是
 +4H+。实现该反应的物质间转化如图。下列分析正确的是
+4H+。实现该反应的物质间转化如图。下列分析正确的是
| A.在酸性条件下,黄铁矿催化氧化中NO做催化剂 |
| B.反应II中Fe3+做氧化剂,FeS2被还原 |
| C.反应I的离子方程式为4Fe(NO)2++O2+4H+=4Fe3++4NO+2H2O,其中Fe(NO)2+做氧化剂 |
| D.反应III的离子方程式为Fe2++NO=Fe(NO)2+,该反应是氧化还原反应 |
您最近一年使用:0次
2021-09-10更新
|
1519次组卷
|
15卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题(已下线)2022年新高考化学时事热点情境化考题---物质循环图贵州省铜仁市第一中学2020届高三上学期第三次月考化学试题2020届高三《新题速递·化学》12月第01期(考点01-06)黑龙江省鹤岗市第一中学2021届高三上学期第一次月考(开学考试)化学试题重庆市秀山高级中学校2021-2022学年高三上学期9月月考化学试题(已下线)第二单元 化学物质及其变化(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)黑龙江省绥化市青冈县第一中学校2022届高三上学期期初考试化学试题安徽省马鞍山市含山县第二中学2021-2022学年高三上学期第一次月考化学试题广东省梅州市大埔县田家炳实验中学2021-2022学年高三上学期第二次月考化学试题海南省东方市琼西中学2021-2022学年高三上学期第二次月考化学试题重庆西南大学附属中学校高 2021-2022学年高三上学期第三次月考化学试题广东省江门市第二中学2021-2022学年高一上学期第一次月考化学试题宁夏银川市景博中学2022-2023学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市普高联谊校2022-2023学年高三上学期期中考试化学试题
名校
2 . 回答下列问题:
(1)在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
①计算20~40s内用N2O4表示的平均反应速率为___ mol·L-1·s-1。
②反应进行至100s后将反应混合物的温度降低,混合气体的颜色___ (填“变浅”“变深”或“不变”)。
③要增大该反应的K值,可采取的措施有___ (填序号)。
A.增大N2O4起始浓度B.向混合气体中通入NO2
C.使用高效催化剂D.升高温度
(2)已知2A2(g)+B2(g) 2C(g)ΔH=-akJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
2C(g)ΔH=-akJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
①a___ (填“>”“=”或“<”)b。
②若将反应温度升高到700℃,该反应的平衡常数将___ (填“增大”“减小”或“不变”)。
③若在原来的容器中,只加入2molC,500℃时充分反应达到平衡后,C的浓度___ (填“>”“=”或“<”)wmol·L-1.
④能说明该反应已经达到平衡状态的是___ 。
a.v(C)=2v(B2)b.容器内压强保持不变
c.v逆(A2)=2v正(B2)d.容器内气体的密度保持不变
⑤使该反应的反应速率增大,且平衡向正反应方向移动的操作是___ 。
a.及时分离出C气体b.适当升高温度
c.增大B2的浓度d.选择高效的催化剂
(1)在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4
 2NO2ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间/s 物质n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②反应进行至100s后将反应混合物的温度降低,混合气体的颜色
③要增大该反应的K值,可采取的措施有
A.增大N2O4起始浓度B.向混合气体中通入NO2
C.使用高效催化剂D.升高温度
(2)已知2A2(g)+B2(g)
 2C(g)ΔH=-akJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
2C(g)ΔH=-akJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。①a
②若将反应温度升高到700℃,该反应的平衡常数将
③若在原来的容器中,只加入2molC,500℃时充分反应达到平衡后,C的浓度
④能说明该反应已经达到平衡状态的是
a.v(C)=2v(B2)b.容器内压强保持不变
c.v逆(A2)=2v正(B2)d.容器内气体的密度保持不变
⑤使该反应的反应速率增大,且平衡向正反应方向移动的操作是
a.及时分离出C气体b.适当升高温度
c.增大B2的浓度d.选择高效的催化剂
您最近一年使用:0次
2021-09-07更新
|
590次组卷
|
4卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题(已下线)专题22 化学平衡 化学平衡常数(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练西藏拉萨中学2021-2022学年高二上学期第一次月考理综化学试题内蒙古乌兰察布市部分学校2021-2022学年高二上学期期中联考化学试题
名校
3 . 写出或完成下列热化学方程式。
(1)下列变化过程,属于放热反应的是____ 。
①浓H2SO4稀释;②酸碱中和反应;③H2在Cl2中燃烧;④Ba(OH)2•8H2O与NH4Cl;⑤铝热反应;⑥碳高温条件下还原CO2。
(2)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ的热量。写出CH4燃烧的热化学方程式__ 。
(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
根据键能数据估算下列反应:CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H为___ 。
(4)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
①Mg(s)+H2(g)=MgH2(s)ΔH1
②Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)ΔH2
求Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH=____ 。
(5)已知反应:N2(g)+3H2(g) 2NH3(g)△H=-92.2kJ/mol,现取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量
2NH3(g)△H=-92.2kJ/mol,现取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___ 92.2kJ(填“大于”“等于”或“小于”),原因是___ 。
(1)下列变化过程,属于放热反应的是
①浓H2SO4稀释;②酸碱中和反应;③H2在Cl2中燃烧;④Ba(OH)2•8H2O与NH4Cl;⑤铝热反应;⑥碳高温条件下还原CO2。
(2)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ的热量。写出CH4燃烧的热化学方程式
(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
| 化学键 | C—H | C—F | H—F | F—F |
| 键能kJ/mol | 414 | 489 | 565 | 155 |
(4)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
①Mg(s)+H2(g)=MgH2(s)ΔH1
②Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)ΔH2
求Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH=
(5)已知反应:N2(g)+3H2(g)
 2NH3(g)△H=-92.2kJ/mol,现取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量
2NH3(g)△H=-92.2kJ/mol,现取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量
您最近一年使用:0次
名校
解题方法
4 . CaS用于制备除虫剂、发光材料等。某课题组拟用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物。
(1)甲同学设计如图实验装置检验气体产物:
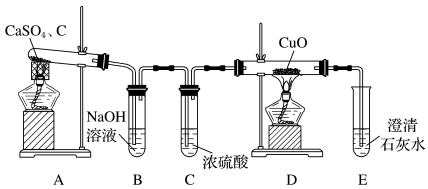
①B装置作用是___ 。
②D和E装置能检验装置A的反应产物是___ 。
③若存在上述反应产物,D和E装置中出现的现象分别是___ 、___ 。
(2)乙同学提出,根据氧化还原反应,A中的气体产物可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计方案(同一种仪器可重复使用)。
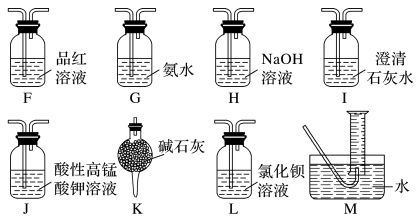
①气流从左至右,仪器连接顺序为A、F、___ 。
②能证明有SO2的现象是___ ;能证明有CO2的现象是___ 。
③除去SO2的离子方程式为___ 。
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1:1:2,写出A中反应的化学方程式___ 。
(1)甲同学设计如图实验装置检验气体产物:

①B装置作用是
②D和E装置能检验装置A的反应产物是
③若存在上述反应产物,D和E装置中出现的现象分别是
(2)乙同学提出,根据氧化还原反应,A中的气体产物可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计方案(同一种仪器可重复使用)。

①气流从左至右,仪器连接顺序为A、F、
②能证明有SO2的现象是
③除去SO2的离子方程式为
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1:1:2,写出A中反应的化学方程式
您最近一年使用:0次
名校
解题方法
5 . 某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如图:(已知乳酸酸性强于碳酸)
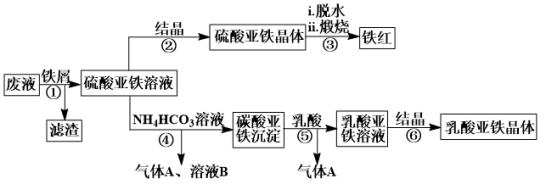
已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO ;
;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2•xH2O↓+H2SO4。
请回答:
(1)步骤①所得滤渣的主要成分为___ ,分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是___ ;步骤②中得到纯净硫酸亚铁晶体的操作为蒸发浓缩、___ 、___ 。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为___ 。
(3)步骤④的离子方程式是___ 。
(4)实验室中常用KMnO4滴定法测定晶体中FeSO4·7H2O的质量分数,取步骤②中所得FeSO4·7H2O晶体样品ag,配成500.00mL溶液,取出25.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000mol•L-1KMnO4溶液25.00mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)__ 。

已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO
 ;
;②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2•xH2O↓+H2SO4。
请回答:
(1)步骤①所得滤渣的主要成分为
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为
(3)步骤④的离子方程式是
(4)实验室中常用KMnO4滴定法测定晶体中FeSO4·7H2O的质量分数,取步骤②中所得FeSO4·7H2O晶体样品ag,配成500.00mL溶液,取出25.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000mol•L-1KMnO4溶液25.00mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)
您最近一年使用:0次
2021-09-07更新
|
261次组卷
|
2卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
6 . A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如图反应关系:
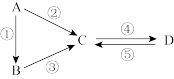
(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式:___ 。
(2)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素位于同一主族,且溶液均显碱性。写出反应②的化学方程式:___ 。
(3)若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式:___ 。
(4)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式:___ 。

(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式:
(2)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素位于同一主族,且溶液均显碱性。写出反应②的化学方程式:
(3)若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式:
(4)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式:
您最近一年使用:0次
名校
7 . 用CH4催化还原NO2可以消除氮氧化物的污染,例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
下列说法不正确的是
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
下列说法不正确的是
| A.由反应①可知CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H<-574kJ·mol-1 |
| B.反应①②转移的电子数相同 |
| C.若用标准状况下4.48LCH4还原NO2至N2,放出的热量为173.4kJ |
| D.若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总物质的量为0.80mol |
您最近一年使用:0次
2021-09-07更新
|
937次组卷
|
7卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题吉林省洮南市第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)第1章 化学反应的热效应(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)浙江省北斗联盟2021-2022学年高二上学期期中联考化学试题湖南省张家界市第一中学2022届高三下学期期中考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第1单元03巩固练山东省淄博市高青县第一中学2023-2024学年高一下学期期中考试化学试题
名校
解题方法
8 . 下列各组澄清溶液中的离子能大量共存,且加入试剂后发生反应的离子方程式书写正确的是
| 选项 | 离子 | 试剂 | 离子方程式 |
| A | NH 、Na+、Fe3+、AlO 、Na+、Fe3+、AlO | 少量铜粉 | 2Fe3++Cu=2Fe2++Cu2+ |
| B | NH 、Fe3+、Br-、SO 、Fe3+、Br-、SO | 过量NaOH | Fe3++3OH-=Fe(OH)3↓ |
| C | K+、Na+、ClO-、SO | 足量SO2 | SO2+H2O+2ClO-=SO +2HClO +2HClO |
| D | K+、Na+、SO 、AlO 、AlO | 少量AlCl3 | Al3++3AlO +6H2O=4Al(OH)3↓ +6H2O=4Al(OH)3↓ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-09-07更新
|
1578次组卷
|
6卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题2021年湖南省高考化学试卷变式题11-19广东省珠海市第二中学2022届高三十月月考化学试题甘肃省张掖市第二中学2021-2022学年高三上学期10月月考化学试题安徽省宣城中学2021-2022学年高二上学期12月月考化学试题(已下线)专题08 化学方程式正误判断—2022年高考化学二轮复习讲练测(全国版)-测试
2018高三·全国·专题练习
名校
9 . 在给定的条件下,下列选项所示的物质间转化均能实现的是
A.Cl2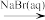 Br2 Br2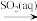 HBr HBr |
B.Fe3O4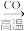 Fe Fe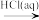 FeCl3 FeCl3 |
C.NaCl Na2CO3 Na2CO3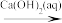 NaOH NaOH |
D.Cu2(OH)2CO3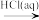 CuCl2 CuCl2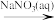 Cu(NO3)2 Cu(NO3)2 |
您最近一年使用:0次
2021-09-07更新
|
421次组卷
|
6卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第2讲 氯及其化合物 (题型专练)安徽省六安市新安中学2022届高三上学期第二次月考化学试题广东省湛江市第二十一中学2021—2022学年高三上学期11月月考化学试题广东省中山市小榄中学2022-2023学年高三上学期第一次月考化学试题黑龙江省佳木斯市第八中学2021-2022学年高三上学期第二次调研(期中)考试化学试题
名校
10 . 设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.1molNa2O2与水完全反应时转移电子数为2NA |
| B.标准状况下,22.4LN2和H2混合气中含2NA个原子 |
| C.将NA个NH3分子溶于1L水中得到1mol·L-1的氨水 |
| D.lmolNa2O2中共含有4NA个离子 |
您最近一年使用:0次
2021-09-07更新
|
407次组卷
|
3卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题(已下线)专题3 从海水中获得的化学物质(章末培优)-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)甘肃省武威市凉州区2022-2023学年高三上学期第二次考试化学试题



