名校
解题方法
1 . 完成下列问题:
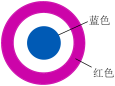
(1)取一块打磨过的生铁片,在其表面滴一滴含酚酞和K3[Fe(CN)6]的食盐水,放置一段时间后,生铁片上出现如图所示“斑痕”,其边缘为红色,中心区域为蓝色,在两色环交界处出现铁锈,生铁片发生___________ 腐蚀,边缘区的电极反应式为___________ 。
(2)区分晶体和非晶体最可靠的方法是___________ 。
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为___________ 。
(4)以多孔铂为电极,如图装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是___________ (填“正极”或“负极”),该电池的负极的电极反应式为___________

用该燃料电池作为电源进行电解,将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为___________ 。
(5)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
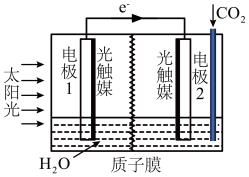
①电极2的电极反应式是___________ 。
②在标准状况下,当产生22.4 L O2时,理论上电极1室液体质量变化___________ g。
(学法题)书写电极反应式时应注意哪些问题___________ 。
(1)取一块打磨过的生铁片,在其表面滴一滴含酚酞和K3[Fe(CN)6]的食盐水,放置一段时间后,生铁片上出现如图所示“斑痕”,其边缘为红色,中心区域为蓝色,在两色环交界处出现铁锈,生铁片发生

(2)区分晶体和非晶体最可靠的方法是
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为
(4)以多孔铂为电极,如图装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是

用该燃料电池作为电源进行电解,将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为
(5)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:

①电极2的电极反应式是
②在标准状况下,当产生22.4 L O2时,理论上电极1室液体质量变化
(学法题)书写电极反应式时应注意哪些问题
您最近一年使用:0次
名校
解题方法
2 . 溶液中的微粒关系。
(1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合:离子浓度大小关系_______ 。
(2)0.1mol/LHA与0.1mol/LNaA等体积混合液(pH<7):离子浓度大小关系(含HA)_________ 。
(3)NH4HSO4溶液与NaOH溶液混合后,溶液呈中性:离子浓度大小关系_________ 。
(4)等浓度的CH3COONa和NaOH混合溶液,物料守恒式为_________ 。
(5)NH4ClO溶液中的质子守恒式为_________ 。
(6)c( )相等的①(NH4)2SO4溶液、②NH4HSO4溶液、③(NH4)2CO3溶液、④NH4Cl溶液,其溶液的物质的量浓度由大到小的顺序为
)相等的①(NH4)2SO4溶液、②NH4HSO4溶液、③(NH4)2CO3溶液、④NH4Cl溶液,其溶液的物质的量浓度由大到小的顺序为_________ (填序号)。
(7)比较不同溶液中同种离子浓度大小,需考虑哪些因素___________ 。
(1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合:离子浓度大小关系
(2)0.1mol/LHA与0.1mol/LNaA等体积混合液(pH<7):离子浓度大小关系(含HA)
(3)NH4HSO4溶液与NaOH溶液混合后,溶液呈中性:离子浓度大小关系
(4)等浓度的CH3COONa和NaOH混合溶液,物料守恒式为
(5)NH4ClO溶液中的质子守恒式为
(6)c(
 )相等的①(NH4)2SO4溶液、②NH4HSO4溶液、③(NH4)2CO3溶液、④NH4Cl溶液,其溶液的物质的量浓度由大到小的顺序为
)相等的①(NH4)2SO4溶液、②NH4HSO4溶液、③(NH4)2CO3溶液、④NH4Cl溶液,其溶液的物质的量浓度由大到小的顺序为(7)比较不同溶液中同种离子浓度大小,需考虑哪些因素
您最近一年使用:0次
名校
解题方法
3 . 物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,请回答:
(1)泡沫灭火剂包括 溶液(约1
溶液(约1 ),
), 溶液(约1
溶液(约1 )及起泡剂,使用时发生反应的离子方程式为
)及起泡剂,使用时发生反应的离子方程式为___________ 。
(2)含等物质的量的 和
和 的溶液物料守恒式为
的溶液物料守恒式为___________ 。
(3)向2 0.1
0.1
 溶液中加入1
溶液中加入1 0.1
0.1 氨水,有白色沉淀产生,继续加入4滴0.1
氨水,有白色沉淀产生,继续加入4滴0.1
 溶液,观察到白色沉淀变为红褐色。试用离子方程式解释白色沉淀变为红褐色的原因:
溶液,观察到白色沉淀变为红褐色。试用离子方程式解释白色沉淀变为红褐色的原因:___________ 。
(4)向 溶液中滴加氨水产生蓝色沉淀,若所得溶液
溶液中滴加氨水产生蓝色沉淀,若所得溶液 ,已知
,已知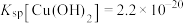 ,则溶液中
,则溶液中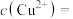
______  。
。
(5)某溶液只含 、
、 、
、 三种金属离子,且三种离子沉淀时的
三种金属离子,且三种离子沉淀时的 如下表所示:为制备
如下表所示:为制备 ,除去
,除去 、
、 离子应该先加入
离子应该先加入_________ ,然后再加入________ ,调节pH范围为_______ 。
(1)泡沫灭火剂包括
 溶液(约1
溶液(约1 ),
), 溶液(约1
溶液(约1 )及起泡剂,使用时发生反应的离子方程式为
)及起泡剂,使用时发生反应的离子方程式为(2)含等物质的量的
 和
和 的溶液物料守恒式为
的溶液物料守恒式为(3)向2
 0.1
0.1
 溶液中加入1
溶液中加入1 0.1
0.1 氨水,有白色沉淀产生,继续加入4滴0.1
氨水,有白色沉淀产生,继续加入4滴0.1
 溶液,观察到白色沉淀变为红褐色。试用离子方程式解释白色沉淀变为红褐色的原因:
溶液,观察到白色沉淀变为红褐色。试用离子方程式解释白色沉淀变为红褐色的原因:(4)向
 溶液中滴加氨水产生蓝色沉淀,若所得溶液
溶液中滴加氨水产生蓝色沉淀,若所得溶液 ,已知
,已知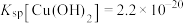 ,则溶液中
,则溶液中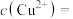
 。
。(5)某溶液只含
 、
、 、
、 三种金属离子,且三种离子沉淀时的
三种金属离子,且三种离子沉淀时的 如下表所示:为制备
如下表所示:为制备 ,除去
,除去 、
、 离子应该先加入
离子应该先加入| 金属离子 |  |  |  | |
 | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
您最近一年使用:0次
名校
解题方法
4 . 现有常温下浓度均为1 mol∙L−1的下列四种溶液:① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④NaOH溶液、⑤
溶液、④NaOH溶液、⑤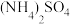 溶液。
溶液。
(1)这5种溶液pH由大到小的顺序是_______ ,其中由水电离的 浓度最小的是
浓度最小的是_______ 。 填序号
填序号
(2)②中各离子浓度由大到小的顺序是_______ , 的水解平衡常数Kh=
的水解平衡常数Kh=_____ 。(已知碳酸的电离常数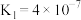 、
、 )
)
(3)向③中通入少量氨气,此时 的值
的值_____  填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” 。
。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积_____ ④的体积(填“>” “<” 或“=”)。
(5)一定量的稀 溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是
溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是______ (填字母)。
A.加 固体 B.加
固体 B.加 固体 C.加
固体 C.加 溶液
溶液
D.加氨水 E.加 溶液
溶液
(6)常温下,向 溶液中加入
溶液中加入 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为_______ ,若将所得悬浊液的pH调整为4,则溶液中 的溶液为
的溶液为______ mol∙L−1 (已知常温下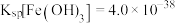 )。
)。
 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④NaOH溶液、⑤
溶液、④NaOH溶液、⑤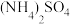 溶液。
溶液。(1)这5种溶液pH由大到小的顺序是
 浓度最小的是
浓度最小的是 填序号
填序号
(2)②中各离子浓度由大到小的顺序是
 的水解平衡常数Kh=
的水解平衡常数Kh=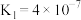 、
、 )
)(3)向③中通入少量氨气,此时
 的值
的值 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” 。
。(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积
(5)一定量的稀
 溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是
溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是A.加
 固体 B.加
固体 B.加 固体 C.加
固体 C.加 溶液
溶液 D.加氨水 E.加
 溶液
溶液(6)常温下,向
 溶液中加入
溶液中加入 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为 的溶液为
的溶液为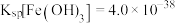 )。
)。
您最近一年使用:0次
名校
解题方法
5 . 在科研和工农业生产中,氮、氯、砷(As)、铁、铜等元素形成的单质及其化合物有着广泛的应用。请回答下列问题:
(1)As和N同族,基态砷原子的价层电子排布式为___________ 。
(2) 的空间结构名称为
的空间结构名称为___________ 。
(3)氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,反应原理为:5 +2
+2 +H+=2Mn2++3H2O+5
+H+=2Mn2++3H2O+5 。请回答下列问题:
。请回答下列问题:
①用KMnO4进行滴定时,判断滴定终点的现象是___________ 。
②下列操作会导致测定结果偏低的是___________ (填序号)。
A.酸式滴定管水洗后未用待测液润洗
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定管尖嘴部分有气泡,滴定后消失
D.观察读数时,滴定前仰视,滴定后俯视
③根据下表中测定的实验数据,计算NaHSO3溶液的物质的量浓度__________ (写出计算过程,结果保留4位有效数字)。
(1)As和N同族,基态砷原子的价层电子排布式为
(2)
 的空间结构名称为
的空间结构名称为(3)氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,反应原理为:5
 +2
+2 +H+=2Mn2++3H2O+5
+H+=2Mn2++3H2O+5 。请回答下列问题:
。请回答下列问题:①用KMnO4进行滴定时,判断滴定终点的现象是
②下列操作会导致测定结果偏低的是
A.酸式滴定管水洗后未用待测液润洗
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定管尖嘴部分有气泡,滴定后消失
D.观察读数时,滴定前仰视,滴定后俯视
③根据下表中测定的实验数据,计算NaHSO3溶液的物质的量浓度
| 实验编号 | 待测NaHSO3溶液的体积/mL | KMnO4溶液的体积/mL |
| 1 | 20.00 | 15.98 |
| 2 | 20.00 | 17.00 |
| 3 | 20.00 | 16.02 |
您最近一年使用:0次
名校
解题方法
6 . 已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
(1)NH4HCO3溶液显___________ 性。
(2)NaHSO3溶液显___________ 性,原因是___________ (通过计算说明)。
(3)等浓度的CH3COOH和CH3COONa混合溶液呈___________ 性,原因是___________ (通过计算说明)。
(4)水解常数Kh如何计算___________ 。
| 弱电解质 | H2CO3 | H2SO3 | NH3·H2O | CH3COOH |
| 电离常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-2 Ka2=6.3×10-8 | Kb=1.77×10-5 | Ka=1.77×10-5 |
(2)NaHSO3溶液显
(3)等浓度的CH3COOH和CH3COONa混合溶液呈
(4)水解常数Kh如何计算
您最近一年使用:0次
名校
解题方法
7 . 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为离子交换膜。请按要求回答相关问题:
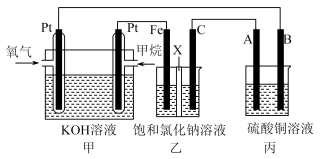
(1)甲烷燃料电池负极反应式是___________ 。
(2)Fe电极的电极反应式为___________ 。
(3)X选择___________ 离子交换膜(填“阴”,“阳”)。
(4)丙模拟粗铜的精炼,那么粗铜放在___________ (填“A”,“B”)极,反应结束后硫酸铜溶液的浓度___________ (填“变大”,“变小”,“不变”)。
(5)若在标准状况下,有1.12 L氧气参加反应,则乙装置中铁极上生成的气体体积为___________ L。
(6)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
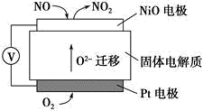
①Pt电极上发生的是___________ 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:___________ 。

(1)甲烷燃料电池负极反应式是
(2)Fe电极的电极反应式为
(3)X选择
(4)丙模拟粗铜的精炼,那么粗铜放在
(5)若在标准状况下,有1.12 L氧气参加反应,则乙装置中铁极上生成的气体体积为
(6)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次
名校
解题方法
8 . 汽车发动机代用燃料包括乙醇、氢气和甲烷等。回答下列问题:
(1)在25℃、 下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量
下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量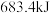 ,则乙醇燃烧热的热化学方程式为
,则乙醇燃烧热的热化学方程式为___________ 。
(2)根据图甲中的能量关系,可求得 键的键能为
键的键能为___________  。
。

(3)甲烷完全燃烧反应的能量关系如图乙所示。

①

___________ (用含 和
和 的关系式表示)。
的关系式表示)。
②为提高燃料利用率,加入甲烷燃烧的催化剂,则
___________ (填“变大”、“变小”或“不变”,下同),该反应的
___________ 。
(4)已知氢气的燃烧热为 ,甲烷的燃烧热为
,甲烷的燃烧热为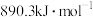 ,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点:
,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点:___________ 。
(5)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:___________ 。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是___________ ,元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(1)在25℃、
 下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量
下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量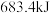 ,则乙醇燃烧热的热化学方程式为
,则乙醇燃烧热的热化学方程式为(2)根据图甲中的能量关系,可求得
 键的键能为
键的键能为 。
。
(3)甲烷完全燃烧反应的能量关系如图乙所示。

①


 和
和 的关系式表示)。
的关系式表示)。②为提高燃料利用率,加入甲烷燃烧的催化剂,则


(4)已知氢气的燃烧热为
 ,甲烷的燃烧热为
,甲烷的燃烧热为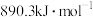 ,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点:
,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点:(5)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是
您最近一年使用:0次
名校
解题方法
9 . 金属及其化合物应用广泛,回答下列问题。
(1)运载火箭和载人飞船上使用的铝材属于_______ (填“纯铝”或“铝合金”),生产可用NaOH溶液除去铝材表面的天然氧化膜,反应的离子方程式是_______ 。
(2)服用维生素C可将人体中的Fe3+转化成Fe2+,这说明维生素C具有_______ (填“还原”或“氧化")性。
(3)为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,用离子方程式表示这一处理过程的原理:_______ 、_______ ;处理过程中需定期添加的原料是_______ (填名称)。
(4)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应,写出反应的离子方程式_______ 。
(5)铁与水蒸气的反应的化学方程式是_______ 。当有16.8g铁粉参加反应时,生成的气体在标准状况下的体积是_______ 。
(6)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是_______ ,反应化学方程式为_______ 。
(1)运载火箭和载人飞船上使用的铝材属于
(2)服用维生素C可将人体中的Fe3+转化成Fe2+,这说明维生素C具有
(3)为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,用离子方程式表示这一处理过程的原理:
(4)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应,写出反应的离子方程式
(5)铁与水蒸气的反应的化学方程式是
(6)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是
您最近一年使用:0次
10 . 氧化还原反应在生产和生活中使用非常广泛。回答下列问题:
(1)氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于区域3的是__________(填字母)。

(2) 外观和食盐相似,又有咸味,容易使人误食中毒。已知
外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: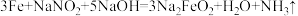 。
。
①上述反应中氧化产物是__________ (填化学式),还原剂和氧化剂的物质的量之比是__________ 。
②若反应中有 (标准状况下)气体生成,则反应中转移电子的物质的量为
(标准状况下)气体生成,则反应中转移电子的物质的量为__________ 。
③某厂废液中,含有2%~5%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是__________ (填字母)。
A. B.
B. C.
C. D.浓硫酸
D.浓硫酸
(3)过氧化氢俗名双氧水,在生产、生活中有多种用途。涉及的化学反应如下:
A.
B.
C.
D.
上述反应中, 仅体现氧化性的是
仅体现氧化性的是__________ (填字母), 、
、 、
、 的氧化性由强到弱的顺序是
的氧化性由强到弱的顺序是______________________________ 。
(1)氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于区域3的是__________(填字母)。

A. | B.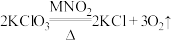 |
C. | D. |
(2)
 外观和食盐相似,又有咸味,容易使人误食中毒。已知
外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: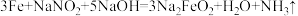 。
。①上述反应中氧化产物是
②若反应中有
 (标准状况下)气体生成,则反应中转移电子的物质的量为
(标准状况下)气体生成,则反应中转移电子的物质的量为③某厂废液中,含有2%~5%的
 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是A.
 B.
B. C.
C. D.浓硫酸
D.浓硫酸(3)过氧化氢俗名双氧水,在生产、生活中有多种用途。涉及的化学反应如下:
A.

B.

C.

D.

上述反应中,
 仅体现氧化性的是
仅体现氧化性的是 、
、 、
、 的氧化性由强到弱的顺序是
的氧化性由强到弱的顺序是
您最近一年使用:0次



