解题方法
1 . 资源化利用二氧化硫,一方面能保护环境,另一方面能提高经济效益,具有深远意义。
(1)下列生产、生活活动中,不易产生 的是___________。
的是___________。
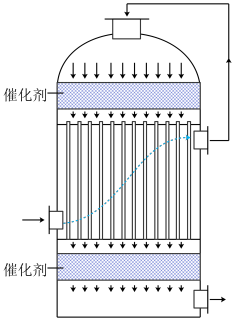
(2)工业中可用含 的冶炼烟气为原料生产硫酸,在如图装置中完成“
的冶炼烟气为原料生产硫酸,在如图装置中完成“ 转化”工序。使用该装置实现了___________。
转化”工序。使用该装置实现了___________。
(3)研究 的性质有利于探索其资源化利用。下列实验方案设计正确的是
的性质有利于探索其资源化利用。下列实验方案设计正确的是___________ 。
钠碱法的启动吸收剂为 溶液,捕捉
溶液,捕捉 后生成
后生成 和
和 的混合液。
的混合液。
(4)常温下进行“钠碱法”的模拟实验。用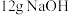 固体配成一定浓度的溶液,这些
固体配成一定浓度的溶液,这些 理论上最多可吸收
理论上最多可吸收 的体积约为
的体积约为___________ L(折算成标准状况)。若实验时只吸收了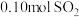 ,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为
,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为___________ 。
(5)当钠碱法的吸收液 达到4~6时,混合液中含较多量
达到4~6时,混合液中含较多量 。加热该溶液可回收得到较高纯度的
。加热该溶液可回收得到较高纯度的 ,剩余溶液可循环使用,进一步吸收
,剩余溶液可循环使用,进一步吸收 ,剩余溶液的主要溶质是
,剩余溶液的主要溶质是________ (填写化学式)。
(6)将 通入
通入 溶液时,得到一组
溶液时,得到一组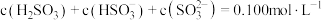 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。
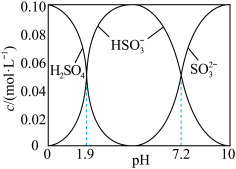
若溶液的 ,溶液中
,溶液中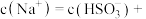
___________ ,此时溶液中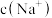
___________  。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)
(7)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数( )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数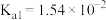 ,
,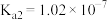 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。___________
(8)“钙碱法”的工作原理与“钠碱法”相似,一般选择消石灰的悬浊液为 吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价_____ 。
(1)下列生产、生活活动中,不易产生
 的是___________。
的是___________。| A.燃放鞭炮 | B.火力发电 | C.火山爆发 | D.海水晒盐 |
(2)工业中可用含
 的冶炼烟气为原料生产硫酸,在如图装置中完成“
的冶炼烟气为原料生产硫酸,在如图装置中完成“ 转化”工序。使用该装置实现了___________。
转化”工序。使用该装置实现了___________。
| A.充分利用热能 | B.防止形成酸雾 | C.加速转化 | D.获取纯净 |
(3)研究
 的性质有利于探索其资源化利用。下列实验方案设计正确的是
的性质有利于探索其资源化利用。下列实验方案设计正确的是 |  |  |  |
A.制取 | B.收集 | C.验证 水溶液的酸性 水溶液的酸性 | D.验证 的还原性 的还原性 |
钠碱法的启动吸收剂为
 溶液,捕捉
溶液,捕捉 后生成
后生成 和
和 的混合液。
的混合液。(4)常温下进行“钠碱法”的模拟实验。用
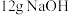 固体配成一定浓度的溶液,这些
固体配成一定浓度的溶液,这些 理论上最多可吸收
理论上最多可吸收 的体积约为
的体积约为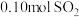 ,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为
,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为(5)当钠碱法的吸收液
 达到4~6时,混合液中含较多量
达到4~6时,混合液中含较多量 。加热该溶液可回收得到较高纯度的
。加热该溶液可回收得到较高纯度的 ,剩余溶液可循环使用,进一步吸收
,剩余溶液可循环使用,进一步吸收 ,剩余溶液的主要溶质是
,剩余溶液的主要溶质是(6)将
 通入
通入 溶液时,得到一组
溶液时,得到一组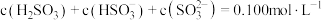 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。
若溶液的
 ,溶液中
,溶液中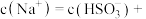
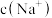
 。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)(7)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数(
 )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数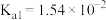 ,
,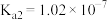 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。(8)“钙碱法”的工作原理与“钠碱法”相似,一般选择消石灰的悬浊液为
 吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
您最近一年使用:0次
解题方法
2 . 杭州亚运会主火炬塔燃料使用的甲醇被誉为绿色燃料。在以往的运动会中,丙烷、煤油也曾作为燃料使用。上述燃料的热值和 排放量如下表所示:
排放量如下表所示:
(1)根据上表数据,计算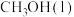 的燃烧热为___________
的燃烧热为___________ 。
。
(2)根据上表,从 排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因
排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因___________ 。
以 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一、其反应原理为:
资源化利用的方式之一、其反应原理为:
(3)下图中,曲线___________ 能表示该反应的平衡常数K与温度T的关系。
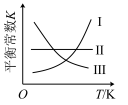
A.I B.II C.III
(4)某温度下,向容积为2.0L的恒容密闭容器中充入 和
和 模拟上述反应。反应达到平衡状态时,测得
模拟上述反应。反应达到平衡状态时,测得 。该温度下,平衡常数
。该温度下,平衡常数 ___________。
___________。
在不同温度下,向等容积的反应器中,分别通入等量、相同比例的 和
和 的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO:
的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO: 。
。

(5)图中一定不处于化学平衡状态的点是___________。
(6)已知催化剂对副反应没有影响。图中当温度高于500K,甲醇产率逐渐下降,原因可能有___________ 、___________ 。
光催化可以加快合成甲醇的反应速率,下图是该反应的部分历程,其中吸附在催化剂表面的物质用*表示。

(7)上图虚线框中的基元反应,主要决定总反应速率快慢的是___________。
上海某研究团队研制出了一种具有反应和分离“双功能分子师催化膜”反应器,使用该反应器制甲醇时,能大幅度提高二氧化碳转化率,其原理如下图所示:
CO2+3H2 CH3OH+H2O
CH3OH+H2O
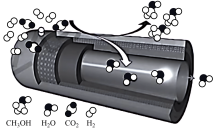
在不同反应器中, 平衡转化率和甲醇选择性
平衡转化率和甲醇选择性 的相关实验数据如下表所示:
的相关实验数据如下表所示:
(8)从绿色化学的角度,分析该双功能分子筛催化膜反应器的优点有:
① 平衡转化率明显升高;
平衡转化率明显升高;
②___________ ;
③___________ 。
 排放量如下表所示:
排放量如下表所示:| 燃料 | 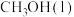 |  | 煤油 |
热值 | 22.7 | 50.4 | 29.0 |
 排放量 排放量 | 16.5 | 16.2 | 22.9 |
(1)根据上表数据,计算
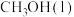 的燃烧热为___________
的燃烧热为___________ 。
。| A.22.7 | B. | C. | D. |
(2)根据上表,从
 排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因
排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因以
 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一、其反应原理为:
资源化利用的方式之一、其反应原理为:
(3)下图中,曲线

A.I B.II C.III
(4)某温度下,向容积为2.0L的恒容密闭容器中充入
 和
和 模拟上述反应。反应达到平衡状态时,测得
模拟上述反应。反应达到平衡状态时,测得 。该温度下,平衡常数
。该温度下,平衡常数 ___________。
___________。| A.3.00 | B.0.33 | C.0.15 | D.0.59 |
在不同温度下,向等容积的反应器中,分别通入等量、相同比例的
 和
和 的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO:
的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO: 。
。
(5)图中一定不处于化学平衡状态的点是___________。
| A.点A | B.点B | C.点C | D.点D |
(6)已知催化剂对副反应没有影响。图中当温度高于500K,甲醇产率逐渐下降,原因可能有
光催化可以加快合成甲醇的反应速率,下图是该反应的部分历程,其中吸附在催化剂表面的物质用*表示。

(7)上图虚线框中的基元反应,主要决定总反应速率快慢的是___________。
A. | B. |
C. | D. |
上海某研究团队研制出了一种具有反应和分离“双功能分子师催化膜”反应器,使用该反应器制甲醇时,能大幅度提高二氧化碳转化率,其原理如下图所示:
CO2+3H2
 CH3OH+H2O
CH3OH+H2O
在不同反应器中,
 平衡转化率和甲醇选择性
平衡转化率和甲醇选择性 的相关实验数据如下表所示:
的相关实验数据如下表所示:| 实验组 | 反应器 | 压强/MPa | 温度/K | 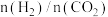 |  平衡转化率/% 平衡转化率/% | 甲醇选择性/% |
| ① | 普通催化反应器 | 3 | 533 | 3 | 21.9 | 67.3 |
| ② | 双功能分子筛催化膜反应器 | 36.1 | 100 |
(8)从绿色化学的角度,分析该双功能分子筛催化膜反应器的优点有:
①
 平衡转化率明显升高;
平衡转化率明显升高;②
③
您最近一年使用:0次
2024-01-13更新
|
377次组卷
|
3卷引用:上海市四区联考2023-2024学年高三上学期化学一模试卷
上海市四区联考2023-2024学年高三上学期化学一模试卷上海市嘉定区第二中学2023-2024学年高三上学期第一次质量调研 化学试卷 (已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
解题方法
3 . 含铁化合物在生产、生活中有广泛的应用。下图是一种太阳能电池工作原理的示意图,其中电解质溶液为 和
和 的混合溶液。
的混合溶液。 中,中心离子为
中,中心离子为___________ 。
(2)电池工作时,下列描述正确的是___________。
(3)正极上发生的电极反应为___________ 。
氮化铁晶体可应用于磁记录材料领域,其晶胞结构如下图所示:
(5)该氮化铁晶体的化学式为___________ 。
A.FeN B.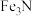 C.
C. D.
D.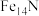
结合图中数据,计算该晶胞的密度
___________  。(设
。(设 为阿伏加德罗常数,用含r和
为阿伏加德罗常数,用含r和 的代数式表示,
的代数式表示, )
)
向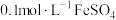 溶液中持续通入
溶液中持续通入 至饱和,有微量黑色的FeS沉淀生成,该溶液中
至饱和,有微量黑色的FeS沉淀生成,该溶液中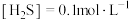 。(忽略
。(忽略 浓度的变化和溶液体积的变化)
浓度的变化和溶液体积的变化)
已知常温下,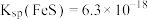 ,
, 的电离常数分别为:
的电离常数分别为: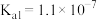 、
、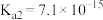 。
。
(6)写出生成黑色沉淀的离子方程式___________ 。溶液中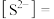
___________  ;溶液中
;溶液中
___________  。
。
 和
和 的混合溶液。
的混合溶液。
 中,中心离子为
中,中心离子为(2)电池工作时,下列描述正确的是___________。
| A.电极a为正极 | B. 向电极a移动 向电极a移动 |
| C.电子由电极a经导线流向电极b | D.电极b上发生氧化反应 |
(3)正极上发生的电极反应为
氮化铁晶体可应用于磁记录材料领域,其晶胞结构如下图所示:

| A.2 | B.4 | C.6 | D.8 |
(5)该氮化铁晶体的化学式为
A.FeN B.
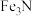 C.
C. D.
D.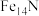
结合图中数据,计算该晶胞的密度

 。(设
。(设 为阿伏加德罗常数,用含r和
为阿伏加德罗常数,用含r和 的代数式表示,
的代数式表示, )
)向
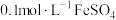 溶液中持续通入
溶液中持续通入 至饱和,有微量黑色的FeS沉淀生成,该溶液中
至饱和,有微量黑色的FeS沉淀生成,该溶液中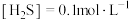 。(忽略
。(忽略 浓度的变化和溶液体积的变化)
浓度的变化和溶液体积的变化)已知常温下,
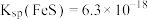 ,
, 的电离常数分别为:
的电离常数分别为: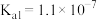 、
、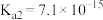 。
。(6)写出生成黑色沉淀的离子方程式
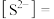
 ;溶液中
;溶液中
 。
。
您最近一年使用:0次
2024-01-13更新
|
258次组卷
|
2卷引用:上海市四区联考2023-2024学年高三上学期化学一模试卷
4 . 肾上腺素是一种脂溶性激素,常用于临床抢救。肾上腺素注射液说明书的部分内容如下:
(1)对肾上腺素分子结构分析正确的是___________。
(2)肾上腺素注射液中盐酸的作用是___________ ;肾上腺素注射液接触空气变色的原因是___________ 。
人工合成肾上腺素(D)的某种路线如下所示:
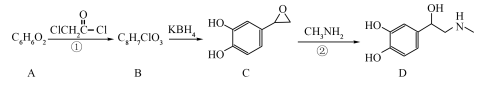
(3)A中含有的官能团为___________。
(4)步骤①的反应类型为___________。
(5)步骤②会产生一种副产物。在质谱图中,该副产物分子离子峰的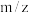 值与肾上腺素的相同,其结构简式为
值与肾上腺素的相同,其结构简式为___________ (不考虑立体异构)。
(6)写出一种符合下列条件的C的同分异构体的结构简式___________ 。
i)能发生银镜反应,也能与 溶液发生显色反应
溶液发生显色反应
ii)核磁共振氢谱图中有4组峰,且峰面积之比为3:2:2:1
(7)上述方法最终得到的D是一对对映体的混合物。
①在下图中用“*”标出D中的不对称碳原子___________ 。

②生产肾上腺素注射液时,须对D的一对对映体进行分离,才能用于生产肾上腺素注射液,原因可能是___________ 。
(8)已知: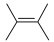
 。结合题示信息,设计以环己烷(
。结合题示信息,设计以环己烷(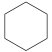 )和
)和 为主要原料合成
为主要原料合成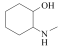 的路线
的路线___________ (无机试剂任选)。
(合成路线可表示为: )
)
| 肾上腺素注射液说明书 【成分】本品为加盐酸的肾上腺素灭菌水溶液。 【性状】本品为几乎无色的澄清液体;与空气接触,会近渐变为淡红色,最后变成棕色。 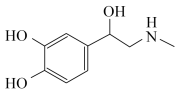 肾上腺素分子的结构 |
(1)对肾上腺素分子结构分析正确的是___________。
A.碳原子采取 、 、 杂化 杂化 | B.所有原子共平面 |
| C.N原子有3对价层电子对 | D.分子中含有肽键 |
(2)肾上腺素注射液中盐酸的作用是
人工合成肾上腺素(D)的某种路线如下所示:

(3)A中含有的官能团为___________。
| A.醛基 | B.醇羟基 | C.酚羟基 | D.羧基 |
(4)步骤①的反应类型为___________。
| A.取代反应 | B.消去反应 | C.氧化反应 | D.还原反应 |
(5)步骤②会产生一种副产物。在质谱图中,该副产物分子离子峰的
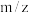 值与肾上腺素的相同,其结构简式为
值与肾上腺素的相同,其结构简式为(6)写出一种符合下列条件的C的同分异构体的结构简式
i)能发生银镜反应,也能与
 溶液发生显色反应
溶液发生显色反应ii)核磁共振氢谱图中有4组峰,且峰面积之比为3:2:2:1
(7)上述方法最终得到的D是一对对映体的混合物。
①在下图中用“*”标出D中的不对称碳原子

②生产肾上腺素注射液时,须对D的一对对映体进行分离,才能用于生产肾上腺素注射液,原因可能是
(8)已知:

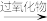
 。结合题示信息,设计以环己烷(
。结合题示信息,设计以环己烷( )和
)和 为主要原料合成
为主要原料合成 的路线
的路线(合成路线可表示为:
 )
)
您最近一年使用:0次
2024-01-13更新
|
337次组卷
|
3卷引用:上海市四区联考2023-2024学年高三上学期化学一模试卷
上海市四区联考2023-2024学年高三上学期化学一模试卷上海市嘉定区第二中学2023-2024学年高三上学期第一次质量调研 化学试卷 (已下线)专题11 有机推断综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
5 . 盐酸羟胺(化学式为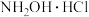 )是一种重要的化工产品,可作还原剂、显像剂等,其熔点为152℃,易溶于水。
)是一种重要的化工产品,可作还原剂、显像剂等,其熔点为152℃,易溶于水。
实验室以环己酮肟、盐酸为原料制备盐酸羟胺的反应原理如下:
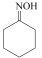 (环己酮肟)
(环己酮肟)
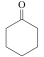 (环己酮)
(环己酮)
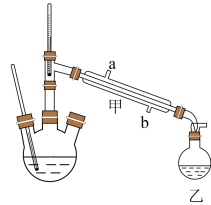
制备盐酸羟胺的实验装置如图所示(加热、搅拌和夹持装置已省略)。
盐酸羟胺在不同温度下的溶解度如下表:
(1)仪器甲中进水口应为___________ 。
A.a处 B.b处 C.a处或b处均可
(2)反应过程中,将环已酮不断蒸出的主要原因是___________ 。
(3)容器乙中收集到环己酮的水溶液,环已酮和水之间存在的相互作用有___________。
(4)反应后,从三口烧瓶的溶液中获取盐酸羟胺的实验方法为___________。
称取0.500g由上述方法制得的盐酸羟胺产品,加水配制成100mL溶液。量取20.00mL于锥形瓶中,加入适量稀硫酸酸化,再加入过量硫酸铁铵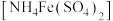 溶液充分反应,接着加入足量磷酸溶液(与
溶液充分反应,接着加入足量磷酸溶液(与 形成无色配合物),最后用
形成无色配合物),最后用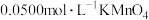 的酸性溶液滴定,达到滴定终点时消耗
的酸性溶液滴定,达到滴定终点时消耗 的酸性溶液的体积为11.35mL。
的酸性溶液的体积为11.35mL。
反应原理为:①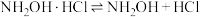
②
③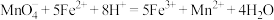
(5)将反应②补充完整,并标出电子转移的方向和数目___________ 。
(6)配制上述盐酸羟胺溶液所需要的定量仪器有___________ 。
A.电子天平 B.100mL容量瓶 C.滴定管 D.量筒
判断滴定终点的现象为___________ 。
(7)通过计算判断该产品的纯度级别___________ 。(写出计算过程)
已知:
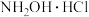 )是一种重要的化工产品,可作还原剂、显像剂等,其熔点为152℃,易溶于水。
)是一种重要的化工产品,可作还原剂、显像剂等,其熔点为152℃,易溶于水。实验室以环己酮肟、盐酸为原料制备盐酸羟胺的反应原理如下:
 (环己酮肟)
(环己酮肟)
 (环己酮)
(环己酮)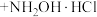
制备盐酸羟胺的实验装置如图所示(加热、搅拌和夹持装置已省略)。

盐酸羟胺在不同温度下的溶解度如下表:
| 温度(℃) | 溶解度(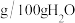 ) ) |
| 20 | 46.7 |
| 40 | 54.9 |
| 60 | 63.2 |
| 80 | 71.1 |
A.a处 B.b处 C.a处或b处均可
(2)反应过程中,将环已酮不断蒸出的主要原因是
(3)容器乙中收集到环己酮的水溶液,环已酮和水之间存在的相互作用有___________。
| A.共价键 | B.离子键 | C.氢键 | D.范德华力 |
| A.冷却结晶 | B.渗析 | C.蒸馏 | D.萃取、分液 |
称取0.500g由上述方法制得的盐酸羟胺产品,加水配制成100mL溶液。量取20.00mL于锥形瓶中,加入适量稀硫酸酸化,再加入过量硫酸铁铵
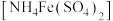 溶液充分反应,接着加入足量磷酸溶液(与
溶液充分反应,接着加入足量磷酸溶液(与 形成无色配合物),最后用
形成无色配合物),最后用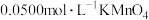 的酸性溶液滴定,达到滴定终点时消耗
的酸性溶液滴定,达到滴定终点时消耗 的酸性溶液的体积为11.35mL。
的酸性溶液的体积为11.35mL。反应原理为:①
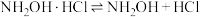
②

③
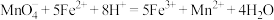
(5)将反应②补充完整,并标出电子转移的方向和数目
(6)配制上述盐酸羟胺溶液所需要的定量仪器有
A.电子天平 B.100mL容量瓶 C.滴定管 D.量筒
判断滴定终点的现象为
(7)通过计算判断该产品的纯度级别
| 纯度级别 | 优级纯 | 分析纯 | 化学纯 |
质量分数 | 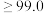 |  |  |

您最近一年使用:0次
2024-01-13更新
|
364次组卷
|
3卷引用:上海市四区联考2023-2024学年高三上学期化学一模试卷
上海市四区联考2023-2024学年高三上学期化学一模试卷上海市嘉定区第二中学2023-2024学年高三上学期第一次质量调研 化学试卷 (已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
6 . 工业排放的某些烟气中含有二氧化硫等大气污染物,对其进行脱硫治理不仅可以防止有害物质排放,还可以生产其他有用的产品。
(1) 分子的空间结构和分子的极性分别为___________。
分子的空间结构和分子的极性分别为___________。
(2)第一电离能: ,结合核外电子排布相关知识,说明其原因
,结合核外电子排布相关知识,说明其原因___________ 。
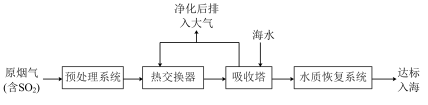
沿海地区的某煤电厂开发出海水脱硫的新工艺,流程如下图所示: ,
, 的电离常数如下表所示:
的电离常数如下表所示:
(3)在吸收塔内,烟气应从吸收塔的___________ 通入,与塔顶喷淋的海水充分接触。
A.上部 B.中部 C.下部
(4)吸收塔内温度不宜过高,原因可能是___________ 。(列举1条)吸收塔内 和海水中
和海水中 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)若煤电厂排放烟气量为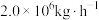 ,其中含
,其中含 为0.15%,该烟气经海水脱硫处理后
为0.15%,该烟气经海水脱硫处理后 为
为 ,则脱硫率
,则脱硫率
___________ 。( )
)
(6)离子液体(ILs)也可以用来处理工业烟气。ILs的负离子吸收 后生成
后生成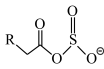 。欲确定
。欲确定 中虚线框内基团的结构,可采用的分析方法有___________。
中虚线框内基团的结构,可采用的分析方法有___________。
工业上还可用 溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
(7)为使 再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
(8)使用 溶液脱硫时,溶液的pH通常需控制在
溶液脱硫时,溶液的pH通常需控制在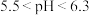 。结合
。结合 的性质和下图,分析pH不宜过小和过大的原因
的性质和下图,分析pH不宜过小和过大的原因___________ 。
(1)
 分子的空间结构和分子的极性分别为___________。
分子的空间结构和分子的极性分别为___________。| A.直线形,非极性 | B.直线形,极性 | C.角形,非极性 | D.角形,极性 |
(2)第一电离能:
 ,结合核外电子排布相关知识,说明其原因
,结合核外电子排布相关知识,说明其原因沿海地区的某煤电厂开发出海水脱硫的新工艺,流程如下图所示:
 ,
, 的电离常数如下表所示:
的电离常数如下表所示:| 弱酸 |  |  |
 | 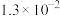 | 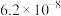 |
 | 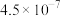 | 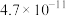 |
(3)在吸收塔内,烟气应从吸收塔的
A.上部 B.中部 C.下部
(4)吸收塔内温度不宜过高,原因可能是
 和海水中
和海水中 发生反应的离子方程式为
发生反应的离子方程式为(5)若煤电厂排放烟气量为
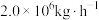 ,其中含
,其中含 为0.15%,该烟气经海水脱硫处理后
为0.15%,该烟气经海水脱硫处理后 为
为 ,则脱硫率
,则脱硫率
 )
)(6)离子液体(ILs)也可以用来处理工业烟气。ILs的负离子吸收
 后生成
后生成 。欲确定
。欲确定 中虚线框内基团的结构,可采用的分析方法有___________。
中虚线框内基团的结构,可采用的分析方法有___________。| A.原子发射光谱 | B.红外光谱 | C.核磁共振氢谱 | D.晶体X射线衍射 |
工业上还可用
 溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。(7)为使
 再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。A. | B.CaO | C. | D.NaOH |
(8)使用
 溶液脱硫时,溶液的pH通常需控制在
溶液脱硫时,溶液的pH通常需控制在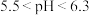 。结合
。结合 的性质和下图,分析pH不宜过小和过大的原因
的性质和下图,分析pH不宜过小和过大的原因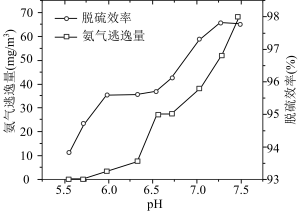
您最近一年使用:0次
2024-01-13更新
|
302次组卷
|
3卷引用:上海市四区联考2023-2024学年高三上学期化学一模试卷
名校
解题方法
7 . 氧化铁黄(化学式为 )是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾
)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾 为原料制备
为原料制备 。
。
(1)下列关于铁元素的认识正确的是___________。
(2)制备氧化铁黄的关键步骤是 溶液的氧化。为探究影响氧化
溶液的氧化。为探究影响氧化 溶液快慢的因素,现利用
溶液快慢的因素,现利用 、蒸馏水和稀
、蒸馏水和稀 配制四组溶液进行实验,实验结果如下表:
配制四组溶液进行实验,实验结果如下表:
①对比实验Ⅰ和Ⅱ可知,实验中影响氧化快慢的因素是___________ ;
②综合对比分析四组实验,简述影响氧化 溶液快慢的决定因素。
溶液快慢的决定因素。___________ 。
制备 的工艺流程包含如下环节
的工艺流程包含如下环节
(4)模拟氧化时,相关 变化记录如图。
变化记录如图。 时段,
时段, 逐渐减小的原因是反应生成了
逐渐减小的原因是反应生成了 ,配平下列化学方程式:
,配平下列化学方程式:___________ 。
________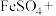 _______
_______ _______=______
_______=______ ______
______
 时段,经历的反应为:
时段,经历的反应为: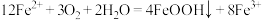 ,该过程
,该过程 继续平缓下降的原因可能是:
继续平缓下降的原因可能是:___________ 。(任写一条)
(5)判断流程中产品是否洗涤干净的方法是:___________ 。
氧化铁黄( )纯度可以通过产品的耗酸量确定,如下图所示。
)纯度可以通过产品的耗酸量确定,如下图所示。 (配合离子),
(配合离子),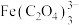 不与稀碱液反应。
不与稀碱液反应。
(6)①在溶液 中滴加
中滴加 标准溶液时,发生反应的离子方程式为
标准溶液时,发生反应的离子方程式为___________ ;
②若实验时加入了 的
的 ,消耗
,消耗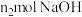 ,设氧化铁黄的式量为
,设氧化铁黄的式量为 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为___________ ;(用含 、
、 、
、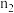 、
、 的代数式表示)
的代数式表示)
③测定时,若滴入 不足量,会使实验结果
不足量,会使实验结果___________ (选填“偏大”、“偏小”或“无影响”)。
 )是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾
)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾 为原料制备
为原料制备 。
。(1)下列关于铁元素的认识正确的是___________。
| A.能存在于人体的血红蛋白中 | B.是地壳中含量最多的金属元素 |
| C.单质是人类最早使用的金属 | D.铁的氧化物都具有致密的结构 |
(2)制备氧化铁黄的关键步骤是
 溶液的氧化。为探究影响氧化
溶液的氧化。为探究影响氧化 溶液快慢的因素,现利用
溶液快慢的因素,现利用 、蒸馏水和稀
、蒸馏水和稀 配制四组溶液进行实验,实验结果如下表:
配制四组溶液进行实验,实验结果如下表:| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
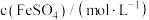 | 0.5 | 0.25 | 0.25 | 0.5 |
| 溶液pH | 2.9 | 2.9 | 3.5 | 3.3 |
| 初始颜色 | 浅绿色 | 浅绿色,较Ⅰ浅 | 浅绿色,同Ⅱ | 浅绿色,同Ⅰ |
 后颜色 后颜色 | 浅绿色 | 浅绿色 | 黄绿色 | 浅绿色 |
 后颜色 后颜色 | 黄绿色 | 浅绿色 | 黄色 | 黄绿色 |
 后颜色 后颜色 | 浅黄色 | 浅黄色,较I浅 | 黄色,较Ⅳ浅 | 黄色 |
②综合对比分析四组实验,简述影响氧化
 溶液快慢的决定因素。
溶液快慢的决定因素。制备
 的工艺流程包含如下环节
的工艺流程包含如下环节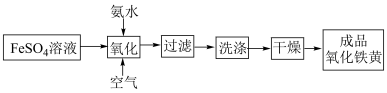
| A.烧杯 | B.漏斗 | C.玻璃棒 | D.蒸发皿 |
(4)模拟氧化时,相关
 变化记录如图。
变化记录如图。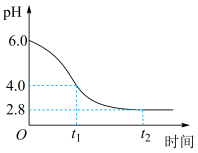
 时段,
时段, 逐渐减小的原因是反应生成了
逐渐减小的原因是反应生成了 ,配平下列化学方程式:
,配平下列化学方程式:________
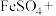 _______
_______ _______=______
_______=______ ______
______
 时段,经历的反应为:
时段,经历的反应为: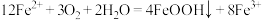 ,该过程
,该过程 继续平缓下降的原因可能是:
继续平缓下降的原因可能是:(5)判断流程中产品是否洗涤干净的方法是:
氧化铁黄(
 )纯度可以通过产品的耗酸量确定,如下图所示。
)纯度可以通过产品的耗酸量确定,如下图所示。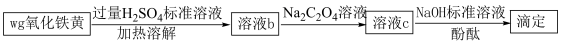
 (配合离子),
(配合离子),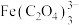 不与稀碱液反应。
不与稀碱液反应。(6)①在溶液
 中滴加
中滴加 标准溶液时,发生反应的离子方程式为
标准溶液时,发生反应的离子方程式为②若实验时加入了
 的
的 ,消耗
,消耗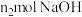 ,设氧化铁黄的式量为
,设氧化铁黄的式量为 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为 、
、 、
、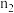 、
、 的代数式表示)
的代数式表示)③测定时,若滴入
 不足量,会使实验结果
不足量,会使实验结果
您最近一年使用:0次
2024-01-13更新
|
430次组卷
|
3卷引用:上海市浦东新区2023-2024学年高三上学期一模化学试卷
上海市浦东新区2023-2024学年高三上学期一模化学试卷上海市闵行区多校联考2023-2024学年高三下学期三模考试化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
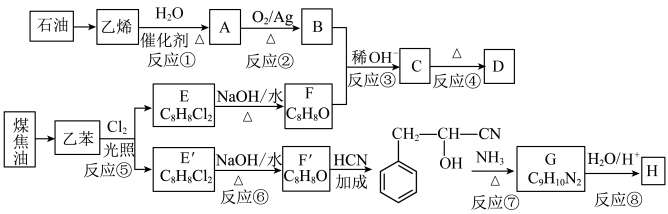
8 . 以石油和煤为原料可以合成各种用途广泛的有机产品。合成3-苯基-2-丁烯醛D(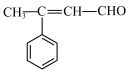 )和苯丙氨酸H(
)和苯丙氨酸H(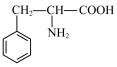 )的路线如下:
)的路线如下:
已知:①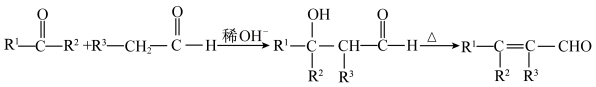 (
( 、
、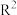 、
、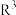 均可以是烃基或氢原子)
均可以是烃基或氢原子)
②同一个碳原子不能同时连两个羟基不稳定,会自动脱水: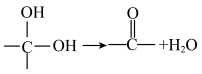
(1)煤加工获得煤焦油的方法是___________。
(2)反应①~④中,属于加成反应的是___________。
(3)B中官能团的名称为___________ 。
(4)写出反应⑥的化学反应方程式___________ 。
(5)检验D中的碳碳双键可使用的试剂是___________ 。
(6)D的同分异构体有多种,写出一种满足下列条件的结构简式。___________
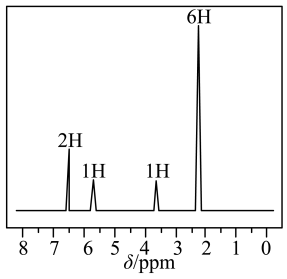
①会使氯化铁溶液发生颜色变化,②核磁共振氢谱图如下:
(7)下列有关H(苯丙氨酸)的描述正确的是___________。
(8)反应⑧需要控制pH的理由是___________ 。
(9)参照上述信息和流程,设计以 为原料合成
为原料合成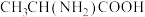 的合成路线
的合成路线___________ 。(合成路线常用的表示方式为:甲 乙……
乙…… 目标产物)
目标产物)
 )和苯丙氨酸H(
)和苯丙氨酸H( )的路线如下:
)的路线如下:
已知:①
 (
( 、
、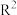 、
、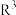 均可以是烃基或氢原子)
均可以是烃基或氢原子)②同一个碳原子不能同时连两个羟基不稳定,会自动脱水:

(1)煤加工获得煤焦油的方法是___________。
| A.分馏 | B.干馏 | C.裂化 | D.裂解 |
(2)反应①~④中,属于加成反应的是___________。
| A.反应① | B.反应② | C.反应③ | D.反应④ |
(3)B中官能团的名称为
(4)写出反应⑥的化学反应方程式
(5)检验D中的碳碳双键可使用的试剂是
(6)D的同分异构体有多种,写出一种满足下列条件的结构简式。
①会使氯化铁溶液发生颜色变化,②核磁共振氢谱图如下:

(7)下列有关H(苯丙氨酸)的描述正确的是___________。
| A.能溶于水 | B.与甘氨酸(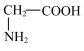 )互为同系物 )互为同系物 |
| C.不存在立体异构 | D.能自身反应形成高分子化合物 |
(8)反应⑧需要控制pH的理由是
(9)参照上述信息和流程,设计以
 为原料合成
为原料合成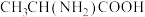 的合成路线
的合成路线 乙……
乙…… 目标产物)
目标产物)
您最近一年使用:0次
2024-01-13更新
|
468次组卷
|
3卷引用:上海市浦东新区2023-2024学年高三上学期一模化学试卷
9 . 与氨气相关的化学变化是氮循环和转化的重要一环,对生产、生活有重要的价值。
(1)下图转化途径中属于“固氮”的是___________。

(2)合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如下:(图中 表示物质吸附在催化剂表面时的状态)
表示物质吸附在催化剂表面时的状态)

①由图可知合成氨反应 的
的
___________  ,对总反应速率影响较大的是步骤
,对总反应速率影响较大的是步骤___________ 。(填写编号)
②若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是___________ 。
A.升高温度,使单位体积内活化分子百分数增加
B.增加反应物的浓度,使单位体积内活化分子百分数增加
C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加
D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加
(3)氨是极具前景的氢能载体和性能卓越的“零碳”燃料,利用 的燃烧反应(
的燃烧反应( )能设计成燃料电池,其工作原理如图所示。电极
)能设计成燃料电池,其工作原理如图所示。电极 为
为___________ (选填“正”或“负”)极;电极 的电极反应式为
的电极反应式为___________ ;当正负极共消耗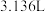 (标准状况)气体时,通过负载的电子数为
(标准状况)气体时,通过负载的电子数为___________ 个。

合成氨厂的可用于合成重要化工原料 ,主要反应为:
,主要反应为: ,向两个容积固定为
,向两个容积固定为 的密闭容器中分别充入比例相同,但总量不同的
的密闭容器中分别充入比例相同,但总量不同的 和气体,
和气体, 的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
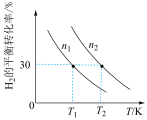
(4)①若 时,向容器中充入
时,向容器中充入 气体(
气体( 和
和 ),反应至
),反应至 时达到平衡,则
时达到平衡,则 内
内 的平均反应速率
的平均反应速率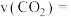
___________ 。
②由上图可判断该反应是___________ (选填“吸热”或“放热”)反应,在___________ (填“较高”或“较低”)温度下有利于该反应自发进行。
③判断图中 、
、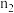 相对大小,并说明理由。
相对大小,并说明理由。___________ 。
(1)下图转化途径中属于“固氮”的是___________。

| A.④⑤⑥ | B.①③④ | C.①⑤⑦ | D.②⑧⑨ |
(2)合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如下:(图中
 表示物质吸附在催化剂表面时的状态)
表示物质吸附在催化剂表面时的状态)
①由图可知合成氨反应
 的
的
 ,对总反应速率影响较大的是步骤
,对总反应速率影响较大的是步骤②若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是
A.升高温度,使单位体积内活化分子百分数增加
B.增加反应物的浓度,使单位体积内活化分子百分数增加
C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加
D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加
(3)氨是极具前景的氢能载体和性能卓越的“零碳”燃料,利用
 的燃烧反应(
的燃烧反应( )能设计成燃料电池,其工作原理如图所示。电极
)能设计成燃料电池,其工作原理如图所示。电极 为
为 的电极反应式为
的电极反应式为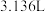 (标准状况)气体时,通过负载的电子数为
(标准状况)气体时,通过负载的电子数为
合成氨厂的可用于合成重要化工原料
 ,主要反应为:
,主要反应为: ,向两个容积固定为
,向两个容积固定为 的密闭容器中分别充入比例相同,但总量不同的
的密闭容器中分别充入比例相同,但总量不同的 和气体,
和气体, 的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
(4)①若
 时,向容器中充入
时,向容器中充入 气体(
气体( 和
和 ),反应至
),反应至 时达到平衡,则
时达到平衡,则 内
内 的平均反应速率
的平均反应速率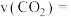
②由上图可判断该反应是
③判断图中
 、
、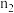 相对大小,并说明理由。
相对大小,并说明理由。
您最近一年使用:0次
解题方法
10 . 钛被誉为太空金属和亲生物金属,拥有卓越的金属特性。它在特定温度下能与多种物质发生反应,在生产和日常生活中都能找到它的踪影。
(1) 原子的价电子排布式为
原子的价电子排布式为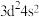 ,它在元素周期表中的位置是
,它在元素周期表中的位置是___________ 。
(2)钛合金材料可用于制造超音速飞机,下列钛合金的性质与该用途无关的是___________。
(3) 合金常用于牙科领域。在基态的
合金常用于牙科领域。在基态的 原子和
原子和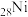 原子中,它们的核外电子具有不同的___________。
原子中,它们的核外电子具有不同的___________。
(4)钛能与卤素单质发生反应,生成用途多样的卤化钛。
①卤族元素( 、
、 、
、 、
、 )随着原子序数的递增,相关性质逐渐增强或变大的是
)随着原子序数的递增,相关性质逐渐增强或变大的是___________ 。
A.元素的电负性 B.简单离子的还原性
C.气态氢化物的热稳定性 D.最高价氧化物对应水化物的酸性
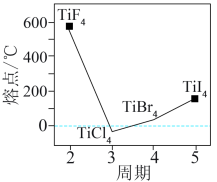
② 的不同四卤化物熔点如图所示,利用晶体知识解释它们熔点变化的原因
的不同四卤化物熔点如图所示,利用晶体知识解释它们熔点变化的原因___________ 。
③ 易与
易与 形成
形成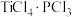 。下列关于
。下列关于 分子说法错误的是
分子说法错误的是___________ 。
A.键角为 B.是极性分子 C.含有
B.是极性分子 C.含有 键 D.中心原子采取
键 D.中心原子采取 杂化
杂化
(5)钛溶于盐酸制得的三氯化钛( ),可作为聚丙烯生产过程中的催化剂。
),可作为聚丙烯生产过程中的催化剂。 晶体有两种异构体:
晶体有两种异构体: (绿色)、
(绿色)、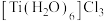 (紫色),两者配位数
(紫色),两者配位数___________ (选填“相同”或“不同”),绿色晶体中配体是___________ 。
(6)利用钛粉和碳粉反应可生成硬度接近金刚石的碳化钛,它在刀具制造领域有重要应用。碳化钛晶胞如图所示,其化学式为___________ 。设 为阿伏加德罗常数的值,若晶胞边长为
为阿伏加德罗常数的值,若晶胞边长为 ,则晶体的密度为
,则晶体的密度为___________  。(写出表达式)
。(写出表达式)

(1)
 原子的价电子排布式为
原子的价电子排布式为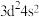 ,它在元素周期表中的位置是
,它在元素周期表中的位置是(2)钛合金材料可用于制造超音速飞机,下列钛合金的性质与该用途无关的是___________。
| A.密度小 | B.硬度大 | C.熔点高 | D.无磁性 |
(3)
 合金常用于牙科领域。在基态的
合金常用于牙科领域。在基态的 原子和
原子和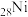 原子中,它们的核外电子具有不同的___________。
原子中,它们的核外电子具有不同的___________。| A.能层数 | B.能级数 | C.占据轨道数 | D.单电子数 |
(4)钛能与卤素单质发生反应,生成用途多样的卤化钛。

①卤族元素(
 、
、 、
、 、
、 )随着原子序数的递增,相关性质逐渐增强或变大的是
)随着原子序数的递增,相关性质逐渐增强或变大的是A.元素的电负性 B.简单离子的还原性
C.气态氢化物的热稳定性 D.最高价氧化物对应水化物的酸性
②
 的不同四卤化物熔点如图所示,利用晶体知识解释它们熔点变化的原因
的不同四卤化物熔点如图所示,利用晶体知识解释它们熔点变化的原因③
 易与
易与 形成
形成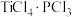 。下列关于
。下列关于 分子说法错误的是
分子说法错误的是A.键角为
 B.是极性分子 C.含有
B.是极性分子 C.含有 键 D.中心原子采取
键 D.中心原子采取 杂化
杂化(5)钛溶于盐酸制得的三氯化钛(
 ),可作为聚丙烯生产过程中的催化剂。
),可作为聚丙烯生产过程中的催化剂。 晶体有两种异构体:
晶体有两种异构体: (绿色)、
(绿色)、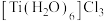 (紫色),两者配位数
(紫色),两者配位数(6)利用钛粉和碳粉反应可生成硬度接近金刚石的碳化钛,它在刀具制造领域有重要应用。碳化钛晶胞如图所示,其化学式为
 为阿伏加德罗常数的值,若晶胞边长为
为阿伏加德罗常数的值,若晶胞边长为 ,则晶体的密度为
,则晶体的密度为 。(写出表达式)
。(写出表达式)
您最近一年使用:0次
2024-01-13更新
|
314次组卷
|
2卷引用:上海市浦东新区2023-2024学年高三上学期一模化学试卷



