名校
1 . 由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
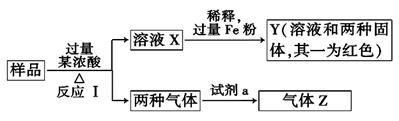
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)___________ 。
(2)Z为一种或两种气体
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是_________ 。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是_____________ 。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)_____________ 。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I- 时,共转移3 mol电子,该反应的离子方程式是_______________ 。

(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)
(2)Z为一种或两种气体
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I- 时,共转移3 mol电子,该反应的离子方程式是
您最近一年使用:0次
2016-12-09更新
|
294次组卷
|
5卷引用:2016届河北省冀州市中学高三复习班上第一次月考化学试卷A
名校
2 . 查阅文献知,3(NH4)2SO4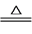 4NH3↑+3SO2↑+N2+6H2O。某课题组成员拟选择下列装置探究硫酸铵的性质(各装置中药品足量)。
4NH3↑+3SO2↑+N2+6H2O。某课题组成员拟选择下列装置探究硫酸铵的性质(各装置中药品足量)。
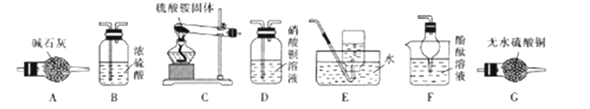
回答下列问题:
(1)A装置盛装碱石灰的仪器是_________ 。C装置中大试管向下倾斜的原因是__________________ 。
(2)甲组同学设计方案:C→G→B→D→E。
①能证明有水生成的实验现象是_______________ ;B装置的作用是______________ 。
②实验中,观察到D装置中产生白色沉淀。实验完毕后,过滤D装置中混合物得白色沉淀。为了检验白色沉淀是BaSO4还是BaSO3,设计简单实验方案:________________ 。
③D装置中发生反应与硝酸钡的量有关,若硝酸钡足量,则D中反应的离子方程式为_______________ 。
④该实验方案能证明硫酸铵的分解产物是______________ (填化学式)。
(3)乙组同学选择上述装置证明产物是否有NH3。
①气体从左至右,装置连接顺序为C、__________ 。
②能证明有氨气生成的实验现象是________________ 。
(4)丙组同学设计实验测定硫酸铵样品的纯度(杂质不参加反应):取15.0g样品溶于蒸馏水,加入足量氯化钡溶液和稀盐酸,过滤、洗涤、干燥、称重,BaSO4质量为23.3g,该样品中硫酸铵的质量分数为________ (结果保留两位小数)。
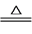 4NH3↑+3SO2↑+N2+6H2O。某课题组成员拟选择下列装置探究硫酸铵的性质(各装置中药品足量)。
4NH3↑+3SO2↑+N2+6H2O。某课题组成员拟选择下列装置探究硫酸铵的性质(各装置中药品足量)。
回答下列问题:
(1)A装置盛装碱石灰的仪器是
(2)甲组同学设计方案:C→G→B→D→E。
①能证明有水生成的实验现象是
②实验中,观察到D装置中产生白色沉淀。实验完毕后,过滤D装置中混合物得白色沉淀。为了检验白色沉淀是BaSO4还是BaSO3,设计简单实验方案:
③D装置中发生反应与硝酸钡的量有关,若硝酸钡足量,则D中反应的离子方程式为
④该实验方案能证明硫酸铵的分解产物是
(3)乙组同学选择上述装置证明产物是否有NH3。
①气体从左至右,装置连接顺序为C、
②能证明有氨气生成的实验现象是
(4)丙组同学设计实验测定硫酸铵样品的纯度(杂质不参加反应):取15.0g样品溶于蒸馏水,加入足量氯化钡溶液和稀盐酸,过滤、洗涤、干燥、称重,BaSO4质量为23.3g,该样品中硫酸铵的质量分数为
您最近一年使用:0次
11-12高二上·河北衡水·期末
3 . 某有机物样品4.6g完全燃烧,将燃烧后的产物通入足量石灰水中完全吸收,经过滤得到沉淀20克,滤液质量比原石灰水减少5.8克,该有机样品可能是
| A.C2H6O2 | B.CH4和C2H6的混合物 |
| C.CH4O和C3H8O的混合物 | D.C2H6O和C3H8O3的混合物 |
您最近一年使用:0次
4 . 固体样品X由Cu、SiO2、KNO3、NH4Cl中的一种或几种混合而成。某同学取该样品进行如下操作(部分产物已略去)

试回答:
(1)仅由步骤I中的实验现象,可得X中一定含有_________ 。
(2)步骤Ⅱ中固体减少的化学反应方程式为______________________ 。
(3)为进一步确定上述混合物X的组成,该同学另取 20.0g固体X加蒸馏水溶解、测得滤液的pH<7,他判断一定有NH4Cl用离子方程式表示其原因_______________ 。
(4)将(3)中加蒸馏水溶解后的混合后体系再经过过滤_______ 、________ (填操作名称)、称量,得到剩余固体的质量为9.80g,则20.0gX中NH4Cl的质量为______ 。

试回答:
(1)仅由步骤I中的实验现象,可得X中一定含有
(2)步骤Ⅱ中固体减少的化学反应方程式为
(3)为进一步确定上述混合物X的组成,该同学另取 20.0g固体X加蒸馏水溶解、测得滤液的pH<7,他判断一定有NH4Cl用离子方程式表示其原因
(4)将(3)中加蒸馏水溶解后的混合后体系再经过过滤
您最近一年使用:0次
5 . 某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·nH2O)分解的实验探究。经小组讨论,他们设计了如下装置进行实验。烧瓶B中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制N2),干燥管C1、C4中装有碱石灰,试管E1、E3、E4中装有澄清石灰水。
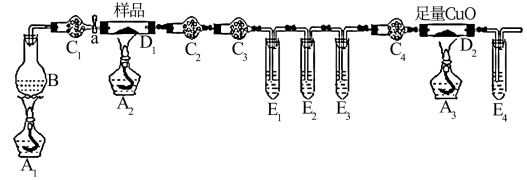
(1)充分反应后,将D1中的固体残余物投入足量经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为________________ 。
(2)该实验装置中有3个酒精灯,至少应该点__________ 次酒精灯,最先点燃的酒精灯是_________ ,最后点燃的是_______ 。
(3)该实验装置中有4个直立的试管,它们与盛放试剂体现不同的作用,其中E2的作用是:___________ 。
(4)该实验装置中有4个干燥管,C3中盛装的试剂是__________________ 。
(5)取7.2 g样品充分反应后,测得D1中的固体残余物为2.88 g,D2中固体质量减轻0.64 g,则草酸亚铁晶体(FeC2O4·nH2O)分解的方程式为__________________________ 。

(1)充分反应后,将D1中的固体残余物投入足量经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为
(2)该实验装置中有3个酒精灯,至少应该点
(3)该实验装置中有4个直立的试管,它们与盛放试剂体现不同的作用,其中E2的作用是:
(4)该实验装置中有4个干燥管,C3中盛装的试剂是
(5)取7.2 g样品充分反应后,测得D1中的固体残余物为2.88 g,D2中固体质量减轻0.64 g,则草酸亚铁晶体(FeC2O4·nH2O)分解的方程式为
您最近一年使用:0次
2017-02-17更新
|
190次组卷
|
3卷引用:2015届河北省唐山一中高三上学期12月月考理综化学试卷
6 . 高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿制高锰酸钾的流程如下(部分条件和产物省略):

请回答下列问题:
(1)提高锰酸钾浸出率(浸出锰酸钾质量与固体总质量之比)的措施有___ 。
(2)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:_ 。
(3)从经济性考虑试剂X宜选择(填名称):____ ,上述流程中,设计步骤IV和V的目的是__ 。
(4)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化.
①阳极反应式为____ 。
②电解过程中,阴极附近电解质溶液的pH将____ (填:增大、减小或不变)。
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色,表明达到滴定终点。写出离子方程式:__ 。
(6)已知:常温下,Ksp[Mn(OH)2]=2.0×10-13。工业上,调节pH沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=___ 。

请回答下列问题:
(1)提高锰酸钾浸出率(浸出锰酸钾质量与固体总质量之比)的措施有
(2)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:
(3)从经济性考虑试剂X宜选择(填名称):
(4)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化.
①阳极反应式为
②电解过程中,阴极附近电解质溶液的pH将
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色,表明达到滴定终点。写出离子方程式:
(6)已知:常温下,Ksp[Mn(OH)2]=2.0×10-13。工业上,调节pH沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=
您最近一年使用:0次
真题
名校
7 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)步骤①中得到的氧化产物是_________ ,溶解温度应控制在60~70度,原因是__________ 。
(2)写出步骤③中主要反应的离子方程式___________ 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________ (写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是______________________________ 。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有__________ (填字母)
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________ 。

回答下列问题:
(1)步骤①中得到的氧化产物是
(2)写出步骤③中主要反应的离子方程式
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥不能省略,理由是
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有
| A.分馏塔 | B.离心机 | C.反应釜 | D.框式压滤机 |
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为
您最近一年使用:0次
2015-06-24更新
|
4994次组卷
|
6卷引用:河北省石家庄市第二中学2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分



