1 . 为测定某亚硫酸钠(Na2SO3)样品的纯度,甲同学称取5.0g固体用如下装置进行实验。回答以下问题:
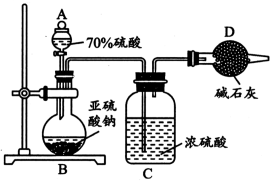
(1)仪器A的名称为_______ 。
(2)B中烧瓶内发生反应的离子方程式为_______ 。
(3)亚硫酸钠易氧化变质,变质后的样品中除亚硫酸钠外还将含有____ (填化学式)。证明Na2SO3样品已部分变质的方法是____ 。
(4)反应结束后,测得D处干燥管增重2.4g,可知该样品中亚硫酸钠的纯度为_______ 。若缺少装置C,实验测得的样品的纯度_______ (填“偏高”或“偏低”或“无影响”)。
(5)乙认为甲的实验方案存在明显缺陷,为使结果更准确,应采取的做法是_______ 。

(1)仪器A的名称为
(2)B中烧瓶内发生反应的离子方程式为
(3)亚硫酸钠易氧化变质,变质后的样品中除亚硫酸钠外还将含有
(4)反应结束后,测得D处干燥管增重2.4g,可知该样品中亚硫酸钠的纯度为
(5)乙认为甲的实验方案存在明显缺陷,为使结果更准确,应采取的做法是
您最近一年使用:0次
2 . 氨基甲酸铵( )是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
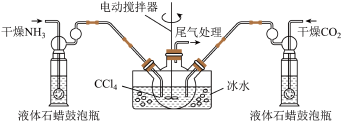
(1)制备氨基甲酸铵的化学方程式为____________
(2)三颈烧瓶用冰水冷却的原因是______________
(3)液体石蜡鼓泡瓶的作用是_______________
(4)水是很好的溶剂,且可以大量吸收反应混合气体,该反应中是否可用水作溶剂:________ (填“是”或“否”),理由:___________
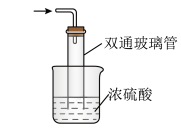
(5)尾气处理装置如图所示,双通玻璃管的作用是_________ ,浓硫酸的作用是________
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为1.00 g。则样品中氨基甲酸铵的质量分数为________
 )是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
(1)制备氨基甲酸铵的化学方程式为
(2)三颈烧瓶用冰水冷却的原因是
(3)液体石蜡鼓泡瓶的作用是
(4)水是很好的溶剂,且可以大量吸收反应混合气体,该反应中是否可用水作溶剂:
(5)尾气处理装置如图所示,双通玻璃管的作用是

(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为1.00 g。则样品中氨基甲酸铵的质量分数为
您最近一年使用:0次
3 . 过碳酸钠(化学式为2Na2CO3·3H2O2)俗名固体双氧水。溶于水可看作是Na2CO3溶液和H2O2溶液混合。为了方便保存,过碳酸钠样品可能添加少量的MgSO4和硅酸镁中的一种或二种作为稳定剂。已知①双氧水可用于供氧、消毒和漂白;②硅酸镁不溶于水。
(1)过碳酸钠的用途不合理的是_________ 。(填字母)
A.鱼池供氧剂B.消毒剂C.干燥剂D.漂白剂
(2)在“过碳酸钠”中加入下列物质时,不会导致“过碳酸钠”变质______________ (填字母)。
A.二氧化锰 B.稀盐酸 C.硫酸钠 D.石灰水
(3)利用实验室限选试剂,设计实验确定该样品中是否添加少量的MgSO4。
限选试剂:稀盐酸、稀H2SO4、BaCl2溶液、蒸馏水、AgNO3溶液
(1)过碳酸钠的用途不合理的是
A.鱼池供氧剂B.消毒剂C.干燥剂D.漂白剂
(2)在“过碳酸钠”中加入下列物质时,不会导致“过碳酸钠”变质
A.二氧化锰 B.稀盐酸 C.硫酸钠 D.石灰水
(3)利用实验室限选试剂,设计实验确定该样品中是否添加少量的MgSO4。
限选试剂:稀盐酸、稀H2SO4、BaCl2溶液、蒸馏水、AgNO3溶液
| 实验操作 | 预期现象和必要结论 |
| 步骤1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤。 | 得到① |
| 步骤2:取少量步骤1所得的滤液于试管中,加入② | ③ |
| 步骤3:取少量步骤2所得的溶液于试管中,④ | ⑤ |
您最近一年使用:0次
4 . 下列实验方案能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 鉴别NO2、溴蒸气 | 用湿润的淀粉碘化钾试纸放在集气瓶口,若试纸变蓝则该气体为溴蒸气 |
| B | 验证I-还原性强于Cl- | 向NaI溶液中依次滴入少量新制氯水和苯,振荡、静置,上层溶液呈紫红色 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变成红色 |
| D | 检验SO2的漂白性 | 将SO2气体通入酸性高锰酸钾溶液中,观察溶液是否褪色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-11-28更新
|
402次组卷
|
4卷引用:广西桂林市龙胜中学2020届高三上学期期中考试化学试题
解题方法
5 . 如图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃处为SO2气体发生装置,C处为SO2与O2反应的装置。
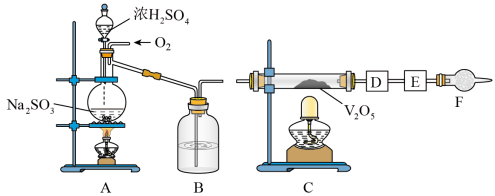
完成下列填空:
(1)A处的化学反应方程式为___ ,所用的硫酸一般为___ (此处填98%的硫酸溶液、70%的硫酸溶液或30%的硫酸溶液)。
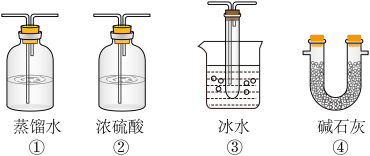
(2)根据实验需要,应该在D、E处连接合适的装置。请从图中选择,将所选装置的序号填入相应的空格,D:___ ,E:____ 。
(3)用12.6gNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间 ,最后测得E处装置增重1.28gSO2,则此时SO2的转化率为
,最后测得E处装置增重1.28gSO2,则此时SO2的转化率为____ %。
(4)若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是___ 。
(5)以下各种尾气吸收装置中,适合于吸收该尾气,而且能防止倒吸的是___ 。

完成下列填空:
(1)A处的化学反应方程式为
(2)根据实验需要,应该在D、E处连接合适的装置。请从图中选择,将所选装置的序号填入相应的空格,D:

(3)用12.6gNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间
 ,最后测得E处装置增重1.28gSO2,则此时SO2的转化率为
,最后测得E处装置增重1.28gSO2,则此时SO2的转化率为(4)若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是
(5)以下各种尾气吸收装置中,适合于吸收该尾气,而且能防止倒吸的是

您最近一年使用:0次
名校
6 . 下列设计的实验方案能达到相应实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol·L−1CuSO4溶液,迅速产生较多气泡 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硝酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| D | 证明氯化银的溶解度大于硫化银的溶解度 | 向2mL 0.1mol·L−1硝酸银溶液中加入1mL 0.1 mol·L−1 NaCl溶液,出现白色沉淀,再加入几滴0.1mol·L−1的Na2S溶液,有黑色沉淀生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-03-18更新
|
1320次组卷
|
6卷引用:广西柳州高级中学2020届高三12月月考理综化学试题
7 . 乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288),可由乳酸与FeCO3反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
I.制备碳酸亚铁:装置如图所示。
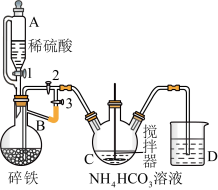
(1)仪器B的名称是________ 。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是____________________________ ,然后关闭活塞1,接下来的操作是____________________ ,此后,C装置溶液中有沉淀生成,并有大量气泡冒出,则C中发生反应的离子方程式为_____________________________________ 。
Ⅱ.制备乳酸亚铁:
(3)向纯净的FeCO3固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式为____________ 。为防止乳酸亚铁变质,在上述体系中还应加入适量铁粉。反应结束后,将所得溶液隔绝空气低温浓缩、_________ 、过滤、洗涤、干燥,得乳酸亚铁晶体。该晶体存放时应注意_________________________ 。
Ⅲ.乳酸亚铁晶体纯度的测量:
(4)某同学查阅文献后,用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量并计算样品纯度(反应中Ce4+还原为Ce3+),他称取6.00g样品,配制成250.00mL溶液,取出25.00mL,用浓度为0.10mol·L-1的(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为________ (以质量分数表示)。
I.制备碳酸亚铁:装置如图所示。

(1)仪器B的名称是
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是
Ⅱ.制备乳酸亚铁:
(3)向纯净的FeCO3固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式为
Ⅲ.乳酸亚铁晶体纯度的测量:
(4)某同学查阅文献后,用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量并计算样品纯度(反应中Ce4+还原为Ce3+),他称取6.00g样品,配制成250.00mL溶液,取出25.00mL,用浓度为0.10mol·L-1的(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为
您最近一年使用:0次
名校
解题方法
8 . 某小组同学探究久置 固体变质的情况,并测定其中铁元素的质量分数。将
固体变质的情况,并测定其中铁元素的质量分数。将 固体用蒸馏水溶解,配成
固体用蒸馏水溶解,配成 待测液,进行实验。
待测液,进行实验。
资料: 中S元素的化合价为-2价:酸性条件下,
中S元素的化合价为-2价:酸性条件下, 的还原产物为
的还原产物为 。
。
(1)实验一:
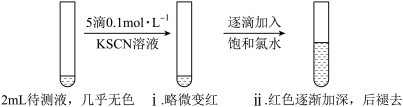
①i中溶液略微变红,说明待测液中存在___________ 。
②ii中溶液颜色逐渐加深的原因是___________ 。
③由实验一推测 固体变质的情况是
固体变质的情况是___________ (填字母序号)。
a.未变质 b.部分变质 c.完全变质
(2)实验二:探究ii中“红色褪去”的原因。
针对“红色褪去”的现象,小组同学猜想可能的原因是___________ ,并通过如下实验证实了猜想。将褪色后的溶液分两份分别进行实验,请补全①中的操作和②中的现象。
(3)实验三:将 固体用蒸馏水溶解,配成
固体用蒸馏水溶解,配成 待测液,进行实验,测定久置
待测液,进行实验,测定久置 固体中铁元素的含量。设计实验方案如图:
固体中铁元素的含量。设计实验方案如图:
①可选作A的物质是___________ (填字母序号)。
a. b.
b. c.
c. d.
d.
②若消耗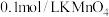 溶液
溶液 ,则久置
,则久置 固体中铁元素的质量分数是
固体中铁元素的质量分数是___________ 。
 固体变质的情况,并测定其中铁元素的质量分数。将
固体变质的情况,并测定其中铁元素的质量分数。将 固体用蒸馏水溶解,配成
固体用蒸馏水溶解,配成 待测液,进行实验。
待测液,进行实验。资料:
 中S元素的化合价为-2价:酸性条件下,
中S元素的化合价为-2价:酸性条件下, 的还原产物为
的还原产物为 。
。(1)实验一:

①i中溶液略微变红,说明待测液中存在
②ii中溶液颜色逐渐加深的原因是
③由实验一推测
 固体变质的情况是
固体变质的情况是a.未变质 b.部分变质 c.完全变质
(2)实验二:探究ii中“红色褪去”的原因。
针对“红色褪去”的现象,小组同学猜想可能的原因是
| 序号 | 操作 | 现象 |
| ① | 产生红褐色沉淀 | |
| ② | 滴加 溶液 溶液 |
(3)实验三:将
 固体用蒸馏水溶解,配成
固体用蒸馏水溶解,配成 待测液,进行实验,测定久置
待测液,进行实验,测定久置 固体中铁元素的含量。设计实验方案如图:
固体中铁元素的含量。设计实验方案如图:
①可选作A的物质是
a.
 b.
b. c.
c. d.
d.
②若消耗
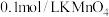 溶液
溶液 ,则久置
,则久置 固体中铁元素的质量分数是
固体中铁元素的质量分数是
您最近一年使用:0次
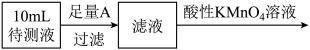
9 . 甲乙两同学对保存已久的Na2SO3试剂进行实验探究。
取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解。
(1)测上述溶液的pH值,其pH值>7,原因是(用离子方程式表示)_________
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是______
(3)假设试剂由Na2SO3和Na2SO4组成,设计实验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论。
限选 试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量。实验如下:
①配制250ml约0.2mol•L-1Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入________ ,洗涤,定容,摇匀。
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将0.05mol•L-1酸性高锰酸钾装入50ml____ (填酸式或碱式)滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4VmL。
③计算Na2SO3的质量分数=______ (只列出计算式,不要求 算出结果)
取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解。
(1)测上述溶液的pH值,其pH值>7,原因是(用离子方程式表示)
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是
(3)假设试剂由Na2SO3和Na2SO4组成,设计实验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 1.取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置。 | |
| 2.取适量步骤1所得溶液于试管中,加入少量的 | 若溶液褪色,说明其有 若溶液不褪色,说明其中没有 |
| 3.再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴 加 | 如果有白色沉淀生成,则说明其中有 |
①配制250ml约0.2mol•L-1Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将0.05mol•L-1酸性高锰酸钾装入50ml
③计算Na2SO3的质量分数=
您最近一年使用:0次
2016-12-09更新
|
166次组卷
|
3卷引用:广西陆川县中学2017-2018学年高二12月月考化学试题
10 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
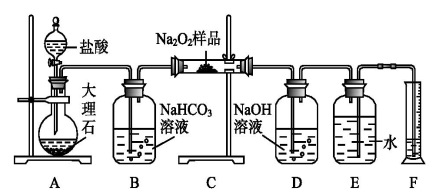
①A中发生反应离子方程式为_____________________ 。
②将仪器连接好以后,必须进行的第一步操作是_____________________ 。
③B装置出来的气体是否需要干燥_________________ 。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________ ,______________ 。
⑤D中NaOH溶液的作用_______________________ 。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________ 。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________ 。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________ 。(填“偏大”、“偏小”或“不影响”)
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为
②将仪器连接好以后,必须进行的第一步操作是
③B装置出来的气体是否需要干燥
④写出装置C中发生的所有反应的化学方程式
⑤D中NaOH溶液的作用
⑥实验结束时,读取实验中生成气体的体积时,不合理的是
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为
⑧实验完成后E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次
2017-02-17更新
|
2185次组卷
|
22卷引用:广西隆林县第二中学2019-2020学年高一上学期期末考试化学试题
广西隆林县第二中学2019-2020学年高一上学期期末考试化学试题2016-2017陕西西安长安区一中实验班高一12月考化学卷【校级联考】安徽省滁州市定远县西片区2018-2019学年高一上学期期中考试化学试题云南省富宁县民族中学2019-2020学年高二上学期开学考试化学试题云南省文山州马关县第一中学2019-2020学年高二上学期9月份考试 化学试题云南省通海县三中2019-2020学年高二9月份(开学考试)化学试题云南省玉溪元江民中2019-2020学年高二开学考试化学试题云南省金平县一中2019-2020学年高二上学期开学考试化学试题云南省通海县三中2019-2020学年高一上学期期中考试化学试题云南省玉溪市通海县第二中学2019-2020学年高一上学期12月月考化学试题云南省剑川县第一中学2019-2020学年高一上学期期末考试化学试题云南省绿春县高级中学2019-2020学年高一上学期期末考试化学试题云南省武定民族中学2019-2020学年 高一上学期期末考试化学试题人教版高一化学必修1第三章《金属及其化合物》测试卷云南省丽江市华坪县第一中学2019—2020学年高一上学期期末考试化学试题云南省丽江县第三中学2019—2020学年高一上学期期末考试化学试题云南省昭通市永善县明志高级中学2019—2020学年高一上学期期末考试化学试题云南省昭通市大关县第一中学2019-2020学年高一上学期期末考试化学试题云南省昆明市寻甸县第三中学2019-2020学年高一上学期期末考试化学试题甘肃省白银市会宁县第四中学2021届高三上学期第二次月考化学试题云南省曲靖市第二中学2020-2021学年高一上学期期末考试化学试题云南省迪庆州香格里拉中学2019-2020学年高一上学期期末考试化学试题



