解题方法
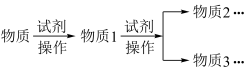
1 . 粘土帆矿(含V2O5、Fe2O3、Al2O3、SiO2等不溶性成分)制备V2O5的工艺流程如下:

已知: ①硫酸氧钒[(VO)SO4]高温易分解生成VO2和SO3
②萃取剂对相关离子的萃取能力如下表:
回答下列问题:
(1)粘土钒矿焙烧时一般选择 250℃的原因是______ ,V2O5与浓硫酸生成硫酸氧钒的化学方程式______ 。
(2)为提高浸出效率可采取的操作有______ (答两条),浸出液中存在 VO2+、VO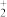 、 Fe3+、Al3+和
、 Fe3+、Al3+和 离子,萃取前加入铁粉的目的
离子,萃取前加入铁粉的目的______ 。
(3)“反萃取”用 20%硫酸目的为______ ,“氧化”的离子方程式为______ 。
(4)用反萃取法由碘的 CCl4溶液提取碘单质,画出流程图______ 。

已知: ①硫酸氧钒[(VO)SO4]高温易分解生成VO2和SO3
②萃取剂对相关离子的萃取能力如下表:
| 微粒 | VO2+ | VO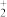 | Fe3+ | Fe2+ |
| 萃取能力 | 强(随pH增大而增强) | 弱 | 强 | 弱 |
(1)粘土钒矿焙烧时一般选择 250℃的原因是
(2)为提高浸出效率可采取的操作有
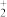 、 Fe3+、Al3+和
、 Fe3+、Al3+和 离子,萃取前加入铁粉的目的
离子,萃取前加入铁粉的目的(3)“反萃取”用 20%硫酸目的为
(4)用反萃取法由碘的 CCl4溶液提取碘单质,画出流程图

您最近一年使用:0次
2021-03-18更新
|
1684次组卷
|
3卷引用:山东省青岛市2021届高三3月统一质量检测化学试题
解题方法
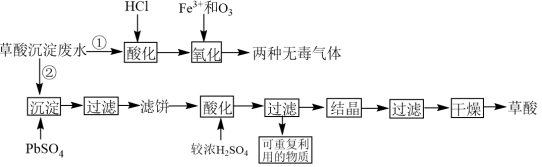
2 . 稀土工业生产中,草酸(H2C2O4)是稀土元素沉淀剂。工业生产中会产生稀土草酸沉淀废水,其主要成分为盐酸和草酸的混合溶液及微量的草酸稀土杂质等。此废水腐蚀性较强,直接排放会造成环境污染。工业上处理废水的方法包括“①氧化法”和“②沉淀法”。相关工业流程如图所示:
25℃时,各物质的溶度积常数如下表:
回答下列问题:
(1)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体。则草酸和臭氧反应的化学方程式为_______ 。
(2)“氧化”步骤中,当废水pH=1.0时,单位时间内的草酸去除率接近55%;当废水的pH上升至5.5时,单位时间内的草酸去除率只有5%,其原因是_______ 。为了使加入的17.5mg·L-1的Fe3+催化效果达到最佳,废水酸化时应将pH调整至小于_______ (已知lg2=0.3,1g5=0.7)。
(3)“②沉淀法”:将1.5mol PbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)=PbC2O4(s)+2H+(aq)+ (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=_______ 。
(4)滤饼“酸化”“过滤”后可重复利用的物质为_______ (填化学式)。
(5)比较“①氧化法”和“②沉淀法”,从原料利用率角度分析,方法_______ (填“①”或“②”)更好,原因是_______ 。

25℃时,各物质的溶度积常数如下表:
| Ksp[Fe(OH)3] | Ksp(PbSO4) | Ksp(PbC2O4) | Ka1(H2C2O4)] | Ka2(H2C2O4) |
| 2.5×10-39 | 2.0×10-8 | 5.0×10-10 | 6.0×10-2 | 6.25×10-5 |
(1)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体。则草酸和臭氧反应的化学方程式为
(2)“氧化”步骤中,当废水pH=1.0时,单位时间内的草酸去除率接近55%;当废水的pH上升至5.5时,单位时间内的草酸去除率只有5%,其原因是
(3)“②沉淀法”:将1.5mol PbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)=PbC2O4(s)+2H+(aq)+
 (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=(4)滤饼“酸化”“过滤”后可重复利用的物质为
(5)比较“①氧化法”和“②沉淀法”,从原料利用率角度分析,方法
您最近一年使用:0次
19-20高二·浙江·期中
名校
3 . 由一种阳离子与两种酸根离子组成的盐称为混盐,CaOCl2是一种常见的混盐,下列说法不正确的是
| A.CaOCl2有较强的氧化性 |
| B.CaOCl2水溶液呈碱性 |
| C.由氯气为原料,每生成1 mol CaOCl2,转移的电子数为2NA |
| D.CaOCl2的溶液中加入足量浓硫酸,可有黄绿色的气体产生 |
您最近一年使用:0次
名校
4 . 足量的铜与一定量的浓硝酸充分反应,得到4.48L(标准状况)NO2与NO的混合气体,这些气体与一定体积的O2混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入100mL4mol·L-1NaOH溶液,Cu2+恰好沉淀完全。下列说法正确的是
| A.此反应过程中转移了0.5mol的电子 |
| B.消耗氧气的体积为1.12L(标准状况) |
| C.参加反应的HNO3是0.45mol |
| D.混合气体中含2.24L(标准状况)NO |
您最近一年使用:0次
2020-07-22更新
|
3034次组卷
|
11卷引用:辽宁省大连市旅顺口区2019-2020学年高一下学期期末考试化学试题
辽宁省大连市旅顺口区2019-2020学年高一下学期期末考试化学试题辽宁省大连市2019-2020学年高一下学期期末考试化学试题重庆市缙云教育联盟2020-2021学年高一9月月考化学试题山西省实验中学2020-2021学年高一下学期第一次月考化学试题辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题辽宁省部分中学2019-2020高一下学期期末考试化学试题黑龙江省鹤岗市第一中学2021-2022学年高一下学期4月月考化学试题云南省曲靖市第一中学2022-2023学年高一下学期期末考试化学试题安徽省铜陵市第一中学2022-2023 学年高一下学期期中教学质量检测化学试题云南省开远市第一中学校2022-2023学年高一下学期期末考试化学试题重庆市万州第二高级中学2023-2024学年高一下学期3月月考试题 化学试题
解题方法
5 . 草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}易溶于水,难溶于乙醇,110℃可完全失去结晶水,是制备某些铁触媒的主要原料。实验室通过下列方法制备Ka[Fe(C2O4)b]·cH2O并测定其组成:
Ⅰ.草酸合铁酸钾晶体的制备
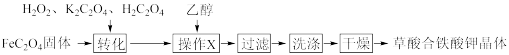
(1)“转化”过程中若条件控制不当,会发生H2O2氧化H2C2O4的副反应,写出该副反应的化学方程式:_________________________ 。
(2)“操作X”中加入乙醇的目的是_______________________ 。
Ⅱ.草酸合铁酸钾组成的测定
步骤1:准确称取两份质量均为0.4910 g的草酸合铁酸钾样品。
步骤2:一份在N2氛围下保持110℃加热至恒重,称得残留固体质量为0.4370 g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱,发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-,用蒸馏水冲洗交换柱,收集交换出的Cl-,以K2CrO4为指示剂,用0.1500 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液20.00 mL。
(3)若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量________ (填“偏大”“偏小”或“不变”)。
(4)通过计算确定草酸合铁酸钾样品的化学式(写出计算过程)。________
Ⅰ.草酸合铁酸钾晶体的制备

(1)“转化”过程中若条件控制不当,会发生H2O2氧化H2C2O4的副反应,写出该副反应的化学方程式:
(2)“操作X”中加入乙醇的目的是
Ⅱ.草酸合铁酸钾组成的测定
步骤1:准确称取两份质量均为0.4910 g的草酸合铁酸钾样品。
步骤2:一份在N2氛围下保持110℃加热至恒重,称得残留固体质量为0.4370 g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱,发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-,用蒸馏水冲洗交换柱,收集交换出的Cl-,以K2CrO4为指示剂,用0.1500 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液20.00 mL。
(3)若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量
(4)通过计算确定草酸合铁酸钾样品的化学式(写出计算过程)。
您最近一年使用:0次
2020·全国·零模
解题方法
6 . 某磷灰石主要成分有羟磷灰石[Ca5(PO4)3OH]和氟磷灰石[Ca5(PO4)3F];制备磷酸的两种工艺流程如图(部分产物和条件省略):
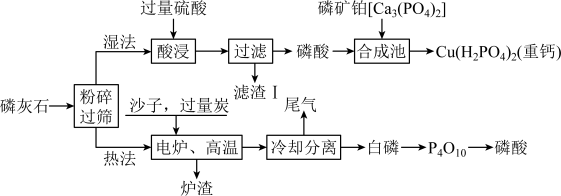
试回答下列问题:
(1)Ca5(PO4)3OH改写成“碱和盐”形式为:___ ;从组成看,Ca5(PO4)3F,类似下列盐的是___ (填字母)。
A.(NH4)2Fe(SO4)2 B.CaOCl2
C.BiOCl(Bi为+3价) D.Cu2(OH)2CO3
(2)提高“酸浸”速率的措施有___ (填一条即可)。
(3)“酸浸”中Ca5(PO4)3F和H2SO4反应的化学方程式为___ (要求:x用数字表示)。
(4)沙子、过量焦炭、氟磷灰石在电炉中反应生成CaSiO3、白磷、SiF4和另一种还原性气体,写出该反应的化学程式:___ ,在该反应中氧化产物与还原产物的物质的量之比为___ 。
(5)常温下,Ksp(CaSO4)=7.1×10-5,Ksp[Ca3(PO4)2]=2.1×10-33。H3PO4的电离常数:pK1=-lgK1=2.12,pK2=7.21,pK3=12.67,从离子积和浓度积关系角度分析Ca3(PO4)2和H2SO4反应生成CaSO4和H3PO4的主要原因是___ 。
(6)相对于湿法,热法的主要缺点有能耗高等,优点有___ (答一条即可)

试回答下列问题:
(1)Ca5(PO4)3OH改写成“碱和盐”形式为:
A.(NH4)2Fe(SO4)2 B.CaOCl2
C.BiOCl(Bi为+3价) D.Cu2(OH)2CO3
(2)提高“酸浸”速率的措施有
(3)“酸浸”中Ca5(PO4)3F和H2SO4反应的化学方程式为
(4)沙子、过量焦炭、氟磷灰石在电炉中反应生成CaSiO3、白磷、SiF4和另一种还原性气体,写出该反应的化学程式:
(5)常温下,Ksp(CaSO4)=7.1×10-5,Ksp[Ca3(PO4)2]=2.1×10-33。H3PO4的电离常数:pK1=-lgK1=2.12,pK2=7.21,pK3=12.67,从离子积和浓度积关系角度分析Ca3(PO4)2和H2SO4反应生成CaSO4和H3PO4的主要原因是
(6)相对于湿法,热法的主要缺点有能耗高等,优点有
您最近一年使用:0次
2013·上海·零模
解题方法
7 . 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。将5.60 g α-Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为6.88 g。
(1)产生的氢气的体积为_________ mL(标准状况下)。
(2)将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量。____________
(3)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________ 。T的化学式为____________ 。
(4)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
①混合气体的平均摩尔质量为______________ 。
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
(5)有机高分子材料聚酯纤维可由二酸与二醇通过缩聚形成。如100个乙二酸分子与100个乙二醇分子发生缩聚,当形成一条聚酯链时,其(平均)式量达到最大(如图所示,其式量为11618)。
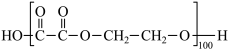
为降低聚酯链的长度与平均式量,可调整乙二酸与乙二醇的相对用量,使形成的聚酯链两端均为相同基团,从而无法再连接增长。现有100个乙二酸分子与105个乙二醇分子恰好完全反应,且聚酯链无法再增长。
①共形成_____ 条聚酯链。
②计算所得聚酯的平均式量。_______________
(1)产生的氢气的体积为
(2)将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量。
(3)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为
(4)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
①混合气体的平均摩尔质量为
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% |
(5)有机高分子材料聚酯纤维可由二酸与二醇通过缩聚形成。如100个乙二酸分子与100个乙二醇分子发生缩聚,当形成一条聚酯链时,其(平均)式量达到最大(如图所示,其式量为11618)。
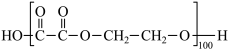
为降低聚酯链的长度与平均式量,可调整乙二酸与乙二醇的相对用量,使形成的聚酯链两端均为相同基团,从而无法再连接增长。现有100个乙二酸分子与105个乙二醇分子恰好完全反应,且聚酯链无法再增长。
①共形成
②计算所得聚酯的平均式量。
您最近一年使用:0次
8 . 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为_______ 。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中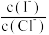 为:
为:_______ ,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) =H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_______ kJ。
(4)Bodensteins研究了下列反应:2HI(g)⇌H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的计算式为:_______ 。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为_______ (以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=_______ min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_______ (填字母)

(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
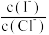 为:
为:(3)已知反应2HI(g) =H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
(4)Bodensteins研究了下列反应:2HI(g)⇌H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为

您最近一年使用:0次
2019-01-30更新
|
7110次组卷
|
9卷引用:2015年全国普通高等学校招生统一考试化学(新课标I卷)
名校
解题方法
9 . 2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢(HCN)气体。氰化氢的沸点只有26 ℃,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题:
(1)写出氰化钠遇水产生氰化氢气体的离子方程式_________________________
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式________________________________ 。
(3)爆炸残留在废水中的CN-可以用Cr2O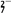 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
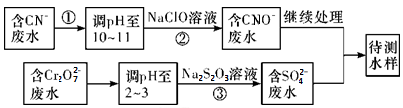
①上述处理废水流程中主要使用的方法是____________
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为_________________ ;
③步骤③中,每处理0.4 mol Cr2O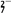 时转移电子2.4 mol,该反应的离子方程式
时转移电子2.4 mol,该反应的离子方程式_________ ;
(1)写出氰化钠遇水产生氰化氢气体的离子方程式
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式
(3)爆炸残留在废水中的CN-可以用Cr2O
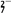 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
①上述处理废水流程中主要使用的方法是
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为
③步骤③中,每处理0.4 mol Cr2O
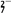 时转移电子2.4 mol,该反应的离子方程式
时转移电子2.4 mol,该反应的离子方程式
您最近一年使用:0次
2017-12-13更新
|
625次组卷
|
2卷引用:湖南省浏阳一中、醴陵一中、南方中学2017-2018学年高二12月联考化学试题
名校
解题方法
10 . 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、A12O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如图所示。
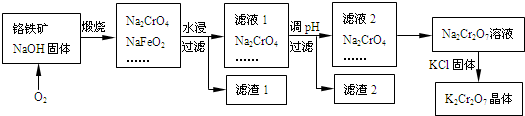
已知:①NaFeO2遇水强烈水解.②Cr2O72-+H2O 2CrO42-+2H+。
2CrO42-+2H+。
请回答:
(1)K2Cr2O7中K元素的原子结构示意图为____________ ,化合价是_______________ 。
(2)往铬铁矿里通入氧气的主要目的是__________________ 。滤液1的成分除Na2CrO4外,还含有_____ (填化学式)。
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式
是________________________ 。
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是____________________ 。
(5)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、__________ 、过滤、洗涤、干燥。
(6)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是_______________________ 。

已知:①NaFeO2遇水强烈水解.②Cr2O72-+H2O
 2CrO42-+2H+。
2CrO42-+2H+。请回答:
(1)K2Cr2O7中K元素的原子结构示意图为
(2)往铬铁矿里通入氧气的主要目的是
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式
是
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是
(5)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、
(6)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是
您最近一年使用:0次



