1 . 下列实验能得出相关结论的是
| 实验操作 | 实验结论 | |
| A | 向NaHA溶液中滴加紫色石蕊溶液,溶液变为蓝色 | Kw>Ka1(H2A)·Ka2(H2A) |
| B | 常温下将铝片投入浓硝酸中,无明显现象 | 铝与浓硝酸不反应 |
| C | 向10mL0.1mol·L-1FeCl3溶液中加入5mL0.1mol·L-1KSCN溶液,溶液显红色,再滴加少量1mol·L-1KSCN溶液,红色加深 | Fe3+和SCN-的反应是可逆反应 |
| D | 向FeCl2溶液中滴加少量的酸性KMnO4溶液,KMnO4溶液褪色 | 氧化性: >Cl2 >Cl2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 工业上以赤泥[主要成分是Sc2O3,另含有少量Fe2O3、SiO2(不溶于酸)、Al2O3等]为主要原料提取氧化钪,其工艺流程如图所示(P2O4是一种磷酸酯萃取剂,草酸化学式为H2C2O4)。
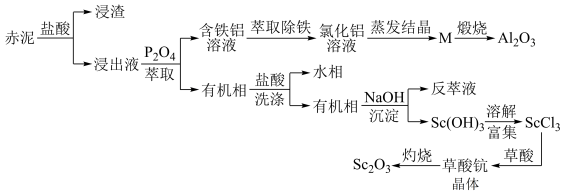
回答下列问题:
(1)赤泥经盐酸处理后所得“浸渣”主要成分为____ (化学式)。
(2)赤泥“盐酸酸浸”时不宜温度过高,原因是____ 。
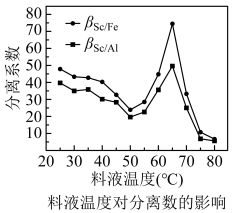
(3)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如表所示,萃取时P2O4最佳浓度及料液温度分别为____ 、____ ;
P2O4浓度对萃取率的影响如表:
料液温度对分离系数的影响如图:
(4)M经煅烧后可得到Al2O3,则M成分为____ 。
(5)为探究所得草酸钪晶体Sc2(C2O4)3·xH2O中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69gSc2O3固体,则x=____ 。
(6)草酸钪晶体在空气中灼烧分解反应方程式为____ 。

回答下列问题:
(1)赤泥经盐酸处理后所得“浸渣”主要成分为
(2)赤泥“盐酸酸浸”时不宜温度过高,原因是
(3)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如表所示,萃取时P2O4最佳浓度及料液温度分别为
P2O4浓度对萃取率的影响如表:
试验编号 | P2O4浓度/% | 分相情况 | 钪萃取率/% | 铁萃取率/% |
1-1 | 1 | 分相快 | 90.76 | 15.82 |
1-2 | 2 | 分相容易 | 91.53 | 19.23 |
1-3 | 3 | 分相容易 | 92.98 | 13.56 |
1-4 | 4 | 有第三相 | 90.69 | 30.12 |
1-5 | 5 | 轻微乳化 | 91.74 | 39.79 |
料液温度对分离系数的影响如图:

(4)M经煅烧后可得到Al2O3,则M成分为
(5)为探究所得草酸钪晶体Sc2(C2O4)3·xH2O中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69gSc2O3固体,则x=
(6)草酸钪晶体在空气中灼烧分解反应方程式为
您最近一年使用:0次
名校
解题方法
3 . 将一定量的氯气通入 的氢氧化钾浓溶液中,加热少许时间后,恰好完全反应,测得溶液中含氯元素的离子有:
的氢氧化钾浓溶液中,加热少许时间后,恰好完全反应,测得溶液中含氯元素的离子有: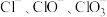 。下列说法
。下列说法不正确 的是
 的氢氧化钾浓溶液中,加热少许时间后,恰好完全反应,测得溶液中含氯元素的离子有:
的氢氧化钾浓溶液中,加热少许时间后,恰好完全反应,测得溶液中含氯元素的离子有: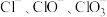 。下列说法
。下列说法A.一共消耗了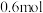 氯气 氯气 |
B.当溶液中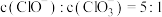 时,反应的离子方程式为: 时,反应的离子方程式为: |
C.若反应中转移的电子为 ,则 ,则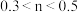 |
D.反应生成的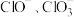 有一定的氧化性 有一定的氧化性 |
您最近一年使用:0次
2023-02-16更新
|
1015次组卷
|
2卷引用:广东省大湾区2022-2023学年高一上学期期末联考化学试题
名校
解题方法
4 . 标准状况下,将SO2和Cl2组成的混合气体a L通入200mL 0.1mol·L-1 Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅(溶液体积近似不变)。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则下列分析错误的是(已知:SO2+2Fe3++2H2O=SO +2Fe2++4H+)
+2Fe2++4H+)
 +2Fe2++4H+)
+2Fe2++4H+)| A.a L混合气体的物质的量可能为0.08mol |
| B.混合气体中SO2的体积为0.896L |
| C.所得沉淀为0.1mol的BaSO4 |
| D.混合气体中Cl2的物质的量可能为0.03mol |
您最近一年使用:0次
2023-02-16更新
|
1819次组卷
|
3卷引用:上海市复旦大学附属中学2022-2023学年高一上学期2月期末考试化学试题
名校
5 .  (易潮解)是一种潜在的锂电池的电解质材料。某小组用粗锌(含少量
(易潮解)是一种潜在的锂电池的电解质材料。某小组用粗锌(含少量 和
和 )和稀硫酸反应制备
)和稀硫酸反应制备 ,利用纯化后的氢气还原硫酸锂制备硫化锂并对产品纯度进行分析。
,利用纯化后的氢气还原硫酸锂制备硫化锂并对产品纯度进行分析。
请回答下列问题:
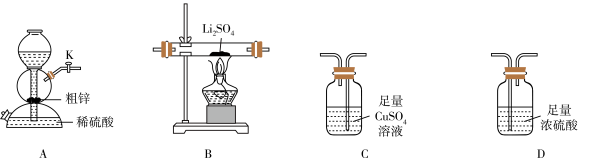
(1)利用上述装置制备 ,按气流从左至右,装置的连接顺序是A→
,按气流从左至右,装置的连接顺序是A→_______ (填字母,装置可重复使用)。
(2)其他条件相同,粗锌与稀硫酸反应比纯锌_______ (填“快”或“慢”),B中反应的化学方程式为_______ ,C中现象是_______ 。
(3)探究 产品的成分
产品的成分
由上述实验Ⅱ中滴加试剂为_______ ,产品中含有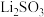 、
、 杂质的原因可能是
杂质的原因可能是_______ 。
(4)定量测定 的含量
的含量
①取 g
g 样品加入
样品加入


 稀硫酸(过量)
稀硫酸(过量)
②充分反应后,煮沸溶液以除去残留的酸性气体
③滴加酚酞溶液作指示剂,用
 标准
标准 溶液滴定过量的硫酸,消耗
溶液滴定过量的硫酸,消耗 溶液
溶液
 ,产品含
,产品含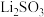 杂质,但不影响上述实验方案的科学性,理由是
杂质,但不影响上述实验方案的科学性,理由是_______ ,若产品中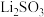 杂质含量为10%(质量分数),则
杂质含量为10%(质量分数),则 样品的纯度为
样品的纯度为_______ (用含 、
、 、
、 、
、 、m的代数式表示)。
、m的代数式表示)。
 (易潮解)是一种潜在的锂电池的电解质材料。某小组用粗锌(含少量
(易潮解)是一种潜在的锂电池的电解质材料。某小组用粗锌(含少量 和
和 )和稀硫酸反应制备
)和稀硫酸反应制备 ,利用纯化后的氢气还原硫酸锂制备硫化锂并对产品纯度进行分析。
,利用纯化后的氢气还原硫酸锂制备硫化锂并对产品纯度进行分析。请回答下列问题:

(1)利用上述装置制备
 ,按气流从左至右,装置的连接顺序是A→
,按气流从左至右,装置的连接顺序是A→(2)其他条件相同,粗锌与稀硫酸反应比纯锌
(3)探究
 产品的成分
产品的成分| 实验 | 操作与现象 | 结论 |
| Ⅰ | 取少量 样品,滴加足量稀盐酸,将气体通入品红溶液中,溶液褪色 样品,滴加足量稀盐酸,将气体通入品红溶液中,溶液褪色 | 样品含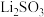 杂质 杂质 |
| Ⅱ | 在实验Ⅰ的溶液中滴加_______,产生白色沉淀 | 样品含 杂质 杂质 |
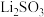 、
、 杂质的原因可能是
杂质的原因可能是(4)定量测定
 的含量
的含量①取
 g
g 样品加入
样品加入


 稀硫酸(过量)
稀硫酸(过量)②充分反应后,煮沸溶液以除去残留的酸性气体
③滴加酚酞溶液作指示剂,用

 标准
标准 溶液滴定过量的硫酸,消耗
溶液滴定过量的硫酸,消耗 溶液
溶液
 ,产品含
,产品含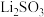 杂质,但不影响上述实验方案的科学性,理由是
杂质,但不影响上述实验方案的科学性,理由是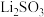 杂质含量为10%(质量分数),则
杂质含量为10%(质量分数),则 样品的纯度为
样品的纯度为 、
、 、
、 、
、 、m的代数式表示)。
、m的代数式表示)。
您最近一年使用:0次
解题方法
6 . 配平下列方程式
(1) ;
;________ 。
(2) ;
;________ 。
(1)
 ;
;(2)
 ;
;
您最近一年使用:0次
名校
解题方法
7 . 钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪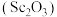 的一种流程如下:
的一种流程如下:
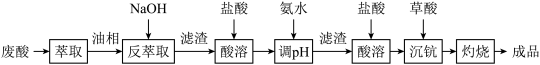
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是_______________________ 。
(2)常温下,先加入氨水调节 ,过滤,滤渣主要成分是
,过滤,滤渣主要成分是__________ ;再向滤液加入氨水调节 ,滤液中
,滤液中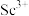 的浓度为
的浓度为__________ 。
{已知: 、
、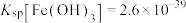 、
、 }
}
(3)用草酸“沉钪”,写出“沉钪”得到草酸钪的离子方程式:___________________________ 。
(4)草酸钪“灼烧”氧化的化学方程式为________________________________________________ 。
(5)废酸中含钪量为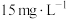 ,VL废酸最多可提取
,VL废酸最多可提取 的质量为
的质量为__________ 。
(6)镧与Sc同族位于第六周期,一种镧、锑形成的配合物结构如图所示:
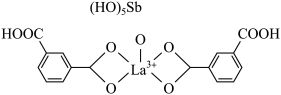
该结构中,中心离子 配位数为
配位数为__________ 。
(7)某铁、镧、锑的合金晶胞如图1,铁原子位于锑原子构成的正八面体的体心,晶胞的六个表面结构都如图2:
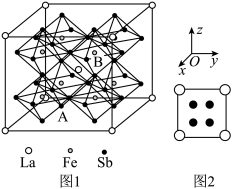
①若图中A点锑原子的坐标为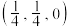 ,则B点铁原子的坐标为
,则B点铁原子的坐标为__________ 。
②若该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Sb原子与Sb原子的最近距离为
,则Sb原子与Sb原子的最近距离为__________ cm。
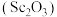 的一种流程如下:
的一种流程如下:
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是
(2)常温下,先加入氨水调节
 ,过滤,滤渣主要成分是
,过滤,滤渣主要成分是 ,滤液中
,滤液中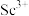 的浓度为
的浓度为{已知:
 、
、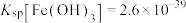 、
、 }
}(3)用草酸“沉钪”,写出“沉钪”得到草酸钪的离子方程式:
(4)草酸钪“灼烧”氧化的化学方程式为
(5)废酸中含钪量为
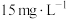 ,VL废酸最多可提取
,VL废酸最多可提取 的质量为
的质量为(6)镧与Sc同族位于第六周期,一种镧、锑形成的配合物结构如图所示:

该结构中,中心离子
 配位数为
配位数为(7)某铁、镧、锑的合金晶胞如图1,铁原子位于锑原子构成的正八面体的体心,晶胞的六个表面结构都如图2:

①若图中A点锑原子的坐标为
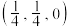 ,则B点铁原子的坐标为
,则B点铁原子的坐标为②若该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Sb原子与Sb原子的最近距离为
,则Sb原子与Sb原子的最近距离为
您最近一年使用:0次
2023-02-06更新
|
585次组卷
|
3卷引用:湖南省 衡阳市第一中学2023届高三第六次月考化学试题
名校
解题方法
8 . 将5.6g镁和铜的混合物加入到500mL1mol/L的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入2mol/LNaOH溶液至沉淀完全,生成沉淀的质量为10.7g,下列叙述错误的是
| A.当金属全部溶解时,电子转移的数目为0.3NA |
| B.混合物镁和铜的物质的量之比为1:2 |
| C.当金属全部溶解时,产生的NO气体的体积在标准状况下为2.24L |
| D.当生成的沉淀量达到最大时,消耗NaOH溶液的体积为200mL |
您最近一年使用:0次
2023-01-19更新
|
1641次组卷
|
3卷引用:四川省绵竹中学2022-2023学年高一下学期第一次月考化学试题
解题方法
9 . 中国自古有“信口雌黄”、“雄黄入药”之说。雌黄 和雄黄
和雄黄 都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。
都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。
(1)砷元素有 、
、 两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
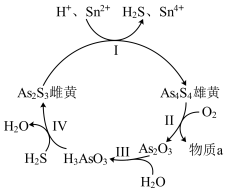
①I中氧化剂是________________________ (填化学式)。
②Ⅱ中若 反应,转移
反应,转移 ,写出Ⅱ的化学方程式:
,写出Ⅱ的化学方程式:____________ 。
(2)Ⅲ中产物亚砷酸 可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的
可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的 关系如图所示。
关系如图所示。
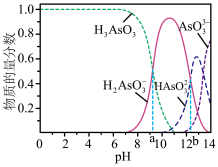
①人体血液的 在7.35~7.45之间,用药后人体中含砷元素的主要微粒是
在7.35~7.45之间,用药后人体中含砷元素的主要微粒是____________ (填化学式)。
②将 溶液滴入
溶液滴入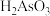 溶液,在溶液pH由8变至10的过程中,发生反应的离子方程式是
溶液,在溶液pH由8变至10的过程中,发生反应的离子方程式是____________ 。
(3)P与 属于同主族元素,亚磷酸二氢钾
属于同主族元素,亚磷酸二氢钾 是一种杀菌消毒剂。已知:常温下,
是一种杀菌消毒剂。已知:常温下, 的电离常数
的电离常数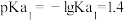 ;
;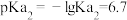 ;
; 。以
。以 和
和 为原料制备
为原料制备 和
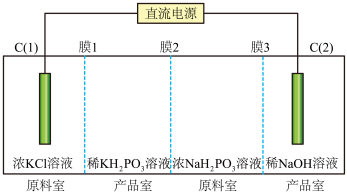
和 的装置如图。
的装置如图。
①已知 与足量的
与足量的 溶液反应生成
溶液反应生成 ,由此推知
,由此推知 是
是____________ (填“正”或“酸式”)盐。
②常温下 溶液
溶液
____________ 7(填“>”、“<”或“=”)。
③膜2为____________ (填“阴”或“阳”)离子交换膜, 电极上发生的电极反应式为:
电极上发生的电极反应式为:____ 。
 和雄黄
和雄黄 都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。
都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。(1)砷元素有
 、
、 两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
①I中氧化剂是
②Ⅱ中若
 反应,转移
反应,转移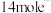 ,写出Ⅱ的化学方程式:
,写出Ⅱ的化学方程式:(2)Ⅲ中产物亚砷酸
 可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的
可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的 关系如图所示。
关系如图所示。
①人体血液的
 在7.35~7.45之间,用药后人体中含砷元素的主要微粒是
在7.35~7.45之间,用药后人体中含砷元素的主要微粒是②将
 溶液滴入
溶液滴入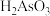 溶液,在溶液pH由8变至10的过程中,发生反应的离子方程式是
溶液,在溶液pH由8变至10的过程中,发生反应的离子方程式是(3)P与
 属于同主族元素,亚磷酸二氢钾
属于同主族元素,亚磷酸二氢钾 是一种杀菌消毒剂。已知:常温下,
是一种杀菌消毒剂。已知:常温下, 的电离常数
的电离常数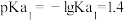 ;
;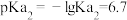 ;
; 。以
。以 和
和 为原料制备
为原料制备 和
和 的装置如图。
的装置如图。
①已知
 与足量的
与足量的 溶液反应生成
溶液反应生成 ,由此推知
,由此推知 是
是②常温下
 溶液
溶液
③膜2为
 电极上发生的电极反应式为:
电极上发生的电极反应式为:
您最近一年使用:0次
名校
10 . 化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可以减少该有害物质向环境排放。例如:
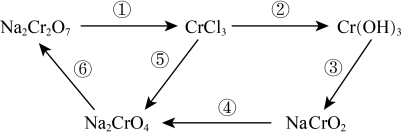
(1)Na2Cr2O7属于______ (填序号)。
①酸 ②碱 ③盐 ④氧化物
(2)在上述转化中,Cr元素化合价不变的步骤是_____ (填序号)。
(3)反应①为:Na2Cr2O7+HCl=NaCl+CrCl3+Cl2↑+H2O (未配平)。其中还原产物为_____ ,Na2Cr2O7与Cl2的反应系数比为_____ 。
(4)完成反应④的配平,并用单线桥 标出电子转移的方向和数目_____ 。(系数为1也请写出)
______ClO +______CrO
+______CrO +______
+______ =______Cl-+______CrO
=______Cl-+______CrO +______H2O
+______H2O

(1)Na2Cr2O7属于
①酸 ②碱 ③盐 ④氧化物
(2)在上述转化中,Cr元素化合价不变的步骤是
(3)反应①为:Na2Cr2O7+HCl=NaCl+CrCl3+Cl2↑+H2O (未配平)。其中还原产物为
(4)完成反应④的配平,并用
______ClO
 +______CrO
+______CrO +______
+______ =______Cl-+______CrO
=______Cl-+______CrO +______H2O
+______H2O
您最近一年使用:0次



