名校
1 . H2O2是一种常用绿色氧化剂。下列关于H2O2的说法正确的是
| A.H2O2是一种常用绿色氧化剂,所以H2O2只有氧化性 |
| B.H2O2能将I-氧化为I2,所以氧化性:I2>H2O2 |
| C.H2O2能作为绿色氧化剂,是由于其还原产物为O2 |
| D.H2O2中氧元素化合价为-1,所以H2O2既有氧化性又有还原性 |
您最近一年使用:0次
名校
2 . 按要求完成下列方程式
(1)用一种碱性氧化物和一种酸制备MgCl2,写出该制备反应的化学方程式___________ 。
(2)常温下以Fe、CuO、H2SO4三种物质为原料制备Cu的离子方程式___________ ,___________ 。
(3)用稀硫酸清洗青铜器表面的铜绿[Cu2(OH)2CO3],写出涉及的离子方程式___________ 。
(4)高温下铝粉与氧化铁的反应可用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢地焊接在一起。该反应的化学方程式为___________ 。
(5)工业废水中含有的Cr2O 有毒,必须处理达标后才能排放。工业上常用FeSO4·7H2O做处理剂将Cr2O
有毒,必须处理达标后才能排放。工业上常用FeSO4·7H2O做处理剂将Cr2O 还原为Cr3+,反应的离子方程式为
还原为Cr3+,反应的离子方程式为___________ 。
(6)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上通过碱性环境中次氯酸钠氧化三氯化铁制备高铁酸钠,制备过程的离子方程式为___________ 。
(1)用一种碱性氧化物和一种酸制备MgCl2,写出该制备反应的化学方程式
(2)常温下以Fe、CuO、H2SO4三种物质为原料制备Cu的离子方程式
(3)用稀硫酸清洗青铜器表面的铜绿[Cu2(OH)2CO3],写出涉及的离子方程式
(4)高温下铝粉与氧化铁的反应可用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢地焊接在一起。该反应的化学方程式为
(5)工业废水中含有的Cr2O
 有毒,必须处理达标后才能排放。工业上常用FeSO4·7H2O做处理剂将Cr2O
有毒,必须处理达标后才能排放。工业上常用FeSO4·7H2O做处理剂将Cr2O 还原为Cr3+,反应的离子方程式为
还原为Cr3+,反应的离子方程式为(6)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上通过碱性环境中次氯酸钠氧化三氯化铁制备高铁酸钠,制备过程的离子方程式为
您最近一年使用:0次
3 . ClO2是一种新型消毒剂,以下反应均能制得ClO2。
Ⅰ.2NaCl+6H2O 2ClO2↑+5H2↑+2NaOH
2ClO2↑+5H2↑+2NaOH
Ⅱ.5NaClO3+6HCl=6ClO2↑+3H2O+5NaCl
Ⅲ.Cl2+2NaClO2=2ClO2↑+2NaCl
(1)请表示反应Ⅰ中电子转移的方向和数目___________ 。
(2)由反应②可知,氧化性NaClO3____ ClO2;
(3)通过反应Ⅱ和Ⅲ分别制备标准状况下2.24LClO2,转移电子物质的量之比为___________ 。
(4)从氯元素利用率的角度分析,以上三种方法中,制备ClO2的最佳方法是___________ 。(填序号)
Ⅰ.2NaCl+6H2O
 2ClO2↑+5H2↑+2NaOH
2ClO2↑+5H2↑+2NaOHⅡ.5NaClO3+6HCl=6ClO2↑+3H2O+5NaCl
Ⅲ.Cl2+2NaClO2=2ClO2↑+2NaCl
(1)请表示反应Ⅰ中电子转移的方向和数目
(2)由反应②可知,氧化性NaClO3
(3)通过反应Ⅱ和Ⅲ分别制备标准状况下2.24LClO2,转移电子物质的量之比为
(4)从氯元素利用率的角度分析,以上三种方法中,制备ClO2的最佳方法是
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.写出下列反应的离子方程式:
(1)磁性氧化铁溶于稀盐酸:___________ 。
(2)用硫氰酸钾溶液检验待测液中的
___________ 。
(3)用酸性高锰酸钾溶液检验待测液中的
___________ 。
Ⅱ.根据信息配平下列反应的离子方程式
(4)将 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。请根据题中信息配平该反应的离子方程式:
无色)。请根据题中信息配平该反应的离子方程式:___________
___________ ___________
___________ ___________=___________
___________=___________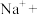 ___________
___________ ___________
___________ ___________
___________
(5) 虽然具有净水作用,但是腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
虽然具有净水作用,但是腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。完成
高效,且腐蚀性小。完成 氧化
氧化 的离子方程式:
的离子方程式:___________
___________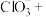 ___________
___________ ___________=___________
___________=___________ ___________
___________ ___________
___________
(1)磁性氧化铁溶于稀盐酸:
(2)用硫氰酸钾溶液检验待测液中的

(3)用酸性高锰酸钾溶液检验待测液中的

Ⅱ.根据信息配平下列反应的离子方程式
(4)将
 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。请根据题中信息配平该反应的离子方程式:
无色)。请根据题中信息配平该反应的离子方程式:___________
 ___________
___________ ___________=___________
___________=___________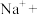 ___________
___________ ___________
___________ ___________
___________(5)
 虽然具有净水作用,但是腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
虽然具有净水作用,但是腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。完成
高效,且腐蚀性小。完成 氧化
氧化 的离子方程式:
的离子方程式:___________
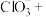 ___________
___________ ___________=___________
___________=___________ ___________
___________ ___________
___________
您最近一年使用:0次
解题方法
5 . 研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:
(1)在酸性条件下,可发生反应: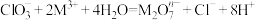 ,在该过程中
,在该过程中 被
被______ (填“氧化”或“还原”),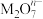 中M的化合价是
中M的化合价是______ 价。
(2)卫星发射时以N2H4(联氨)和N2O4为火箭的动力源,二者发生的反应为: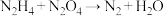 ,反应温度高达2700℃,回答下列问题。
,反应温度高达2700℃,回答下列问题。
①配平方程式:____________
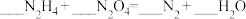
②氧化产物与还原产物的质量之比为______ 。
③用双线桥标出该反应电子转移的方向和数目_____ 。
(3)某同学设计如下实验研究H2O2的性质:
①从理论上分析H2O2具有还原性的原因____________________ 。
②能证明H2O2具有氧化性的实验是______ (填序号),写出该实验过程中发生反应的离子方程式____________________ 。
(1)在酸性条件下,可发生反应:
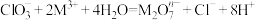 ,在该过程中
,在该过程中 被
被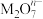 中M的化合价是
中M的化合价是(2)卫星发射时以N2H4(联氨)和N2O4为火箭的动力源,二者发生的反应为:
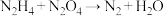 ,反应温度高达2700℃,回答下列问题。
,反应温度高达2700℃,回答下列问题。①配平方程式:
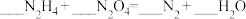
②氧化产物与还原产物的质量之比为
③用双线桥标出该反应电子转移的方向和数目
(3)某同学设计如下实验研究H2O2的性质:
序号 | 实验 | 实验现象 |
Ⅰ | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
Ⅱ | 向5%H2O2酸性溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
②能证明H2O2具有氧化性的实验是
您最近一年使用:0次
名校
6 . P元素有三种含氧酸:H3PO4、H3PO3、H3PO2,它们依次为三元、二元、一元弱酸。H3PO2可将溶液中的Ag+还原为Ag,从而可用于化学镀银。请回答下列问题:
(1)写出H3PO4与足量NaOH溶液反应的化学方程式:___________ 。
(2)H3PO3中,P元素的化合价为___________ ;H3PO2的电离方程式是___________ 。
(3)Na2HPO3、NaH2PO2均属于___________ 盐(填“酸式”、“碱式”、“正”)。
(4)用H3PO2进行化学镀银时,氧化剂与还原剂的粒子个数之比为 ,则氧化产物可能为下列选项中的
,则氧化产物可能为下列选项中的___________ (填字母序号)。
a.H3PO3 b.H3PO4 c.无法确定
据此,写出上述镀银反应的离子方程式:___________ 。
(1)写出H3PO4与足量NaOH溶液反应的化学方程式:
(2)H3PO3中,P元素的化合价为
(3)Na2HPO3、NaH2PO2均属于
(4)用H3PO2进行化学镀银时,氧化剂与还原剂的粒子个数之比为
 ,则氧化产物可能为下列选项中的
,则氧化产物可能为下列选项中的a.H3PO3 b.H3PO4 c.无法确定
据此,写出上述镀银反应的离子方程式:
您最近一年使用:0次
名校
解题方法
7 . 回答下列问题:
(1)①用双线桥法表示下列反应中电子转移的方向和数目:Cl2+SO2+2H2O=2HCl+H2SO4。___________
②在上述反应中,若反应消耗71.0 g Cl2,同时消耗标准状况下SO2的体积约为___________ L,转移电子的物质的量为___________ mol。
(2)二氧化氯是一种安全、高效的消毒剂,可以在极低的浓度下杀灭病菌。利用KClO3和浓盐酸在一定温度下可制备二氧化氯气体,同时产生黄绿色的气体。

①请写出上述反应的化学方程式并配平。___________
②若反应中转移的电子数为2NA个,则产生ClO2的物质的量为___________ 。
(1)①用双线桥法表示下列反应中电子转移的方向和数目:Cl2+SO2+2H2O=2HCl+H2SO4。
②在上述反应中,若反应消耗71.0 g Cl2,同时消耗标准状况下SO2的体积约为
(2)二氧化氯是一种安全、高效的消毒剂,可以在极低的浓度下杀灭病菌。利用KClO3和浓盐酸在一定温度下可制备二氧化氯气体,同时产生黄绿色的气体。

①请写出上述反应的化学方程式并配平。
②若反应中转移的电子数为2NA个,则产生ClO2的物质的量为
您最近一年使用:0次
解题方法
8 . 金属钛在医疗、航空、军工电子等领域使用非常广泛。以钛铁矿(主要成分为FeTiO3,还有Fe2O3、MgO、SiO2等杂质)为主要原料冶炼金属钛生产流程如图所示。
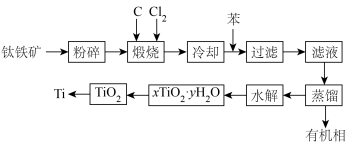
已知:
(1)煅烧过程中主要反应的化学方程式为___________ ,煅烧过程中发生的反应为吸热反应,该反应能够自发进行的原因是___________ 。
(2)“水解”发生的化学方程式为___________ 。
(3)在上述工艺流程中可以循环使用的物质是___________ 。
(4)测定产物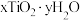 组成的方法如下:
组成的方法如下:
步骤一:取样品2.100g,在酸性条件下充分溶解,并用适量铝将 还原为
还原为 ,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用 的NH4Fe(SO4)2标准溶液滴定,将
的NH4Fe(SO4)2标准溶液滴定,将 氧化为
氧化为 。重复滴定2次。滴定所得相关数据如下表:
。重复滴定2次。滴定所得相关数据如下表:
①步骤一中用稀硫酸而不用水定容的原因是___________ 。
②通过计算确定该样品的组成为___________ 。
(5)从TiO2获得单质钛可以采用FFC-熔盐电脱氧法,具体流程为:将二氧化钛压制成型,经过预烧结,制备成电解体系的阴极,石墨作惰性阳极,以氯化钠、氯化钙为混合熔盐,在低于一定电压条件下电解,阴极生成金属钛。写出阴极的电极反应式___________ 。

已知:
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| TiCl4 | -25 | 136 | 溶于苯,遇水分解放热,放出有毒的腐蚀性烟气 |
| FeCl3 | 306 | 315 | 易溶于水,难溶于苯等有机物 |
| MgCl2 | 714 | 1412 | 易溶于水,难溶于苯等有机物 |
| SiCl4 | -70 | 57.6 | 溶于苯、四氯化碳等非极性溶剂,遇水剧烈反应 |
(1)煅烧过程中主要反应的化学方程式为
(2)“水解”发生的化学方程式为
(3)在上述工艺流程中可以循环使用的物质是
(4)测定产物
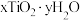 组成的方法如下:
组成的方法如下:步骤一:取样品2.100g,在酸性条件下充分溶解,并用适量铝将
 还原为
还原为 ,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用
 的NH4Fe(SO4)2标准溶液滴定,将
的NH4Fe(SO4)2标准溶液滴定,将 氧化为
氧化为 。重复滴定2次。滴定所得相关数据如下表:
。重复滴定2次。滴定所得相关数据如下表:| 滴定序号 | 待测液体积/mL | 滴定起点读数/mL | 滴定终点读数/mL |
| 1 | 25.00 | 0.02 | 24.02 |
| 2 | 25.00 | 0.08 | 24.06 |
| 3 | 25.00 | 0.12 | 24.14 |
②通过计算确定该样品的组成为
(5)从TiO2获得单质钛可以采用FFC-熔盐电脱氧法,具体流程为:将二氧化钛压制成型,经过预烧结,制备成电解体系的阴极,石墨作惰性阳极,以氯化钠、氯化钙为混合熔盐,在低于一定电压条件下电解,阴极生成金属钛。写出阴极的电极反应式
您最近一年使用:0次
解题方法
9 . 某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验,请回答下列问题:

(1)制备氯气的化学方程式为___________ 。
(2)淀粉—KI溶液中观察到的现象是___________ ,反应的化学方程式为___________ 。
(3)若干燥的有色布条不褪色,潮湿的有色布条褪色,则说明___________ 。
(4)工业上常用廉价的石灰乳吸收氯气制得漂白粉。漂白粉溶于水后,遇到空气中CO2的,即产生漂白、杀菌作用,用化学方程式表示漂白粉的漂白原理___________ 。
(5)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(b、c、d、e中重合部分代表物质间反应,且氯水足量)。

①a过程的化学方程式___________ 。
②d过程所观察到的现象为___________ ;c过程证明了氯水中存在的微粒是___________ 。
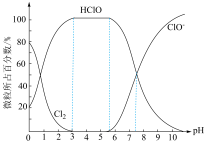
③已知25℃时,氯水中Cl2(溶于水的氯气分子)、HClO、ClO三种微粒所占百分数与pH的关系如图,则用Cl2处理饮用水时,溶液的pH最佳控制范围是___________ 。
(6)实验室制取Cl2还可采用KMnO4与浓盐酸混合,其原理为: ,试回答下列问题:
,试回答下列问题:
①请用双线桥表示反应中电子转移:___________ ;
②反应中氧化剂与还原剂的物质的量之比___________ ,在标准状况下,当生成11.2LCl2时,被氧化的HCl的物质的量为___________ 。

(1)制备氯气的化学方程式为
(2)淀粉—KI溶液中观察到的现象是
(3)若干燥的有色布条不褪色,潮湿的有色布条褪色,则说明
(4)工业上常用廉价的石灰乳吸收氯气制得漂白粉。漂白粉溶于水后,遇到空气中CO2的,即产生漂白、杀菌作用,用化学方程式表示漂白粉的漂白原理
(5)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(b、c、d、e中重合部分代表物质间反应,且氯水足量)。

①a过程的化学方程式
②d过程所观察到的现象为
③已知25℃时,氯水中Cl2(溶于水的氯气分子)、HClO、ClO三种微粒所占百分数与pH的关系如图,则用Cl2处理饮用水时,溶液的pH最佳控制范围是

(6)实验室制取Cl2还可采用KMnO4与浓盐酸混合,其原理为:
 ,试回答下列问题:
,试回答下列问题:①请用双线桥表示反应中电子转移:
②反应中氧化剂与还原剂的物质的量之比
您最近一年使用:0次
名校
解题方法
10 . 赤铁矿的主要成分为Fe2O3,为测定赤铁矿矿样中铁的百分含量,有如下两种预处理方法:
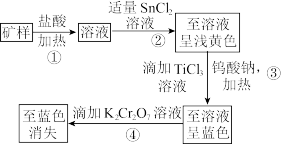
已知:①Sn、Hg、Ti在溶液中存在的形式有Sn2+、Sn4+、Hg2+、H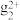 、Ti3+、TiO2+,且Sn2+能与K2Cr2O7反应,而Hg2+不能;氯化汞溶于水,氯化亚汞不溶于水(白色沉淀)。
、Ti3+、TiO2+,且Sn2+能与K2Cr2O7反应,而Hg2+不能;氯化汞溶于水,氯化亚汞不溶于水(白色沉淀)。
②钨酸钠(Na2WO4)可作指示剂,若W(Ⅵ)还原为W(Ⅴ),溶液将呈现蓝色。氧化性:Fe3+>W 。
。
(1)矿样与盐酸反应的主要化学方程式为___________ 。
(2)过程①发生反应的离子方程式为___________ ,过程②产生的沉淀是___________ (填化学式)。
(3)Na2WO4中W的化合价为___________ ,加入指示剂钨酸钠(Na2WO4)的作用是___________ 。
(4)现称取0.2 g矿样进行上述预处理后,加入H2SO4-H3PO4混酸溶液,以二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液滴定,消耗0.0100 mol·L-1的K2Cr2O7标准溶液20.00 mL。
①配平滴定时发生反应的离子方程式: Fe2++
Fe2++ Cr2
Cr2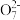 +
+ H+=
H+= Fe3++
Fe3++ Cr3++
Cr3++ H2O
H2O___________ 。
②原矿样中铁的百分含量为___________ ,若矿样预处理后溶液放置过久,对测定结果的影响是___________ (填“偏高”、“偏低”或“无影响”)。

已知:①Sn、Hg、Ti在溶液中存在的形式有Sn2+、Sn4+、Hg2+、H
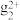 、Ti3+、TiO2+,且Sn2+能与K2Cr2O7反应,而Hg2+不能;氯化汞溶于水,氯化亚汞不溶于水(白色沉淀)。
、Ti3+、TiO2+,且Sn2+能与K2Cr2O7反应,而Hg2+不能;氯化汞溶于水,氯化亚汞不溶于水(白色沉淀)。②钨酸钠(Na2WO4)可作指示剂,若W(Ⅵ)还原为W(Ⅴ),溶液将呈现蓝色。氧化性:Fe3+>W
 。
。(1)矿样与盐酸反应的主要化学方程式为
(2)过程①发生反应的离子方程式为
(3)Na2WO4中W的化合价为
(4)现称取0.2 g矿样进行上述预处理后,加入H2SO4-H3PO4混酸溶液,以二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液滴定,消耗0.0100 mol·L-1的K2Cr2O7标准溶液20.00 mL。
①配平滴定时发生反应的离子方程式:
 Fe2++
Fe2++ Cr2
Cr2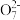 +
+ H+=
H+= Fe3++
Fe3++ Cr3++
Cr3++ H2O
H2O②原矿样中铁的百分含量为
您最近一年使用:0次



