解题方法
1 . 铁氰化钾[ ]由亚铁氰化钾[
]由亚铁氰化钾[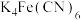 ]制得,请回答下列问题。
]制得,请回答下列问题。
Ⅰ.亚铁氰化钾的制取
以含NaCN电镀液为主要原料制备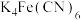 的流程如下:
的流程如下:
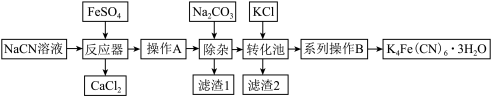
(1)常温下,HCN的电离常数 。实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,其操作的目的是
。实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,其操作的目的是_______ 。
(2)反应器加热至50℃,再慢慢加入加入 溶液,在80℃下维持反应30~40min,发生的反应方程式是
溶液,在80℃下维持反应30~40min,发生的反应方程式是_______ ,反应完成后再加入 溶液的作用是
溶液的作用是_______ 。
(3)转化池中发生复分解反应生成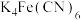 ,说明该反应能发生的理由
,说明该反应能发生的理由_______ 。
(4)系列操作B为_______ 。
Ⅱ.铁氰化钾的制取
(5)电解法:工业上,以石墨为电极,电解亚铁氰化钾溶液可以制备铁氰化钾,阳极的电极反应式为_______ 。
(6)氯氧化法:在氯气的作用下,在约60~65℃下将亚铁氰化钾热溶液氧化。当反应物料液的pH控制在6~7时,停止引入氯气,该步反应的方程式为_______ 。然后加入 饱和溶液(碱性下被还原为
饱和溶液(碱性下被还原为 )和未反应完的亚铁氰化钾继续反应,并用棕色硫酸铁铵检查反应是否完全,用盐酸调节料液的pH,使pH为7~8,该步反应的方程式为
)和未反应完的亚铁氰化钾继续反应,并用棕色硫酸铁铵检查反应是否完全,用盐酸调节料液的pH,使pH为7~8,该步反应的方程式为_______ 反应后,将料液沉淀,过滤并在溶液中真空经_______ (填提纯方法)得铁氰化钾成品。用这种方法可以提纯下列实验产品的是_______ (填序号)。
a.粗碘(含有少量沙粒) b.粗乙醇(含有少量水) c.粗苯甲酸(含有少量氯化钠)
 ]由亚铁氰化钾[
]由亚铁氰化钾[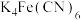 ]制得,请回答下列问题。
]制得,请回答下列问题。Ⅰ.亚铁氰化钾的制取
以含NaCN电镀液为主要原料制备
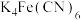 的流程如下:
的流程如下:
(1)常温下,HCN的电离常数
 。实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,其操作的目的是
。实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,其操作的目的是(2)反应器加热至50℃,再慢慢加入加入
 溶液,在80℃下维持反应30~40min,发生的反应方程式是
溶液,在80℃下维持反应30~40min,发生的反应方程式是 溶液的作用是
溶液的作用是(3)转化池中发生复分解反应生成
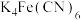 ,说明该反应能发生的理由
,说明该反应能发生的理由(4)系列操作B为
Ⅱ.铁氰化钾的制取
(5)电解法:工业上,以石墨为电极,电解亚铁氰化钾溶液可以制备铁氰化钾,阳极的电极反应式为
(6)氯氧化法:在氯气的作用下,在约60~65℃下将亚铁氰化钾热溶液氧化。当反应物料液的pH控制在6~7时,停止引入氯气,该步反应的方程式为
 饱和溶液(碱性下被还原为
饱和溶液(碱性下被还原为 )和未反应完的亚铁氰化钾继续反应,并用棕色硫酸铁铵检查反应是否完全,用盐酸调节料液的pH,使pH为7~8,该步反应的方程式为
)和未反应完的亚铁氰化钾继续反应,并用棕色硫酸铁铵检查反应是否完全,用盐酸调节料液的pH,使pH为7~8,该步反应的方程式为a.粗碘(含有少量沙粒) b.粗乙醇(含有少量水) c.粗苯甲酸(含有少量氯化钠)
您最近一年使用:0次
2 . 回答下列问题
(Ⅰ)自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:

(1)图2中的N对应图1中物质的化学式为_______ 。
(2)X与Z反应中氧化剂与还原剂的物质的量之比为_______ 。
(3) 溶液易被氧化,检验
溶液易被氧化,检验 溶液变质的试剂为
溶液变质的试剂为_______ 。
(4)铜和M的浓溶液反应生成Z的化学方程式为_______ ;若要证明该反应产物有 ,需要采取的操作是
,需要采取的操作是_______ 。
(Ⅱ)氮氧化物( )是大气污染物之一,处理
)是大气污染物之一,处理 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。
方案l:
(5)汽车排气管上装有催化转化器,可减少尾气对环境的污染,有害气体CO和NO反应可转化为无害气体排放,写出反应的化学方程式_______ 。
方案2:
在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
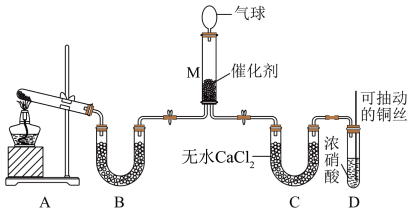
(6)用装置A制备 ,反应的化学方程式为
,反应的化学方程式为_______ ;装置B内的试剂是_______ 。
(7)装置D中发生反应的离子方程式是_______ ;可抽动铜丝的优点是_______ 。
(8)在装置M中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中 和
和 的物质的量之比为
的物质的量之比为_______ 。
方案3:
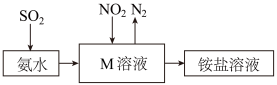
(9)工业生产中利用氨水吸收少量 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是_______ 。
(Ⅰ)自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:

(1)图2中的N对应图1中物质的化学式为
(2)X与Z反应中氧化剂与还原剂的物质的量之比为
(3)
 溶液易被氧化,检验
溶液易被氧化,检验 溶液变质的试剂为
溶液变质的试剂为(4)铜和M的浓溶液反应生成Z的化学方程式为
 ,需要采取的操作是
,需要采取的操作是(Ⅱ)氮氧化物(
 )是大气污染物之一,处理
)是大气污染物之一,处理 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。方案l:
(5)汽车排气管上装有催化转化器,可减少尾气对环境的污染,有害气体CO和NO反应可转化为无害气体排放,写出反应的化学方程式
方案2:
在一定条件下
 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
(6)用装置A制备
 ,反应的化学方程式为
,反应的化学方程式为(7)装置D中发生反应的离子方程式是
(8)在装置M中
 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中 和
和 的物质的量之比为
的物质的量之比为方案3:
(9)工业生产中利用氨水吸收少量
 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是
您最近一年使用:0次
解题方法
3 . 含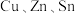 及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)写出基态 电子排布式
电子排布式___________ 。 与C均为第四主族元素,基态
与C均为第四主族元素,基态 原子的价电子中,两种自旋状态的电子数之比为
原子的价电子中,两种自旋状态的电子数之比为___________ 。
(2) 的空间结构名称为
的空间结构名称为___________ , 中心原子杂化方式为
中心原子杂化方式为___________ 。非金属性氧大于硫,能证明此关系成立的一种事实为___________ 。
(3) 的配位体是
的配位体是___________ , 形成配合物后
形成配合物后 键角会
键角会___________ (填“变大”、“变小”或“不变”),原因是成键电子对之间的排斥力___________ 孤电子对与成键电子对的排斥力(填“>”、“<”或“=”)。
(4)如图是硫的四种含氧酸根的结构:
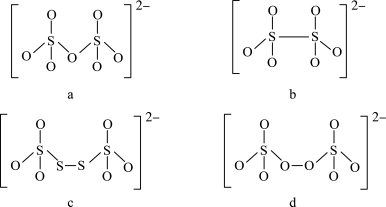
根据组成和结构推断,能在酸性溶液中将 转化为
转化为 的是
的是___________ (填序号),写出其离子反应方程式___________ 。
 及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:(1)写出基态
 电子排布式
电子排布式 与C均为第四主族元素,基态
与C均为第四主族元素,基态 原子的价电子中,两种自旋状态的电子数之比为
原子的价电子中,两种自旋状态的电子数之比为(2)
 的空间结构名称为
的空间结构名称为 中心原子杂化方式为
中心原子杂化方式为(3)
 的配位体是
的配位体是 形成配合物后
形成配合物后 键角会
键角会(4)如图是硫的四种含氧酸根的结构:

根据组成和结构推断,能在酸性溶液中将
 转化为
转化为 的是
的是
您最近一年使用:0次
解题方法
4 . 下列离子方程式书写不正确的是
A. 与稀硫酸混合: 与稀硫酸混合: |
B. 悬浊液中加入足量的 悬浊液中加入足量的 溶液: 溶液: |
C. 与稀硝酸反应: 与稀硝酸反应: |
D.用足量的氨水吸收烟气中的 : :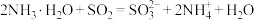 |
您最近一年使用:0次
名校
解题方法
5 . 海洋资源的利用具有广阔前景。
I.从海水中提取溴的工艺流程如图所示。

(1)步骤Ⅰ、步骤Ⅲ发生反应的离子反应方程式为_________ 、_______________ 。
(2)步骤Ⅱ通入热空气或水蒸气吹出 ,利用了溴的
,利用了溴的______________ (填性质)
(3)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:________________ 。
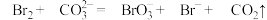
(4)步骤Ⅱ中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。若海水中溴含量约为65 从1000L海水中提取溴,理论上需要
从1000L海水中提取溴,理论上需要 的质量为
的质量为______________ 。
Ⅱ.海带中含有碘元素。实验室提取碘的步骤如下所示:
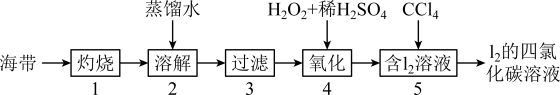
(5)灼烧海带至灰烬时会用到下列仪器中的______________ 。(填字母)
A.酒精灯 B.漏斗 C.坩埚 D.泥三角 E.烧杯
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤______________ (填序号)中实现与碘分离。
(7)写出步骤④反应的离子方程式________________ 。
I.从海水中提取溴的工艺流程如图所示。

(1)步骤Ⅰ、步骤Ⅲ发生反应的离子反应方程式为
(2)步骤Ⅱ通入热空气或水蒸气吹出
 ,利用了溴的
,利用了溴的(3)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
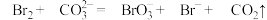
(4)步骤Ⅱ中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。若海水中溴含量约为65
 从1000L海水中提取溴,理论上需要
从1000L海水中提取溴,理论上需要 的质量为
的质量为Ⅱ.海带中含有碘元素。实验室提取碘的步骤如下所示:

(5)灼烧海带至灰烬时会用到下列仪器中的
A.酒精灯 B.漏斗 C.坩埚 D.泥三角 E.烧杯
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤
(7)写出步骤④反应的离子方程式
您最近一年使用:0次
名校
解题方法
6 . 一种用 溶液浸取黄铁矿(主要含
溶液浸取黄铁矿(主要含 ,还含有少量难溶性杂质)的流程如图所示。下列叙述错误的是
,还含有少量难溶性杂质)的流程如图所示。下列叙述错误的是

 溶液浸取黄铁矿(主要含
溶液浸取黄铁矿(主要含 ,还含有少量难溶性杂质)的流程如图所示。下列叙述错误的是
,还含有少量难溶性杂质)的流程如图所示。下列叙述错误的是
A.浸取时主要反应的离子方程式为: |
B.可以向操作后的溶液X中加入KSCN溶液,检验 是否反应完全 是否反应完全 |
C.溶液X经过一系列操作,可制得“绿矾晶体( ) ) |
D.实验室中可以利用 溶液和NaOH溶液混合制备 溶液和NaOH溶液混合制备 胶体 胶体 |
您最近一年使用:0次
2023-04-14更新
|
1089次组卷
|
4卷引用:化学-2023年高考押题预测卷02(天津卷)(含考试版、全解全析、参考答案、答题卡)
(已下线)化学-2023年高考押题预测卷02(天津卷)(含考试版、全解全析、参考答案、答题卡)辽宁省大连市2023届高三下学期一模化学试题(已下线)题型36 微型化工工艺流程甘肃省天水市第一中学 第三中学联考2023-2024学年高三上学期第三次月考 化学试题
7 . 亚氯酸钠( )是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出
)是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 ,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白,过氧化氢法制备
,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白,过氧化氢法制备 固体的实验装置如图所示:
固体的实验装置如图所示:
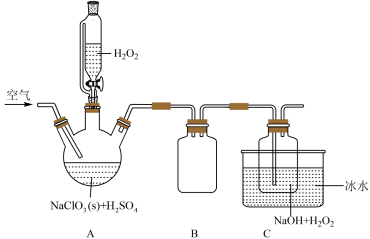
已知:
① 的熔点为
的熔点为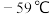 、沸点为
、沸点为 ,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、
,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、 、氮气等气体稀释时,爆炸性则降低。
、氮气等气体稀释时,爆炸性则降低。
②
请回答:
(1)A中盛放 的仪器名称为
的仪器名称为_________ ;按图组装好仪器后,首先应该进行的操作是_________ 。
(2)装置B的作用是_________ ;C装置使用冰水浴的目的_________ 。
(3) 是合成
是合成 的重要原料,写出三颈烧瓶中由
的重要原料,写出三颈烧瓶中由 生成
生成 的化学方程式:
的化学方程式:__________ 。
(4)装置C中加入 溶液的目的除了作反应物外,还因为
溶液的目的除了作反应物外,还因为__________________ 。
空气的流速过慢或过快都会影响 的产率,试分析原因:
的产率,试分析原因:_________ 。
(5)该套装置存在的明显缺陷是__________________ 。
(6)若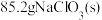 最终制得纯净的
最终制得纯净的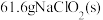 ,则
,则 的产率是
的产率是_________ (保留两位有效数字)。
 )是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出
)是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 ,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白,过氧化氢法制备
,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白,过氧化氢法制备 固体的实验装置如图所示:
固体的实验装置如图所示:
已知:
①
 的熔点为
的熔点为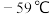 、沸点为
、沸点为 ,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、
,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、 、氮气等气体稀释时,爆炸性则降低。
、氮气等气体稀释时,爆炸性则降低。②

请回答:
(1)A中盛放
 的仪器名称为
的仪器名称为(2)装置B的作用是
(3)
 是合成
是合成 的重要原料,写出三颈烧瓶中由
的重要原料,写出三颈烧瓶中由 生成
生成 的化学方程式:
的化学方程式:(4)装置C中加入
 溶液的目的除了作反应物外,还因为
溶液的目的除了作反应物外,还因为空气的流速过慢或过快都会影响
 的产率,试分析原因:
的产率,试分析原因:(5)该套装置存在的明显缺陷是
(6)若
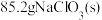 最终制得纯净的
最终制得纯净的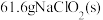 ,则
,则 的产率是
的产率是
您最近一年使用:0次
名校
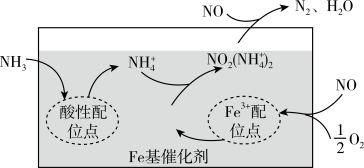
8 . 有氧条件下,在Fe基催化剂表面, 还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO,保护环境。下列说法
还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO,保护环境。下列说法不正确 的是
 还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO,保护环境。下列说法
还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO,保护环境。下列说法
A.在酸性配位点上, 与 与 通过配位键形成 通过配位键形成 |
B.增大压强有利于NO与 吸附在 吸附在 配位点上形成 配位点上形成 |
| C.在反应过程中,Fe基可以提高NO的转化率 |
D.该反应的总方程式为: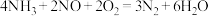 |
您最近一年使用:0次
2023-03-30更新
|
845次组卷
|
7卷引用:天津市南开区2023届高三下学期质量监测 ( 二 ) 化学试题
解题方法
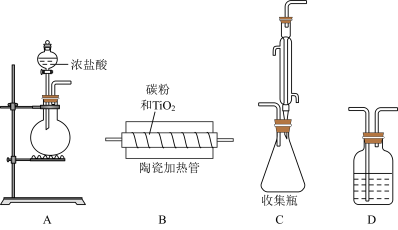
9 . 我国自主开发的“钛战甲”是一种钛合金材料,为深潜万米的“奋斗者”号建造了世界最大、搭载人数最多的潜水器载人舱球壳。TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去):
已知:
①TiO2+2C+2Cl2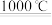 TiCl4+2CO
TiCl4+2CO
②TiCl4为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应
③PdCl2的盐酸溶液可吸收CO而生成黑色颗粒Pd
回答下列问题:
(1)盛放浓盐酸的仪器名称为______ ,圆底烧瓶内所装试剂可为______ (填编号)。
①MnO2 ②KMnO4 ③浓H2SO4
写出其中发生的离子反应方程式______ 。
(2)装置的连接顺序为______ (D装置可重复使用)。
(3)对于实验过程的控制,开始的操作为______ (填①或②),实验结束的操作为_____ (填③或④)。
①先打开分液漏斗活塞,一段时间后,再陶瓷管通电加热
②先陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
③先陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再陶瓷管断电停止加热
(4)装置C左边进气的细长导管作用为______ 。
(5)吸收尾气中CO的的化学方程式_____ 。
(6)所得的TiCl4可用Mg制Ti,该过程可在______ 气氛围保护下进行 (填编号) 。
①氮气 ②氧气 ③水蒸气 ④氩气

已知:
①TiO2+2C+2Cl2
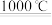 TiCl4+2CO
TiCl4+2CO②TiCl4为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应
③PdCl2的盐酸溶液可吸收CO而生成黑色颗粒Pd
回答下列问题:
(1)盛放浓盐酸的仪器名称为
①MnO2 ②KMnO4 ③浓H2SO4
写出其中发生的离子反应方程式
(2)装置的连接顺序为
(3)对于实验过程的控制,开始的操作为
①先打开分液漏斗活塞,一段时间后,再陶瓷管通电加热
②先陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
③先陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再陶瓷管断电停止加热
(4)装置C左边进气的细长导管作用为
(5)吸收尾气中CO的的化学方程式
(6)所得的TiCl4可用Mg制Ti,该过程可在
①氮气 ②氧气 ③水蒸气 ④氩气
您最近一年使用:0次
名校
10 . “环境就是民生,青山就是美丽,蓝天也是幸福。”拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以 和
和 的形式存在,向其中加强碱并加热可产生并收集
的形式存在,向其中加强碱并加热可产生并收集 。
。 在纯氧气中燃烧生成
在纯氧气中燃烧生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
②某团队设计处理氨氮废水的流程如下:
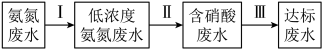
过程Ⅱ为硝化过程,在微生物的作用下实现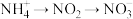 的转化,在碱性条件下,
的转化,在碱性条件下, 转化生成
转化生成 的过程中,
的过程中, 在反应中做
在反应中做_______ 剂;过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇( ),实现
),实现 的转化。将1 mol
的转化。将1 mol  完全转化为
完全转化为 转移的电子数为
转移的电子数为_______ 。
(2)硫酸生产及煤燃烧过程中产生的废气 等会对大气造成污染。
等会对大气造成污染。
①为防止工业上煤燃烧产生 ,常向燃煤中加入
,常向燃煤中加入 浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为
浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为_______ 。
②某兴趣小组对收集的酸雨样品进行了pH测定,随着时间的推移,得到以下数据(pH越小酸性越强)。
雨水pH变化的主要原因是_______ (用化学方程式表示)。
(1)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以
 和
和 的形式存在,向其中加强碱并加热可产生并收集
的形式存在,向其中加强碱并加热可产生并收集 。
。 在纯氧气中燃烧生成
在纯氧气中燃烧生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为②某团队设计处理氨氮废水的流程如下:

过程Ⅱ为硝化过程,在微生物的作用下实现
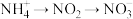 的转化,在碱性条件下,
的转化,在碱性条件下, 转化生成
转化生成 的过程中,
的过程中, 在反应中做
在反应中做 ),实现
),实现 的转化。将1 mol
的转化。将1 mol  完全转化为
完全转化为 转移的电子数为
转移的电子数为(2)硫酸生产及煤燃烧过程中产生的废气
 等会对大气造成污染。
等会对大气造成污染。①为防止工业上煤燃烧产生
 ,常向燃煤中加入
,常向燃煤中加入 浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为
浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为②某兴趣小组对收集的酸雨样品进行了pH测定,随着时间的推移,得到以下数据(pH越小酸性越强)。
| 时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| Ph | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
您最近一年使用:0次



