1 . 二氧化氯ClO2是一种黄绿色气体,在工业上常用作水处理剂、漂白剂。在处理废水时,ClO2可将废水中的CN-(其中C为+2价)氧化成CO2和N2,其离子方程式为xClO2+yCN-=2CO2+N2+2Cl-。下列说法错误 的是
| A.x=y=2 |
| B.氧化性:ClO2>CO2 |
| C.氧化产物与还原产物的个数比为3:2 |
| D.当生成1molN2分子时,转移6mol电子 |
您最近一年使用:0次
2024-01-18更新
|
132次组卷
|
3卷引用: 天津市武清区杨村第一中学2023-2024学年高一上学期第三次阶段检测化学试题
2 . 硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物和两种非金属氧化物。
(1)组装好实验装置后,要进行的下一步操作是___________ ;实验开始时通入氮气的目的是___________ 。
(2)B中实验现象证明分解产物中含有___________ (写化学式)。依据实验2硬质玻璃管中加热冷却后的固体性质确定分解产物有___________ (写化学式)。
(3)某同学欲通过下列实验验证分解产物中含有的另一种非金属氧化物。
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为
___________ 。___________ ,该现象体现了该物质的___________ 性。
③写出该条件下硫酸亚铁受热分解的化学方程式___________ 。
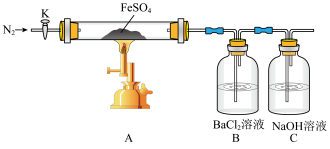
| 序号 | 操作步骤 | 实验现象 |
| 1 | 打开K,通入一段时间的 ,关闭活塞K,加热A中的玻璃管一段时间 ,关闭活塞K,加热A中的玻璃管一段时间 | B中产生大量白色沉淀 |
| 2 | A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到棕色固体物质 |
(2)B中实验现象证明分解产物中含有
(3)某同学欲通过下列实验验证分解产物中含有的另一种非金属氧化物。
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为


③写出该条件下硫酸亚铁受热分解的化学方程式
您最近一年使用:0次
3 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
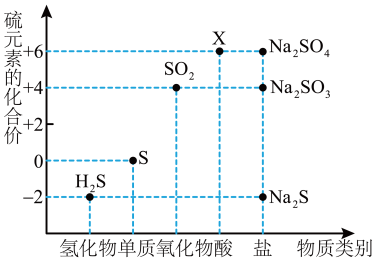
(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的___________ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(3)将 与
与 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为___________ 。
(4)配平下列反应_________________ 。
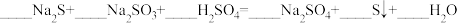
(5)一定条件下,在 密闭容器中发生反应:
密闭容器中发生反应: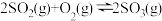 ,开始时加入
,开始时加入 、
、 、
、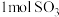 ,在
,在 末测得
末测得 的物质的量是
的物质的量是 ,用
,用 的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为___________ ,在 末
末 的浓度为
的浓度为___________ 。若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”)
①升高温度,化学反应速率___________ ;
②再充入 ,化学反应速率
,化学反应速率___________ ;
③将容器体积变为 ,化学反应速率
,化学反应速率___________ 。

(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将
 与
与 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为(4)配平下列反应
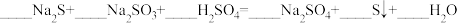
(5)一定条件下,在
 密闭容器中发生反应:
密闭容器中发生反应: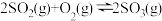 ,开始时加入
,开始时加入 、
、 、
、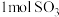 ,在
,在 末测得
末测得 的物质的量是
的物质的量是 ,用
,用 的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为 末
末 的浓度为
的浓度为①升高温度,化学反应速率
②再充入
 ,化学反应速率
,化学反应速率③将容器体积变为
 ,化学反应速率
,化学反应速率
您最近一年使用:0次
4 . 氮、硫的化合物与人类生活和生产有着密切的联系。
Ⅰ.氨既是一种重要的化工产品,又是一种重要的化工原料。图1为合成氨以及氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为_____ 氧化炉中发生反应的化学方程式为_____ 。
(2)A为_____ ;向吸收塔中通入A的作用_____ 。
(3)工业生产中为了盛装大量浓硝酸,可选择_____ (填字母)作为罐体材料。
a.铜 b.铂 c.铝 d.镁
Ⅱ.浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如图2所示的实验。请据此回答下列问题:
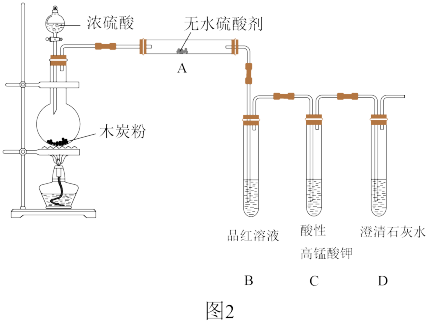
(4)浓硫酸与木炭反应的化学方程式:_____ 。
(5)装置B中的现象_____ ;证明产物中有_____ 。
(6)装置C的作用是_____ 。
Ⅰ.氨既是一种重要的化工产品,又是一种重要的化工原料。图1为合成氨以及氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为
(2)A为
(3)工业生产中为了盛装大量浓硝酸,可选择
a.铜 b.铂 c.铝 d.镁
Ⅱ.浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如图2所示的实验。请据此回答下列问题:

(4)浓硫酸与木炭反应的化学方程式:
(5)装置B中的现象
(6)装置C的作用是
您最近一年使用:0次
5 .  (主要指NO和
(主要指NO和 )是大气主要污染物之一,有效去除大气中的
)是大气主要污染物之一,有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。
(1)可以利用 与
与 反应消除
反应消除 。新型催化剂M能催化
。新型催化剂M能催化 与
与 反应生成
反应生成 。写出该反应的化学方程式
。写出该反应的化学方程式___________ ,该反应氧化产物和还原产物的物质的量之比为___________ 。
(2)某兴趣小组拟用甲烷与NO的反应设计成原电池对NO进行无污染处理,装置如图所示,
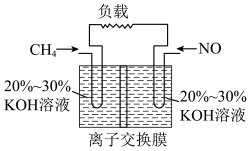
①甲烷的空间结构为___________ 。
②该装置的能量转化为___________ 。
③补齐负极的反应式: :
:___________ 。
(3)一种新型催化剂能使NO和CO发生反应: 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时, 随温度(T)和时间(t)的变化曲线如图所示。
随温度(T)和时间(t)的变化曲线如图所示。
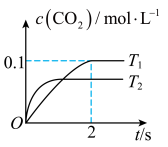
①温度
________  (填“大于、小于、等于”)
(填“大于、小于、等于”)
②在 温度下,0~2s内的平均反应速率
温度下,0~2s内的平均反应速率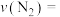
___________ 。
③在容积固定的恒温容器中,不能说明该反应已达到平衡状态的是___________ (填字母)。
A.混合气体的平均摩尔质量不再变化 B.容器内的气体压强保持不变
C.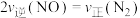 D.容器内混合气体的密度保持不变
D.容器内混合气体的密度保持不变
 (主要指NO和
(主要指NO和 )是大气主要污染物之一,有效去除大气中的
)是大气主要污染物之一,有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。(1)可以利用
 与
与 反应消除
反应消除 。新型催化剂M能催化
。新型催化剂M能催化 与
与 反应生成
反应生成 。写出该反应的化学方程式
。写出该反应的化学方程式(2)某兴趣小组拟用甲烷与NO的反应设计成原电池对NO进行无污染处理,装置如图所示,

①甲烷的空间结构为
②该装置的能量转化为
③补齐负极的反应式:
 :
:(3)一种新型催化剂能使NO和CO发生反应:
 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时, 随温度(T)和时间(t)的变化曲线如图所示。
随温度(T)和时间(t)的变化曲线如图所示。
①温度

 (填“大于、小于、等于”)
(填“大于、小于、等于”)②在
 温度下,0~2s内的平均反应速率
温度下,0~2s内的平均反应速率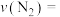
③在容积固定的恒温容器中,不能说明该反应已达到平衡状态的是
A.混合气体的平均摩尔质量不再变化 B.容器内的气体压强保持不变
C.
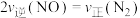 D.容器内混合气体的密度保持不变
D.容器内混合气体的密度保持不变
您最近一年使用:0次
名校
解题方法
6 . 烟气中常含有大量SO2和H2S等大气污染物,需经过净化处理后才能排放。
(1)除去燃煤产生的废气中的SO2的过程如图所示。

①过程I是 发生催化氧化反应,若参加反应
发生催化氧化反应,若参加反应 和
和 的体积比为4:3,则反应的化学方程式为
的体积比为4:3,则反应的化学方程式为_________ 。
②过程Ⅱ利用电化学装置吸收另一部分 ,使得Cu再生,该过程中阳极的电极反应式为
,使得Cu再生,该过程中阳极的电极反应式为____________ 。若此过程中除去 体积分数为0.5%的废气2240L(标准状况),可使
体积分数为0.5%的废气2240L(标准状况),可使________ g Cu再生。
(2)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺为:

① 时,I中为
时,I中为_________ 溶液(写化学式)。
②工艺中加入 固体,并再次充入
固体,并再次充入 的目的是
的目的是______________ 。
(3)较普遍采用H2S处理方法为克劳斯工艺,反应原理可表示为: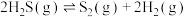 。在1470K、100kPa反应条件下,将
。在1470K、100kPa反应条件下,将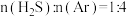 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为___________ ,平衡常数
___________ kPa。
(1)除去燃煤产生的废气中的SO2的过程如图所示。

①过程I是
 发生催化氧化反应,若参加反应
发生催化氧化反应,若参加反应 和
和 的体积比为4:3,则反应的化学方程式为
的体积比为4:3,则反应的化学方程式为②过程Ⅱ利用电化学装置吸收另一部分
 ,使得Cu再生,该过程中阳极的电极反应式为
,使得Cu再生,该过程中阳极的电极反应式为 体积分数为0.5%的废气2240L(标准状况),可使
体积分数为0.5%的废气2240L(标准状况),可使(2)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺为:

①
 时,I中为
时,I中为②工艺中加入
 固体,并再次充入
固体,并再次充入 的目的是
的目的是(3)较普遍采用H2S处理方法为克劳斯工艺,反应原理可表示为:
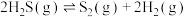 。在1470K、100kPa反应条件下,将
。在1470K、100kPa反应条件下,将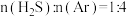 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为
您最近一年使用:0次
名校
解题方法
7 . 浩瀚的海洋中蕴藏着丰富的资源。从海水中可以提取很多有用的物质。
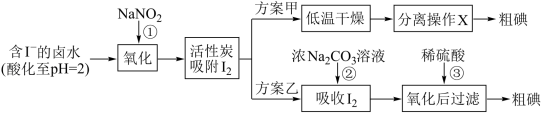
Ⅰ.提溴工业。用海水晒盐之后的盐卤可提取溴,提取流程如图:
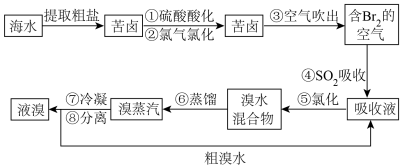
(1)用热空气能将溴单质吹出的原因是___________ 。
(2)写出④发生反应的化学方程式___________ 。
(3)已知某溶液中 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比为变为4:3:2,那么通入
的物质的量之比为变为4:3:2,那么通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的___________ 。
Ⅱ.提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:
资料显示:
ⅰ.pH=2时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO
,同时生成NO
ⅱ.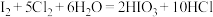 ;氧化性:
;氧化性: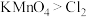
ⅲ.
(4)请列举除蒸馏法外海水淡化的一种方法:___________ 。
(5)写出反应①的离子方程式___________ 。
(6)方案甲中,根据 的特性,分离操作X应为
的特性,分离操作X应为___________ 、冷凝结晶。
(7) 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是___________ 。
(8)方案乙中,已知反应③过滤后,滤液中仍存在少量的 、
、 。为了检验滤液中的
。为了检验滤液中的 ,某小组同学设计如下实验方案,请将实验步骤补充完整。
,某小组同学设计如下实验方案,请将实验步骤补充完整。
实验中可供选择的试剂:稀 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。
a.将滤液用 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
b.从水层取少量溶液于试管中,___________ 。
Ⅰ.提溴工业。用海水晒盐之后的盐卤可提取溴,提取流程如图:

(1)用热空气能将溴单质吹出的原因是
(2)写出④发生反应的化学方程式
(3)已知某溶液中
 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比为变为4:3:2,那么通入
的物质的量之比为变为4:3:2,那么通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的Ⅱ.提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
ⅰ.pH=2时,
 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO
,同时生成NOⅱ.
 ;氧化性:
;氧化性: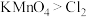
ⅲ.

(4)请列举除蒸馏法外海水淡化的一种方法:
(5)写出反应①的离子方程式
(6)方案甲中,根据
 的特性,分离操作X应为
的特性,分离操作X应为(7)
 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是(8)方案乙中,已知反应③过滤后,滤液中仍存在少量的
 、
、 。为了检验滤液中的
。为了检验滤液中的 ,某小组同学设计如下实验方案,请将实验步骤补充完整。
,某小组同学设计如下实验方案,请将实验步骤补充完整。实验中可供选择的试剂:稀
 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。a.将滤液用
 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,b.从水层取少量溶液于试管中,
您最近一年使用:0次
2023-05-25更新
|
407次组卷
|
2卷引用:天津市第一中学2022—2023学年高一下学期第二次月考化学试题
名校
解题方法
8 . 下列叙述对应的离子方程式正确的是
A.向饱和NaOH溶液通入过量 析出白色晶体: 析出白色晶体: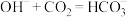 |
B.白色沉淀CuCl溶于 - - 溶液得到深蓝色溶液: 溶液得到深蓝色溶液:  |
C.向 溶液中滴入酸化的 溶液中滴入酸化的 溶液产生白色沉淀: 溶液产生白色沉淀: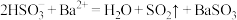 |
D.向 溶液中滴入 溶液中滴入 溶液产生黑色沉淀和气泡: 溶液产生黑色沉淀和气泡:  |
您最近一年使用:0次
2023-05-24更新
|
2422次组卷
|
10卷引用:T2-离子反应
(已下线)T2-离子反应湖南省部分名校联盟2023届高三5月冲刺压轴大联考化学试题(已下线)专题04 离子方程式与离子共存-2023年高考化学真题题源解密(新高考专用)化学02(15+4模式)2024年1月“九省联考”考前化学猜想卷湖南省衡阳市第八中学2023-2024学年高三上学期1月月考化学(已下线)热点03 离子方程式的正误判断、离子共存江西省宜春市丰城市第九中学2023-2024学年高三上学期期末考试化学试题2024届湖南省长沙市第一中高三下学期高考适应性演练(一)化学试题江西省宜春市上高县2023-2024学年高三下学期5月月考化学试题2024届湖北省荆州中学高三下学期第三次适应性考试化学试卷
名校
9 . I.已知氯化钠的晶胞如图所示。

(1)下列关于氯化钠的说法正确的是_____ 。
(2)已知NaCl的密度为ρg•cm-3,NaCl的摩尔质量为Mg/mol,阿佛加德罗常数的值为NA,则在NaCl晶体里Na+和Cl-的最短距离为_____ pm。
Ⅱ.过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。
已知:H2O2(l) H+(aq)+
H+(aq)+ (aq) K=2.24×10-12(25℃)
(aq) K=2.24×10-12(25℃)
完成下列填空:
(3)氧原子核外电子能级数为_____ ,H2O2的电子式_____ 。
对H2O2分子结构,有以下两种推测:
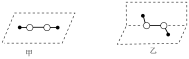
要确定H2O2分子结构,需要测定H2O2分子中的_____ 。(选填序号)
a.H-O键长 b.O-O键长 c.H-O-O键角 d.H-O、O-O键能
(4)25℃,pH(H2O2)_____ pH(H2O)(选填“>”、“<”或“=”)。研究表明,H2O2溶液中HO 浓度越大,H2O2的分解速率越快。某温度下,经过相同时间,不同浓度H2O2分解率与pH的关系如图所示。一定浓度的H2O2,pH增大H2O2分解率增大的原因是
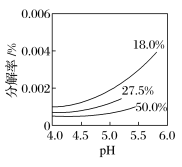
浓度越大,H2O2的分解速率越快。某温度下,经过相同时间,不同浓度H2O2分解率与pH的关系如图所示。一定浓度的H2O2,pH增大H2O2分解率增大的原因是_____ 。相同pH下,H2O2浓度越大H2O2分解率越低的原因是_____ 。
(5)蓝色的CrO5遇H2O2会褪色,此反应可用于检验H2O2,配平下列方程式:_____ 。
_____CrO5+_____H2O2+_____H+=_____Cr3++_____O2↑+_____H2O。

(1)下列关于氯化钠的说法正确的是
| A.基态Na+的电子有5种空间运动状态 |
| B.钠是第一电离能最大的碱金属元素 |
| C.氯原子的价电子排布式可写成[Ne]3s23p5 |
| D.每个氯离子周围与它最近且等距的氯离子有12个 |
Ⅱ.过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。
已知:H2O2(l)
 H+(aq)+
H+(aq)+ (aq) K=2.24×10-12(25℃)
(aq) K=2.24×10-12(25℃)完成下列填空:
(3)氧原子核外电子能级数为
对H2O2分子结构,有以下两种推测:
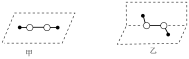
要确定H2O2分子结构,需要测定H2O2分子中的
a.H-O键长 b.O-O键长 c.H-O-O键角 d.H-O、O-O键能
(4)25℃,pH(H2O2)
 浓度越大,H2O2的分解速率越快。某温度下,经过相同时间,不同浓度H2O2分解率与pH的关系如图所示。一定浓度的H2O2,pH增大H2O2分解率增大的原因是
浓度越大,H2O2的分解速率越快。某温度下,经过相同时间,不同浓度H2O2分解率与pH的关系如图所示。一定浓度的H2O2,pH增大H2O2分解率增大的原因是
(5)蓝色的CrO5遇H2O2会褪色,此反应可用于检验H2O2,配平下列方程式:
_____CrO5+_____H2O2+_____H+=_____Cr3++_____O2↑+_____H2O。
您最近一年使用:0次
名校
解题方法
10 . 无机非金属元素在化工生产中扮演着重要的角色,请利用相关知识回答下列问题:
(1)硅单质可作为硅半导体材料,三氯硅烷( )还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: ;ii.三氯硅烷易被氧化。
;ii.三氯硅烷易被氧化。
①硅在周期表中的位置是___________ 。
②工业上原料石英砂常用 溶液浸泡除杂,实验室检验溶液中存在
溶液浸泡除杂,实验室检验溶液中存在 的操作与现象为
的操作与现象为___________ 。
③写出制粗硅的化学方程式___________ 。
④整个制备过程必须严格控制无水无氧。 遇水剧烈反应生成
遇水剧烈反应生成 、
、 和一种气体单质,该气体单质是
和一种气体单质,该气体单质是___________ (填名称);在制备高纯硅的过程中若混入 ,可能引起的后果是
,可能引起的后果是___________ 。
⑤用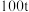 含二氧化硅
含二氧化硅 的石英矿,整个制备提纯过程硅元素损失了
的石英矿,整个制备提纯过程硅元素损失了 ,最终获得高纯硅的质量为
,最终获得高纯硅的质量为___________ t(结果精确到小数点后两位)。
(2)瓷器成分大多为硅酸盐,如蓝紫色的硅酸铜钡(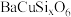 ,铜为
,铜为 价),下列说法正确的是___________。
价),下列说法正确的是___________。
(3)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是___________(填序号)。
(1)硅单质可作为硅半导体材料,三氯硅烷(
 )还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
 ;ii.三氯硅烷易被氧化。
;ii.三氯硅烷易被氧化。①硅在周期表中的位置是
②工业上原料石英砂常用
 溶液浸泡除杂,实验室检验溶液中存在
溶液浸泡除杂,实验室检验溶液中存在 的操作与现象为
的操作与现象为③写出制粗硅的化学方程式
④整个制备过程必须严格控制无水无氧。
 遇水剧烈反应生成
遇水剧烈反应生成 、
、 和一种气体单质,该气体单质是
和一种气体单质,该气体单质是 ,可能引起的后果是
,可能引起的后果是⑤用
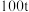 含二氧化硅
含二氧化硅 的石英矿,整个制备提纯过程硅元素损失了
的石英矿,整个制备提纯过程硅元素损失了 ,最终获得高纯硅的质量为
,最终获得高纯硅的质量为(2)瓷器成分大多为硅酸盐,如蓝紫色的硅酸铜钡(
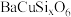 ,铜为
,铜为 价),下列说法正确的是___________。
价),下列说法正确的是___________。A. | B.可用氧化物形式表示为  |
| C.硅酸铜钡易溶于强酸和强碱 | D.唐宋时期,我国的瓷器已享誉海内外 |
| A.压电陶瓷 | B.高温结构陶瓷 | C.生物陶瓷 | D.超导陶瓷 |
您最近一年使用:0次
2023-05-03更新
|
207次组卷
|
2卷引用:天津市第五十四中学2023-2024学年高一下学期期中考试化学试卷



