名校
解题方法
1 . 某校化学兴趣小组探究 与
与 溶液的反应,装置如图所示。
溶液的反应,装置如图所示。
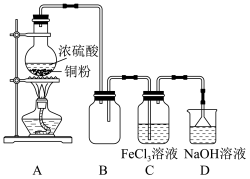
(1)①A装置中制备 的化学方程式为
的化学方程式为_______ ;②装置B的作用_______ 。
(2)该小组同学预测 与
与 溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:
溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:_______ (用离子方程式表示)。
(3)该小组探究实验的具体步骤如下:
根据步骤Ⅰ、Ⅱ、Ⅲ的现象,该小组学查阅资料获知:
ⅰ.生成红棕色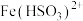 离子的反应为:
离子的反应为:
ⅱ.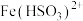 离子可以将
离子可以将 还原为
还原为
③溶液中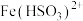 与
与 反应的离子方程式为
反应的离子方程式为_______
④由上述实验可知 与
与 溶液反应生成
溶液反应生成 所需时间较长,缩短该反应所用时间可以采取的措施
所需时间较长,缩短该反应所用时间可以采取的措施_______ (任写两条)
 与
与 溶液的反应,装置如图所示。
溶液的反应,装置如图所示。
(1)①A装置中制备
 的化学方程式为
的化学方程式为(2)该小组同学预测
 与
与 溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:
溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:(3)该小组探究实验的具体步骤如下:
| 步骤 | 现象 | 结论 |
Ⅰ。取   溶液于装置C中,并连接好装置,通入 溶液于装置C中,并连接好装置,通入 至饱和。 至饱和。 | 溶液很快由黄色变为红棕色。 | |
| Ⅱ.用激光笔照射步骤Ⅰ中的红棕色溶液。 | 溶液中无明显光路。 | ①红棕色溶液不是 |
| Ⅲ.将步骤Ⅰ中的溶液静置。 | 1小时后,溶液逐渐变为浅绿色。 | ②溶液中有 |
ⅰ.生成红棕色
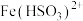 离子的反应为:
离子的反应为:
ⅱ.
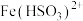 离子可以将
离子可以将 还原为
还原为
③溶液中
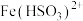 与
与 反应的离子方程式为
反应的离子方程式为④由上述实验可知
 与
与 溶液反应生成
溶液反应生成 所需时间较长,缩短该反应所用时间可以采取的措施
所需时间较长,缩短该反应所用时间可以采取的措施
您最近一年使用:0次
2022-04-04更新
|
586次组卷
|
4卷引用:三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)
(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)陕西省咸阳市武功县普集高级中学2021-2022学年高三上学期期末考试化学试题(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)辽宁省渤海大学附属高级中学2021-2022学年高一下学期第二次阶段性考试化学试题
名校
解题方法
2 . 催化剂二价铜微粒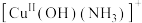 可用于汽车尾气脱硝,催化机理如图所示。下列说法正确的是
可用于汽车尾气脱硝,催化机理如图所示。下列说法正确的是
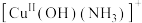 可用于汽车尾气脱硝,催化机理如图所示。下列说法正确的是
可用于汽车尾气脱硝,催化机理如图所示。下列说法正确的是
A.基态铜原子的核外电子排布式为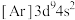 |
B.1mol 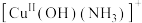 中含有4mol σ键 中含有4mol σ键 |
| C.状态②到状态⑤过程中,均发生了电子转移 |
D.该脱硝过程的总反应方程式为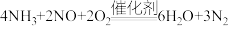 |
您最近一年使用:0次
2022-03-09更新
|
292次组卷
|
2卷引用:天津市南开中学2024届高三下学期第五次月检测化学试卷
名校
解题方法
3 . 已知Mn2O 与S2-在酸性溶液中能发生反应: Mn2O
与S2-在酸性溶液中能发生反应: Mn2O +3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O
+3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O 中锰元素的化合价是
中锰元素的化合价是
 与S2-在酸性溶液中能发生反应: Mn2O
与S2-在酸性溶液中能发生反应: Mn2O +3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O
+3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O 中锰元素的化合价是
中锰元素的化合价是| A.+2 | B.+4 | C.+3 | D.+6 |
您最近一年使用:0次
2022-02-28更新
|
875次组卷
|
36卷引用:天津市滨海新区2020-2021学年高一上学期期末考试化学试题
天津市滨海新区2020-2021学年高一上学期期末考试化学试题天津市宁河区2023-2024学年高一上学期期末考试化学试题河南省安阳市第三十六中学2017-2018学年高一上学期期中考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期开学考试化学试题夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用广东省2020年普通高中学业水平考试化学合格性考试模拟试题(七)陕西省汉中市龙岗学校2019-2020学年高一上学期期末考试化学试题(已下线)【南昌新东方】江西省九江一中2013-2014学年高一上学期期中考试化学试题广东省珠海市第二中学2019-2020学年高一上学期期中考试化学试题广东省中山纪念中学2019-2020学年高一上学期第二次段考化学试题山东省济宁市邹城兖矿一中2020-2021学年度高一9月月考化学试题吉林公主岭范家屯一中2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】30湖南省岳阳市楚雄中学2020-2021学年高一上学期期中考试化学试题广东省湛江市第四中学2020-2021学年高一上学期期中考试化学试题北京市铁路第二中学2020-2021学年高一上学期期中考试化学试题(已下线)【南昌新东方】9. 2020 高一上 铁路一中 刘惠文 钟欣(已下线)【浙江新东方】双师 (55)宁夏青铜峡市高级中学2020-2021学年高一12月月考化学试题河北衡水市第十四中学2020-2021学年高一上学期三调考试化学试题河北省衡水市武邑武罗学校2020-2021学年高一上学期期中考试化学试题新疆巴音郭楞蒙古自治州第二中学2021届高三上学期第一次摸底考试化学试题河北省衡水市武强中学2020-2021学年高一上学期第一次月考化学试题云南省玉溪市江川区第二中学2020-2021学年高一下学期竞赛化学试题黑龙江省鸡西市第一中学2020-2021学年高一上学期第一次月考化学试题四川省成都市第七中学2021-2022学年高一上学期期中考试化学试题四川省攀枝花市第十五中学校2021-2022学年高一上学期期中考试化学试题安徽省安庆市第十中学2021-2022学年高一上学期10月月考化学试题江苏省宿迁市泗阳县实验高级中学2021-2022学年高一上学期第二次调研测试化学试题广东省梅州市兴宁市叶塘中学2021-2022学年高一上学期摸底考试化学试题浙江省绿谷联盟2022-2023学年高一上学期10月份考试化学试题 黑龙江省鹤岗市第一中学2022-2023学年高一上学期10月月考化学试题山西省晋城市第一中学校2022-2023学年高一上学期第二次调研考试化学试题四川省仁寿县铧强中学2021-2022学年高一上学期半期考试化学试题云南省昆明市第八中学2020-2021学年高一上学期期中考试化学试题(已下线)专题七 氧化还原反应
名校
4 . 下列有关Fe3+、Fe2+的性质及应用的说法正确的是
①向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液,黄色逐渐消失,加KSCN后溶液颜色不变
②将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
③向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
④将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
⑤向Fe2(SO4)3溶液中加入过量铁粉的离子方程式:Fe3++Fe=2Fe2+
⑥Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
①向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液,黄色逐渐消失,加KSCN后溶液颜色不变
②将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
③向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
④将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
⑤向Fe2(SO4)3溶液中加入过量铁粉的离子方程式:Fe3++Fe=2Fe2+
⑥Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
| A.①②⑥ | B.①②③ | C.①④⑤ | D.②④⑥ |
您最近一年使用:0次
2021-12-18更新
|
4243次组卷
|
10卷引用:天津市南开区崇化中学2022-2023学年高一上学期期末质量检测化学试题
天津市南开区崇化中学2022-2023学年高一上学期期末质量检测化学试题吉林省洮南市第一中学2021-2022学年高一上学期第三次月考化学试题山东省济南第三中学2022-2023学年高一上学期12月月考化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期12月月考化学试题江西省景德镇一中2022-2023学年高一上学期期中考试(19班)化学试题江西省南昌市豫章中学20212-2022学年高一下学期第一次月考化学试题广东省汕尾华大实验学校2022-2023学年高一上学期12月月考化学试题新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题新疆乌鲁木齐市高级中学2023-2024学年高一上学期1月期末化学试题山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题
名校
5 . 工业上利用废铁屑(含少量氧化铝、铁的氧化物等)生产碱式硫酸铁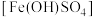 的工艺流程如下:
的工艺流程如下:
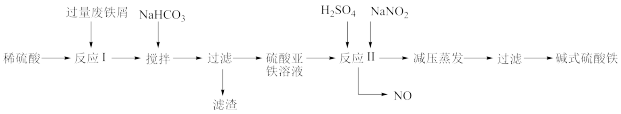
已知:部分阳离子以氢氧化物形式沉淀时溶液的 见下
见下
回答下列问题:
(1)用稀硫酸浸废铁屑后,溶液中存在的阳离子主要有___________
(2)写出酸浸过程中 发生反应的离子方程式
发生反应的离子方程式___________ 。检验有 生成的试剂
生成的试剂___________ ,现象:___________ 。
(3)加入少量 的目的是调节
的目的是调节 在范围内,写出用
在范围内,写出用 调整浓溶液
调整浓溶液 时的离子方程式是
时的离子方程式是___________ 。
(4)反应Ⅱ中加入 的目的是氧化
的目的是氧化 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
(5)碱式硫酸铁溶于水后生成的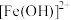 离子可部分水解生成
离子可部分水解生成 聚合离子,该水解反应的离子方程式为
聚合离子,该水解反应的离子方程式为___________ 。
(6)为测定 和
和 溶液中铁元素的总含量,实验操作如下:
溶液中铁元素的总含量,实验操作如下:
①准确量取 溶液于带塞锥形瓶中,加入足量
溶液于带塞锥形瓶中,加入足量 ,调节
,调节 ;
;
②加热除去过量 ;
;
③加入过量 充分反应后,再用
充分反应后,再用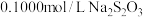 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 。
。
已知:
则溶液中铁元素的总含量为___________ 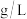 ,如果缺少步骤②,将会导致测定结果
,如果缺少步骤②,将会导致测定结果___________ (填“偏大”、“偏小”或“无影响”)
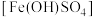 的工艺流程如下:
的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的
 见下
见下| 沉淀物 |  |  |  |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)用稀硫酸浸废铁屑后,溶液中存在的阳离子主要有
(2)写出酸浸过程中
 发生反应的离子方程式
发生反应的离子方程式 生成的试剂
生成的试剂(3)加入少量
 的目的是调节
的目的是调节 在范围内,写出用
在范围内,写出用 调整浓溶液
调整浓溶液 时的离子方程式是
时的离子方程式是(4)反应Ⅱ中加入
 的目的是氧化
的目的是氧化 ,写出该反应的离子方程式
,写出该反应的离子方程式(5)碱式硫酸铁溶于水后生成的
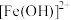 离子可部分水解生成
离子可部分水解生成 聚合离子,该水解反应的离子方程式为
聚合离子,该水解反应的离子方程式为(6)为测定
 和
和 溶液中铁元素的总含量,实验操作如下:
溶液中铁元素的总含量,实验操作如下:①准确量取
 溶液于带塞锥形瓶中,加入足量
溶液于带塞锥形瓶中,加入足量 ,调节
,调节 ;
;②加热除去过量
 ;
;③加入过量
 充分反应后,再用
充分反应后,再用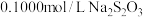 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 。
。已知:

则溶液中铁元素的总含量为
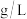 ,如果缺少步骤②,将会导致测定结果
,如果缺少步骤②,将会导致测定结果
您最近一年使用:0次
2021-12-03更新
|
349次组卷
|
3卷引用:天津市第一中学2021-2022学年高三上学期第二次月考化学试题
6 . 草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:探究草酸的制备
实验室用硝酸氧化淀粉水解液法制备草酸:C6H12O6+12HNO3→ 3H2C2O4+9NO2↑+3NO↑+9H2O。
装置如图所示:
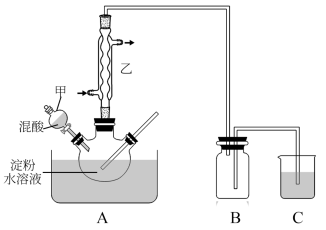
(1)上图实验装置中仪器乙的名称为:___________ ,B装置的作用___________ 。
(2)检验淀粉是否完全水解所需要的试剂为:___________ 。
实验Ⅱ:探究草酸的不稳定性
已知:草酸晶体(H2C2O4·2H2O,M=126g/mol)无色,易溶于水,熔点为101℃,受热易脱水、升华,170℃以上分解产生H2O、CO和CO2.草酸的酸性比碳酸强,其钙盐难溶于水。

(3)请选取以上的装置证明草酸晶体分解的产物(可重复使用,加热装置和连接装置已略去)。仪器装置连接顺序为:C→___________ →___________ →___________ →___________ →D→A→F→E
(4)若实验结束后测得A管后面的F装置质量增加4.4g,则至少需分解草酸晶体的质量为___________ g。
实验Ⅲ:探究草酸与酸性高锰酸钾的反应
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;
写出高锰酸钾在酸性条件下氧化草酸的离子反应方程式:___________ 。
由此你认为溶液褪色总是先慢后快的原因是___________ 。
实验Ⅰ:探究草酸的制备
实验室用硝酸氧化淀粉水解液法制备草酸:C6H12O6+12HNO3→ 3H2C2O4+9NO2↑+3NO↑+9H2O。
装置如图所示:

(1)上图实验装置中仪器乙的名称为:
(2)检验淀粉是否完全水解所需要的试剂为:
实验Ⅱ:探究草酸的不稳定性
已知:草酸晶体(H2C2O4·2H2O,M=126g/mol)无色,易溶于水,熔点为101℃,受热易脱水、升华,170℃以上分解产生H2O、CO和CO2.草酸的酸性比碳酸强,其钙盐难溶于水。

(3)请选取以上的装置证明草酸晶体分解的产物(可重复使用,加热装置和连接装置已略去)。仪器装置连接顺序为:C→
(4)若实验结束后测得A管后面的F装置质量增加4.4g,则至少需分解草酸晶体的质量为
实验Ⅲ:探究草酸与酸性高锰酸钾的反应
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(S) | 褪色时间(S) | ||
| C(mol·L-1) | V(mL) | C(mol·L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
由此你认为溶液褪色总是先慢后快的原因是
您最近一年使用:0次
7 . 用还原法将硝酸厂烟气中的大量氮氧化物转化为无毒的物质。常温下,将NO和H2的混合气体通过Ce(SO4)2与Ce2(SO4)3的混合溶液中,其转化过程如图所示。下列说法不正确的是


| A.反应Ⅰ的离子方程式为2Ce4++H2=2Ce3++2H+ |
| B.反应Ⅱ中氧化剂和还原剂的物质的量之比为1:2 |
| C.反应混合液中Ce4+和Ce3+的总数一定保持不变 |
| D.反应前溶液中c(Ce4+)一定等于反应后溶液中c(Ce4+) |
您最近一年使用:0次
2021-11-16更新
|
1135次组卷
|
15卷引用:天津市第一中学2021-2022学年高一上学期期中考试化学试题
天津市第一中学2021-2022学年高一上学期期中考试化学试题【市级联考】山东省烟台市2019届高三上学期期末考试化学试题河南省洛阳市第一高级中学2019-2020学年高一9月月考化学试题福建省漳平市第一中学2020届高三上学期第二次月考化学试题山西省临汾市县底中学校2020-2021学年高二上学期开学考试化学试题江西省兴国三中2021届高三上学期第一次月考化学试题江苏省沭阳县修远中学2022届高三上学期第一次阶段考试化学试题四川省眉山市彭山区第一中学2021-2022学年高三上学期10月月考化学试题陕西省泾阳县2020-2021学年高三上学期期中考试化学试题湖北省随州市第二中学 2020-2021学年高一下学期期末检测化学试题(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)内蒙古赤峰二中2021-2022学年高一上学期第二次月考化学试题安徽省合肥市第六中学2021-2022学年高一下学期期末考试化学试题安徽省舒城中学2022-2023学年高二上学期开学考试化学试题
名校
解题方法
8 . 一氧化二氯(Cl2O)是一种氯化剂和氧化剂,极易溶于水,与水反应生成 HClO, 遇有机物易燃烧或爆炸,42℃以上易分解。制备出的Cl2O要冷却成固体才便于操作和保存,制取少量的Cl2O是用干燥的氧化汞和氯气反应:2HgO+2Cl2 = Cl2O+HgCl2·HgO (反应放热)。某化学兴趣小组设计如图装置以制备 Cl2O(支撑、加热及夹持装置已省略)。
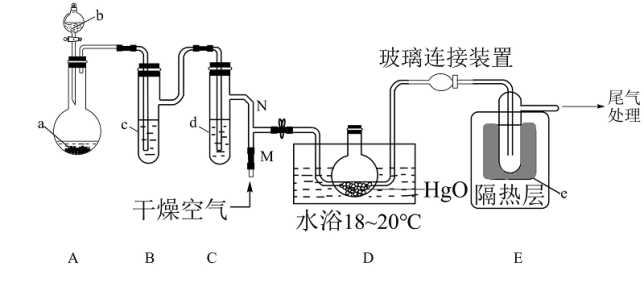
已知:① a中固体试剂是MnO2,b中试剂是浓盐酸。
②有关物质的熔沸点如下表。
请回答:
(1)仪器b的名称___________
(2)写出装置 A 中制备 Cl2的化学方程式___________ 。
(3)B中盛有的液体c应是___________ ,C中的液体d的作用___________
(4)E中的保温瓶中盛有液态制冷剂e是___________ (在“干冰”“冰水”“液态空气”“液氨”“液氯”中选择一种)
(5)据文献报道,Cl2O 的另一种制备方法是利用 Cl2与足量的 Na2CO3溶液 反应来制得,同时生成NaHCO3和NaCl两种盐,写出该反应的化学方程式___________ 。

已知:① a中固体试剂是MnO2,b中试剂是浓盐酸。
②有关物质的熔沸点如下表。
| Cl2O | N2 | O2 | CO2 | NH3 | Cl2 | |
| 熔点 | -120.6 ℃ | -209.86℃ | -218.4℃ | -78.5℃(升华) | -77.3℃ | -101℃ |
| 沸点 | 3.8℃ | -195.8℃ | -183℃ | -33.35℃ | -34.6℃ |
(1)仪器b的名称
(2)写出装置 A 中制备 Cl2的化学方程式
(3)B中盛有的液体c应是
(4)E中的保温瓶中盛有液态制冷剂e是
(5)据文献报道,Cl2O 的另一种制备方法是利用 Cl2与足量的 Na2CO3溶液 反应来制得,同时生成NaHCO3和NaCl两种盐,写出该反应的化学方程式
您最近一年使用:0次
2021-11-08更新
|
379次组卷
|
3卷引用:天津滨海新区八所重点学校2021-2022学年高三下学期毕业班联考化学试题
名校
解题方法
9 . 含氮化合物过多蓄积会导致水体富营养化,需将其从水体中除去,该过程称为脱氮。常用的脱氮方法有吹脱法和折点氯化法。
吹脱法:调节水体 至8左右,然后持续向水中吹入空气。
至8左右,然后持续向水中吹入空气。
折点氯化法:调节水体 至6左右,向水中加入适量
至6左右,向水中加入适量 。
。
下列分析不正确的是
吹脱法:调节水体
 至8左右,然后持续向水中吹入空气。
至8左右,然后持续向水中吹入空气。折点氯化法:调节水体
 至6左右,向水中加入适量
至6左右,向水中加入适量 。
。下列分析不正确的是
A.含氨和铵盐的水体中存在平衡: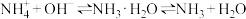 |
B.吹脱法的原理是通过鼓气降低 浓度,从而降低水中 浓度,从而降低水中 与 与 的含量 的含量 |
C.折点氯化法除 的原理为: 的原理为: |
D.吹脱法无法对含 的水体脱氮,但折点氯化法可以对含 的水体脱氮,但折点氯化法可以对含 的水体脱氮 的水体脱氮 |
您最近一年使用:0次
2021-10-19更新
|
1074次组卷
|
17卷引用:天津市五校2022-2023学年高三上学期期中联考化学试题
天津市五校2022-2023学年高三上学期期中联考化学试题天津市咸水沽第一中学2022-2023学年高三上学期线上期末考试化学试题2020届高三化学海淀区高三第一学期期中练习北京市海淀区2019-2020学年高三期中考试化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》湖北省龙泉中学、潜江中学2020届高三12月联考理综化学试题山东省济宁市泗水县2021届高三上学期期中考试化学试题(已下线)课时24 环境污染与保护-2022年高考化学一轮复习小题多维练(全国通用)北京市北京中国人民大学附属中学2022届高三10月检测化学试卷(已下线)2022年新高考化学时事热点情境化考题---化学与文化生活(已下线)备战2022年高考化学精准检测卷【全国卷】11(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)章末综合评价(四)THUSSAT新高考地区2022年12月诊断性测试化学试题北京市交通大学附属中学2023-2024学年高一上学期12月月考化学试题 重庆市2023-2024学年高三下学期2月月度质量检测化学试题(已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
10 . NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图1;研究发现在催化剂上可能发生的反应过程如图2。下列说法不正确的是
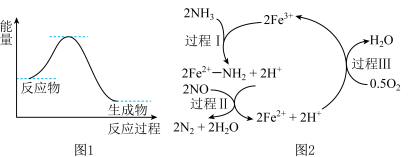

| A.NH3催化还原NO为放热反应 |
| B.过程I中NH3断裂极性键,需要吸收能量,Fe3+体现了氧化性 |
C.过程III的离子方程式: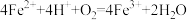 |
| D.反应过程中,反应物为NH3、O2、NO,Fe3+、Fe2+为中间产物 |
您最近一年使用:0次
2021-09-26更新
|
989次组卷
|
16卷引用:天津市红桥区2021-2022学年高三上学期期中考试化学试题
天津市红桥区2021-2022学年高三上学期期中考试化学试题浙江省“精诚联盟”2021-2022学年高二上学期返校考试化学试题江西省抚州市临川一中、临川一中实验学校2022届高三第一次月考化学试题(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)吉林省长春市北师大附属学校2021-2022学年高三上学期第一次月考化学试题(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)浙江省金华市第六中学2022-2023学年高二上学期开学考试化学试题四川省成都市郫都区2021-2022学年高二上学期期中考试化学试题山东省“学情空间”区域教研共同体2022-2023学年高三上学期10月检测化学试题湖南省宁乡市四校联考2022-2023学年高二上学期10月月考化学试题湖北省襄阳市第三中学2021-2022学年高一下学期3月月考化学试题四川省凉山州西昌市第二中学2021-2022学年高二上学期期末检测化学试题浙江省名校协作体2023-2024学年高二上学期开学适应性考试化学试题吉林省通化市梅河口市第五中学2022-2023学年高三上学期10月期中考试化学试题湖南省常德市第一中学2023-2024学年高二上学期入学考试化学试题上海市控江中学2023-2024学年高二上学期10月阶段测验化学试题



