名校
解题方法
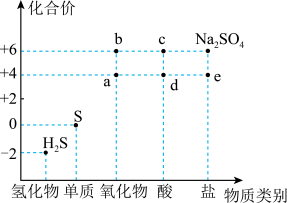
1 . 如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:_____ ,体现了c的_____ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是_____ (填化学式)。
(3)将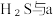 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为_____ 。
(4)配平下列反应:_____ 。
_____
(5)为防止多余的a气体污染环境,应将尾气通入_____ 溶液中;
(6)将足量的 溶液中,下列说法正确的是
溶液中,下列说法正确的是_____ (填字母)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀

(7)将 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为_____ 。 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:_____ 。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是
(3)将
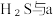 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为(4)配平下列反应:
_____

(5)为防止多余的a气体污染环境,应将尾气通入
(6)将足量的
 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(7)将
 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为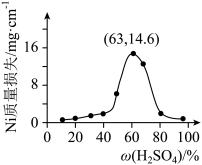
 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 研究人员提出利用热化学硫碘循环实现硫化氢分解联产氢气和硫黄,转化过程如下,其中Y、Z代表I2或HI中的一种。下列说法不正确 的是
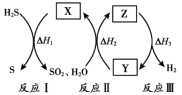
| A.Y在Z溶液中比在H2SO4溶液中易溶 |
| B.反应I中X的浓度与硫黄的产率无关 |
| C.反应Ⅱ的化学方程式为SO2+2H2O+I2=H2SO4+2HI |
| D.等压条件下,反应Ⅰ、Ⅱ、Ⅲ的反应热之和等于硫化氢直接分解的反应热 |
您最近一年使用:0次
2024-04-15更新
|
269次组卷
|
2卷引用:天津市第一中学2023-2024学年高三下学期5月月考化学试卷
真题
解题方法
3 . 铜及其化合物在生产生活中有重要作用。
(1)基态Cu原子的价层电子排布式是______ , 与
与 相比较,离子半径较大的是
相比较,离子半径较大的是______ 。
(2)铜的一种化合物的晶胞如图所示,其化学式为______ 。 ,写出该反应化学方程式:
,写出该反应化学方程式:______ 。反应中,H2O2实际消耗量大于理论用量的原因是______ 。H2O2电子式为______ 。
(4)上述制备反应中,下列物质均可替代H2O2作氧化剂,最适合的是是______ (填序号)。
a.硝酸 b. c.
c.
(5)Cu2+和I-的反应可用于Cu含量的定量分析。向CuCl2溶液中滴入KI溶液,生成一种碘化物白色沉淀,且上层溶液可使淀粉溶液变蓝。该白色沉淀的化学式为______ 。反应中KI的作用为______ 。
(1)基态Cu原子的价层电子排布式是
 与
与 相比较,离子半径较大的是
相比较,离子半径较大的是(2)铜的一种化合物的晶胞如图所示,其化学式为

 ,写出该反应化学方程式:
,写出该反应化学方程式:(4)上述制备反应中,下列物质均可替代H2O2作氧化剂,最适合的是是
a.硝酸 b.
 c.
c.
(5)Cu2+和I-的反应可用于Cu含量的定量分析。向CuCl2溶液中滴入KI溶液,生成一种碘化物白色沉淀,且上层溶液可使淀粉溶液变蓝。该白色沉淀的化学式为
您最近一年使用:0次
名校
4 . 某实验小组欲探究SO2和Cl2能否发生反应,设计如图所示的实验装置进行实验。注:已检验装置气密性,且实验前已经用氮气排净装置内的空气。
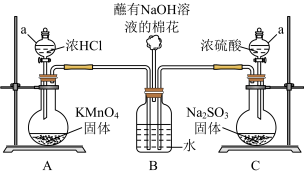
(1)图中仪器a的名称:_______ 。
(2)装置A中的反应为______KMnO4+______HCl(浓)=_____KCl+_____MnCl2+_____Cl2+_____H2O。
①配平该反应并用单线桥表示电子转移_______ 。
②反应中的氧化剂和还原剂的物质的量之比是_______ ;生成71gCl2转移的物质的量是_______ mol。
(3)装置C中反应的化学方程式是_______ 。
(4)打开装置A、C中仪器a的活塞,一段时间后关闭活塞。待反应完全后,又继续如下实验。
①甲同学取适量B中溶液于试管中,向其中滴加一滴AgNO3稀溶液,即有白色沉淀生成。甲同学由此认为SO2和Cl2发生了反应,理由是该反应中生成了______ 离子(写离子符号)。
②乙同学认为甲同学的结论不合理,认为A中生成的Cl2中混有杂质,应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法即可得到正确结论。乙同学认为Cl2中混有的杂质是_______ 。
③丙同学则认为,该白色沉淀不能证明SO2和Cl2发生反应,结合离子方程式解释原因_______ ;丙同学取适量B中溶液于试管中,向其中滴加少量溶液X,有白色沉淀生成,则可得出结论,即SO2和Cl2同时通入水中,可以发生反应。溶液X是______ (填选项序号)。
a.BaCl2溶液 b.Ba(OH)2溶液 c.Ba(NO3)2溶液 d.品红溶液
(5)SO2和Cl2同时通入水中反应的化学方程式_______ 。

(1)图中仪器a的名称:
(2)装置A中的反应为______KMnO4+______HCl(浓)=_____KCl+_____MnCl2+_____Cl2+_____H2O。
①配平该反应并用单线桥表示电子转移
②反应中的氧化剂和还原剂的物质的量之比是
(3)装置C中反应的化学方程式是
(4)打开装置A、C中仪器a的活塞,一段时间后关闭活塞。待反应完全后,又继续如下实验。
①甲同学取适量B中溶液于试管中,向其中滴加一滴AgNO3稀溶液,即有白色沉淀生成。甲同学由此认为SO2和Cl2发生了反应,理由是该反应中生成了
②乙同学认为甲同学的结论不合理,认为A中生成的Cl2中混有杂质,应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法即可得到正确结论。乙同学认为Cl2中混有的杂质是
③丙同学则认为,该白色沉淀不能证明SO2和Cl2发生反应,结合离子方程式解释原因
a.BaCl2溶液 b.Ba(OH)2溶液 c.Ba(NO3)2溶液 d.品红溶液
(5)SO2和Cl2同时通入水中反应的化学方程式
您最近一年使用:0次
名校
5 . 三氯化铬(CrCl3)为紫色晶体,熔点为83 ℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化。其工业生产中应用广泛。
以Cr2O3、CCl4(沸点为76.8 ℃)为原料制备无水CrCl3的实验装置图如下所示。
(2)装置A中产生N2的作用为___________ 。
A.排尽装置中的空气 B.平衡气压 C.吹出CCl4 和CrCl3
(3)装置C和装置E水槽中盛有的液体分别为___________ 、___________ 。
A.沸水 B.冰水
(4)装置D中另一产物为光气(COCl2),D中反应的化学方程式为___________ 。
(5)三氯化铬属于___________ 。
A.分子晶体 B.离子晶体 C.共价晶体 D.金属晶体
实验中发现D、E之间的导管容易堵塞,原因是___________ 。
(6)为进一步探究CrCl3的性质,某同学取若干支试管,分别加入10滴0.1 mol·L-1 CrCl3溶液,再分别加入不同滴数的0.1 mol·L-1 KMnO4酸性溶液,并在不同的温度下进行实验,反应现象记录于表中。
通过对表中数据进行分析,在上述反应条件下,欲将Cr3+ 氧化为橙黄色的Cr2O ,CrCl3与KMnO4最佳用量比为
,CrCl3与KMnO4最佳用量比为___________ 。已知: ,实验用量比理论用量更多,原因是
,实验用量比理论用量更多,原因是___________ 。
(7)Cr(Ⅲ)的存在形态的物质的量分数随溶液pH的分布如图所示,请补充完整由CrCl3溶液制备纯净的Cr(OH)3的实验方案。___________ 。
A.4~6 B.6 C.6~12 D.12
步骤二:充分反应后过滤、洗涤,检验沉淀已洗净的操作是___________ 。
步骤三:低温烘干沉淀,得到Cr(OH)3晶体。
以Cr2O3、CCl4(沸点为76.8 ℃)为原料制备无水CrCl3的实验装置图如下所示。
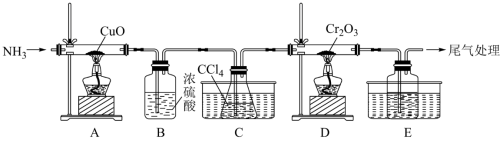
| A.加热氯化铵固体制备氨气 | B.使用无水氯化钙干燥氨气 |
| C.用排水法收集氨气 | D.用湿润的红色石蕊试纸检验氨气 |
A.排尽装置中的空气 B.平衡气压 C.吹出CCl4 和CrCl3
(3)装置C和装置E水槽中盛有的液体分别为
A.沸水 B.冰水
(4)装置D中另一产物为光气(COCl2),D中反应的化学方程式为
(5)三氯化铬属于
A.分子晶体 B.离子晶体 C.共价晶体 D.金属晶体
实验中发现D、E之间的导管容易堵塞,原因是
(6)为进一步探究CrCl3的性质,某同学取若干支试管,分别加入10滴0.1 mol·L-1 CrCl3溶液,再分别加入不同滴数的0.1 mol·L-1 KMnO4酸性溶液,并在不同的温度下进行实验,反应现象记录于表中。
| KMnO4酸性溶液的用量(滴数) | 在不同温度下的反应现象 | |
| 25 ℃ | 90~100 ℃ | |
| 1 | 紫红色 | 蓝绿色溶液 |
| 3 | 紫红色 | 黄绿色溶液 |
| 10 | 紫红色 | 橙黄色溶液 |
| 11 | 紫红色 | 橙黄色溶液,有少量棕褐色沉淀 |
| 25 | 紫红色 | 紫红色溶液,有较多的棕褐色沉淀 |
 ,CrCl3与KMnO4最佳用量比为
,CrCl3与KMnO4最佳用量比为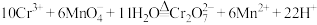 ,实验用量比理论用量更多,原因是
,实验用量比理论用量更多,原因是(7)Cr(Ⅲ)的存在形态的物质的量分数随溶液pH的分布如图所示,请补充完整由CrCl3溶液制备纯净的Cr(OH)3的实验方案。
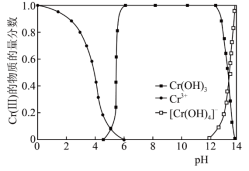
A.4~6 B.6 C.6~12 D.12
步骤二:充分反应后过滤、洗涤,检验沉淀已洗净的操作是
步骤三:低温烘干沉淀,得到Cr(OH)3晶体。
您最近一年使用:0次
2024-04-01更新
|
598次组卷
|
3卷引用:2024届天津市第四十七中学高三下学期模拟预测化学试题
6 . 钪( )是一种功能强大的稀土金属,广泛用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为钛酸亚铁
)是一种功能强大的稀土金属,广泛用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为钛酸亚铁 ,还含有少量
,还含有少量 、
、 、
、 等杂质,从钛铁矿中提取
等杂质,从钛铁矿中提取 的流程如下图:
的流程如下图:
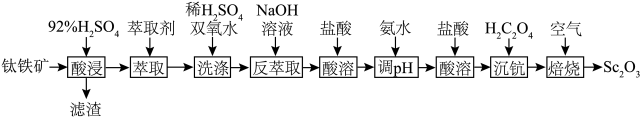
回答下列问题:
(1)“滤渣”的主要成分是
(2)“酸浸”后,钛主要以
 的形式存在于溶液中,
的形式存在于溶液中, 在一定条件下可完全水解生成
在一定条件下可完全水解生成 ,写出
,写出 水解的离子方程式:
水解的离子方程式:(3)实验室萃取装置如下图所示,仪器a的名称为
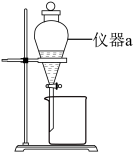
(4)25℃时“调
 ”先加氨水调节
”先加氨水调节 ,过滤除去
,过滤除去 。再向滤液中加入氨水调节
。再向滤液中加入氨水调节 ,已知
,已知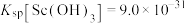 ,此时滤液中
,此时滤液中 的浓度为
的浓度为 。写出检验含
。写出检验含 滤液中是否含
滤液中是否含 的方法:
的方法:(5)“沉钪”时用到草酸,已知草酸的
 ;
;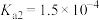 ,则在25℃时,
,则在25℃时, 的草酸溶液中
的草酸溶液中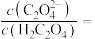
(6)
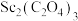 在空气中“焙烧”时生成
在空气中“焙烧”时生成 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
解题方法
7 . 下列指定反应的离子方程式书写正确的是
A.将 溶液滴入 溶液滴入 溶液中: 溶液中: |
B. 溶液中通入过量的 溶液中通入过量的 : :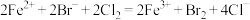 |
C.用铜作电极电解饱和食盐水: |
D.碳酸氢铵溶液中加入足量石灰水: |
您最近一年使用:0次
名校
8 . 下列方程式书写不正确的是
A. 溶液显碱性: 溶液显碱性: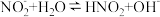 |
B.用碳酸钠溶液处理水垢中的硫酸钙: |
C. 溶液与溴水反应: 溶液与溴水反应: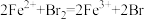 - - |
D.用惰性电极电解饱和 溶液: 溶液: |
您最近一年使用:0次
名校
解题方法
9 . 某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。(已知:C+2H2SO4(浓) CO2+2SO2↑+2H2O)
CO2+2SO2↑+2H2O)
(1)有同学认为制得的SO2中可能混有杂质,其化学式为___________ 。
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。___________ ;装置C中品红溶液的作用是___________ 。
②装置H的作用为___________ 。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。___________ ;
②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是___________ (填Ⅰ、Ⅱ或Ⅲ);试管b中发生反应的离子方程式为___________ 。
 CO2+2SO2↑+2H2O)
CO2+2SO2↑+2H2O)(1)有同学认为制得的SO2中可能混有杂质,其化学式为
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。

②装置H的作用为
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。

②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是
您最近一年使用:0次
2024-02-28更新
|
692次组卷
|
7卷引用:天津市武清区黄花店中学2023-2024学年高一下学期第一次月考化学试题(理科)
天津市武清区黄花店中学2023-2024学年高一下学期第一次月考化学试题(理科)江西省丰城中学2023-2024学年高一下学期开学化学试题(已下线)专题03 常见气体的实验室制取(考题猜想)(6大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)江西省南昌市第十九中学2023-2024学年高一下学期3月月考化学试题河北省石家庄市河北正定中学2023-2024学年高一下学期第一次月考(3月)化学试题辽宁省长海县高级中学2023-2024下学期第一次月考高一化学试卷湖南省常德市第一中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
10 . I.某化学自主实验小组利用如图所示装置探究 能否被
能否被 还原
还原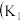 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。________ 。 装置发生的化学反应方程式为
装置发生的化学反应方程式为_________ 。
(2)甲、乙分别是___________  填标号
填标号 。
。
a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下: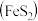 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:___________ 。
(6)写出催化反应室中SO2被氧化为SO3的化学方程式___________ 。
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用___________ 吸收。
 能否被
能否被 还原
还原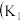 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
 装置发生的化学反应方程式为
装置发生的化学反应方程式为(2)甲、乙分别是
 填标号
填标号 。
。a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若
 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:(4)此实验装置存在一个明显的缺陷是
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
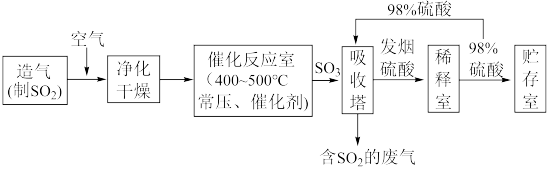
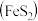 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:(6)写出催化反应室中SO2被氧化为SO3的化学方程式
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用
您最近一年使用:0次
2024-02-24更新
|
780次组卷
|
5卷引用:期末押题卷01-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)
(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)新疆克孜勒苏柯尔克孜自治州第二中学2022-2023学年高一下学期期末考试化学试题安徽省合肥市第一中学2023-2024学年高一下学期月考化学试题(一)广东省广州市黄广中学2023-2024学年高一下学期3月月考化学试题河南省三门峡市渑池县第二高级中学2023-2024学年高一下学期4月期中考试化学试题



