名校
1 . 2023年10月26日11时14分,神舟十七号载人飞船在酒泉卫星发射中心点火发射。飞船返回地球时,为了减弱返回舱着陆的速度,反推发动机的燃料是高氯酸铵 和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
(1)二氧化氯 和过氧化氢均有强氧化性。
和过氧化氢均有强氧化性。
①Cl和O分别形成简单氢化物的稳定性比较_______ >_______
②在酸性条件下,由 和双氧水反应制备
和双氧水反应制备 ,其反应的离子方程式为
,其反应的离子方程式为_______ ;该反应中还原剂与氧化剂的物质的量之比为_______ 。
(2)高氯酸铵中铵根离子的电子式为_______ ;高氯酸铵和铝粉中的元素所形成的简单离子中,核外电子数相同、半径由小到大的顺序是_______ (用离子符号表示)。
(3)氮元素的非金属性较强,N2分子的性质比较稳定,其原因是_______ 。
(4)高氯酸铵和铝粉反应除了生成 和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式
和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式_______ 。
 和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:(1)二氧化氯
 和过氧化氢均有强氧化性。
和过氧化氢均有强氧化性。①Cl和O分别形成简单氢化物的稳定性比较
②在酸性条件下,由
 和双氧水反应制备
和双氧水反应制备 ,其反应的离子方程式为
,其反应的离子方程式为(2)高氯酸铵中铵根离子的电子式为
(3)氮元素的非金属性较强,N2分子的性质比较稳定,其原因是
(4)高氯酸铵和铝粉反应除了生成
 和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式
和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式
您最近一年使用:0次
名校
2 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,下图物质转化中实现了循环,减少了有害物质向环境的排放,回答下列问题。
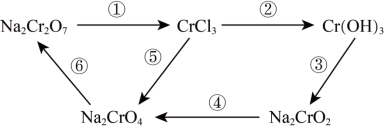
(1)Na2Cr2O7中Cr元素的化合价是______ 。
(2)浓HCl能实现反应①的转化,在浓HCl和Na2Cr2O7的反应中,Na2Cr2O7发生______ 反应(填“氧化”或“还原”),该反应有黄绿色气体生成,写出反应的化学方程式:______ 。
(3)反应④在碱性条件下发生,反应的离子方程式为: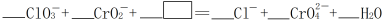 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式______ 。

(1)Na2Cr2O7中Cr元素的化合价是
(2)浓HCl能实现反应①的转化,在浓HCl和Na2Cr2O7的反应中,Na2Cr2O7发生
(3)反应④在碱性条件下发生,反应的离子方程式为:
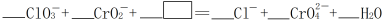 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式
您最近一年使用:0次
3 . 储氢纳米碳管研究成功体现了科技的进步,但用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为:C+K2Cr2O7+H2SO4→CO2↑+K2SO4+Cr2(SO4)3+H2O(未配平)。回答下列问题。
(1)该反应中,还原剂是___________ (填化学式),被还原的元素是___________ (填元素符号)。
(2)该反应中,K2Cr2O7表现出___________ (选填“氧化性”或“还原性”),K2Cr2O7发生了___________ (选填“氧化反应”或“还原反应”)。
(3)H2SO4在该反应中表现出___________(填字母)。
(4)配平上述方程式:________ 。每生成2分子H2O,该反应转移_________ 个电子。
(1)该反应中,还原剂是
(2)该反应中,K2Cr2O7表现出
(3)H2SO4在该反应中表现出___________(填字母)。
| A.只有酸性 | B.只有氧化性 | C.酸性和氧化性 | D.酸性和还原性 |
您最近一年使用:0次
名校
解题方法
4 . 石嘴山市施行的《石嘴山市小规模食品生产经营管理规定》中明确规定:小规模食经营者不得购进、存放、使用亚硝酸盐等易滥用的食品添加剂。
(1)根据物质组成分类,亚硝酸钠(NaNO2)属于___________ (填序号),写出其电离方程式:___________ 。
A.钠盐 B.硝酸盐 C.氧化物
(2)实验室中,亚硝酸钠可用来处理过量的叠氮化钠,有关反应的化学方程式如下:
a. NaNO2+H2SO4=HNO2+NaHSO4
b. 2NaN3+2HNO2=3N2↑+2NO↑+2NaOH
上述氧化还原反应中的氧化剂与还原剂的比值为___________ ,反应生成3个N2转移的电子数为___________ 。
(3)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中的亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中正确的是___________ (填序号)。
A. 亚硝酸钠是还原剂 B.维生素C是氧化剂
C. 维生素C能把铁离子还原成为亚铁离子 D.亚硝酸钠被还原
②鉴别方法如下:将样品盐放入稀硫酸与另外一种溶液(溶质为X)的混合液中,振荡,再滴加淀粉溶液,如果溶液显蓝色,则可以证明该样品盐是亚硝酸钠,如果溶液颜色无变化,则证明该样品盐为氯化钠。X与亚硝酸钠发生的反应可表示为2NaNO2 + 2X + 2H2SO4 = 2NO↑ + I2 + K2SO4 + Na2SO4 + 2H2O(已配平),其中X是___________ (填化学式)该反应的离子方程式为___________ 。
③含NaNO2的废水必须经处理后才能排放,用铵盐来处理亚硝酸钠反应生成一种无毒气体写出该反应的离子方程式:___________ 。
(1)根据物质组成分类,亚硝酸钠(NaNO2)属于
A.钠盐 B.硝酸盐 C.氧化物
(2)实验室中,亚硝酸钠可用来处理过量的叠氮化钠,有关反应的化学方程式如下:
a. NaNO2+H2SO4=HNO2+NaHSO4
b. 2NaN3+2HNO2=3N2↑+2NO↑+2NaOH
上述氧化还原反应中的氧化剂与还原剂的比值为
(3)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中的亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中正确的是
A. 亚硝酸钠是还原剂 B.维生素C是氧化剂
C. 维生素C能把铁离子还原成为亚铁离子 D.亚硝酸钠被还原
②鉴别方法如下:将样品盐放入稀硫酸与另外一种溶液(溶质为X)的混合液中,振荡,再滴加淀粉溶液,如果溶液显蓝色,则可以证明该样品盐是亚硝酸钠,如果溶液颜色无变化,则证明该样品盐为氯化钠。X与亚硝酸钠发生的反应可表示为2NaNO2 + 2X + 2H2SO4 = 2NO↑ + I2 + K2SO4 + Na2SO4 + 2H2O(已配平),其中X是
③含NaNO2的废水必须经处理后才能排放,用铵盐来处理亚硝酸钠反应生成一种无毒气体写出该反应的离子方程式:
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题。
I.某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并用电导率传感器测得混合溶液的导电能力(电导率)随时间变化的曲线如图所示。
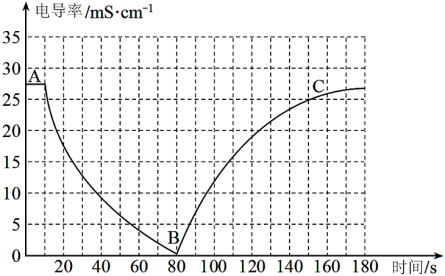
(1)Ba(OH)2在水中以离子形式存在的实验证据是___________ ;
(2)AB段发生的反应的离子方程式是___________ ;
(3)BC段电导率逐渐上升的原因是___________ ;
(4)如果将稀硫酸改为等浓度的稀盐酸,猜想此时电导率的最低点在B点的___________(填选项)
(5)该兴趣小组通过查阅资料了解到Ba2+是重金属离子,可溶性钡盐对人体有毒。医疗上常用硫酸钡作胃肠道检查的造影剂,俗称“钡餐”,而不溶性的碳酸钡却不能做钡餐。请用离子方程式解释原因___________ 。
II.回顾氧化还原反应知识内容,回答下列问题:
(6)配平反应:___________S+___________KOH = ___________K2SO3+___________K2S+___________H2O___________ ,被氧化与被还原的硫原子数目之比是___________ 。
(7)配平反应:___________KMnO4+___________HCl(浓)=___________KCl+___________MnCl2+___________Cl2↑+___________H2O___________ ,氧化剂与还原剂个数之比为___________ ,浓盐酸表现出的性质是___________ 。
(8)配平反应:___________KMnO4 +___________FeSO4 +___________H2SO4 =___________K2SO4 +___________MnSO4 +___________Fe2(SO4)3 +___________H2O___________
(9)配平反应:___________Fe(OH)3+___________NaOH+___________Cl2=___________Na2FeO4+___________NaCl+___________H2O___________
I.某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并用电导率传感器测得混合溶液的导电能力(电导率)随时间变化的曲线如图所示。

(1)Ba(OH)2在水中以离子形式存在的实验证据是
(2)AB段发生的反应的离子方程式是
(3)BC段电导率逐渐上升的原因是
(4)如果将稀硫酸改为等浓度的稀盐酸,猜想此时电导率的最低点在B点的___________(填选项)
| A.上方 | B.下方 | C.重合 | D.无法确定 |
(5)该兴趣小组通过查阅资料了解到Ba2+是重金属离子,可溶性钡盐对人体有毒。医疗上常用硫酸钡作胃肠道检查的造影剂,俗称“钡餐”,而不溶性的碳酸钡却不能做钡餐。请用离子方程式解释原因
II.回顾氧化还原反应知识内容,回答下列问题:
(6)配平反应:___________S+___________KOH = ___________K2SO3+___________K2S+___________H2O
(7)配平反应:___________KMnO4+___________HCl(浓)=___________KCl+___________MnCl2+___________Cl2↑+___________H2O
(8)配平反应:___________KMnO4 +___________FeSO4 +___________H2SO4 =___________K2SO4 +___________MnSO4 +___________Fe2(SO4)3 +___________H2O
(9)配平反应:___________Fe(OH)3+___________NaOH+___________Cl2=___________Na2FeO4+___________NaCl+___________H2O
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题
(1)美国科学家曾宣称:普通盐水在某种无线电波照射下可以燃烧,这一发现有望解决用水作人类能源的重大问题。无线电波可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种电波下持续燃烧。上述“结合力”的实质是___________(填标号)。
(2)科学家发现,在特殊条件下,水能表现出许多有趣的结构和性质。
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其模拟图如图所示:

采用弱电场使水结成“热冰”,说明水分子是___________ (填“极性”或“非极性”)分子。请你展开想象,给“热冰”设计一个应用实例___________ 。
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是___________ 。水分子释放出电子时产生的阳离子具有较强的氧化性,试写出该阳离子与SO2反应的离子方程式___________ 。
(1)美国科学家曾宣称:普通盐水在某种无线电波照射下可以燃烧,这一发现有望解决用水作人类能源的重大问题。无线电波可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种电波下持续燃烧。上述“结合力”的实质是___________(填标号)。
| A.范德华力 | B.氢键 | C.非极性共价键 | D.极性共价键 |
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其模拟图如图所示:

采用弱电场使水结成“热冰”,说明水分子是
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是
您最近一年使用:0次
名校
7 . 高铁酸钾(K2FeO4)是一种高效的水处理剂,实验室制备K2FeO4的装置如图所示。(夹持装置略去)
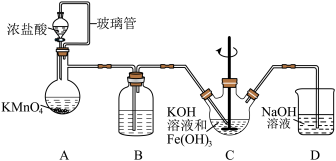
查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是___________ ,玻璃管的作用是___________ 。
(2)装置B中盛放的试剂是___________ 。
(3)装置C中KOH溶液过量的目的是___________ 。搅拌操作,除了防止因局部溶液碱性减弱,使K2FeO4与水反应产生Fe(OH)3和O2,另外的作用是___________ 。
(4)装置C中生成K2FeO4的离子方程式为___________ 。该反应放热,不利于K2FeO4固体析出,写出一条实验改进措施___________ 。
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用___________ 除水。(填标号)
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是___________ 。

查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是
(2)装置B中盛放的试剂是
(3)装置C中KOH溶液过量的目的是
(4)装置C中生成K2FeO4的离子方程式为
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是
您最近一年使用:0次
2023-09-07更新
|
581次组卷
|
3卷引用:宁夏石嘴山市平罗中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
8 . 配平下列方程式或完成下列问题
(1)______ClO-+______Fe(OH)3+_______OH-=______Cl-+______FeO +______H2O。
+______H2O。________ 。
(2)______FeS2+______O2 ______Fe2O3+______SO2。
______Fe2O3+______SO2。________ 。
(3)____KI+____KIO3+____H2SO4=____I2+____K2SO4+____H2O。________ 。
(4)____S+____KOH=____K2S+____K2SO3+____H2O。________ 。
(5)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+______Cl2+______ =______K2CO3+______N2+______KCl+______
=______K2CO3+______N2+______KCl+______ 。
。________ 。
(6)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_____________ 。
(7)黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
写出有关反应的化学方程式:___________________________ 。
(8)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的 、NO转化为:
、NO转化为: 、
、 。当烟气中
。当烟气中 和NO的体积比为2:1时,其离子方程式为
和NO的体积比为2:1时,其离子方程式为___________ 。
(9)研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体(Na2MoO4·2H2O)的途径如图所示:
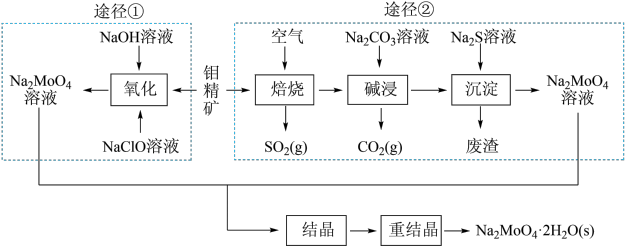
回答下列问题:
途径①制备钼酸钠溶液,同时有SO 生成,该反应的离子方程式为
生成,该反应的离子方程式为_____________ 。
(1)______ClO-+______Fe(OH)3+_______OH-=______Cl-+______FeO
 +______H2O。
+______H2O。(2)______FeS2+______O2
 ______Fe2O3+______SO2。
______Fe2O3+______SO2。(3)____KI+____KIO3+____H2SO4=____I2+____K2SO4+____H2O。
(4)____S+____KOH=____K2S+____K2SO3+____H2O。
(5)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+______Cl2+______
 =______K2CO3+______N2+______KCl+______
=______K2CO3+______N2+______KCl+______ 。
。(6)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(7)黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
写出有关反应的化学方程式:
(8)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的
 、NO转化为:
、NO转化为: 、
、 。当烟气中
。当烟气中 和NO的体积比为2:1时,其离子方程式为
和NO的体积比为2:1时,其离子方程式为(9)研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体(Na2MoO4·2H2O)的途径如图所示:

回答下列问题:
途径①制备钼酸钠溶液,同时有SO
 生成,该反应的离子方程式为
生成,该反应的离子方程式为
您最近一年使用:0次
名校
9 . 可利用如图所示的工艺流程减少 的排放,下列说法错误的是
的排放,下列说法错误的是
 的排放,下列说法错误的是
的排放,下列说法错误的是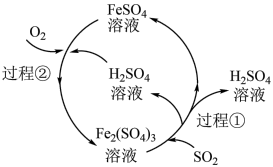
| A.在上述流程中共有三种元素的化合价发生了变化 |
| B.每处理1mol SO2,需要消耗标准状况下22.4L O2 |
| C.在上述流程中Fe2(SO4)3相当于催化剂,无需额外补充 |
D.过程①的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO +4H+ +4H+ |
您最近一年使用:0次
2023-08-24更新
|
198次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期开学检测化学试题
名校
10 . 运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为KClO3+P=P2O5+KCl(未配平)。下列有关该反应的叙述中,正确的是
| A.氯酸钾被氧化 |
| B.反应中每生成1个P2O5时,就转移5个电子 |
| C.单质P被还原,发生还原反应 |
| D.配平后反应的化学方程式为5KClO3+6P=3P2O5+5KCl |
您最近一年使用:0次
2023-08-17更新
|
864次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高一9月月考化学试题



