名校
1 . 离子反应和氧化还原反应在生产、生活中应用广泛,用所学知识回答问题:
(1)新制氢氧化亚铁被氧气氧化,其化学方程式为______________ 。
(2)氯化铝溶液中滴加四羟基合铝酸钠溶液的离子方程式________ 。
(3)向硫酸铜溶液中逐滴滴加氨水至过量的离子方程式是____ 、______ 。
(4)向硫酸铝钾溶液中逐滴加入Ba(OH)2溶液至SO42-全部沉淀时的离子方程式_______ ;
(1)新制氢氧化亚铁被氧气氧化,其化学方程式为
(2)氯化铝溶液中滴加四羟基合铝酸钠溶液的离子方程式
(3)向硫酸铜溶液中逐滴滴加氨水至过量的离子方程式是
(4)向硫酸铝钾溶液中逐滴加入Ba(OH)2溶液至SO42-全部沉淀时的离子方程式
您最近一年使用:0次
名校
解题方法
2 . 氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:

已知:① Cr2O72-+H2O 2CrO42-+2H+;
2CrO42-+2H+;
② CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式____________________________________ ,所加40%NaOH不宜过量太多的原因是______________________________ 。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式_________________ ,反应后从剩余溶液中分离出CH3OH的实验方法是_____________ 。
(3)使用下列用品来测定溶液的pH,合理的是_________ (填字母)。
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体_______________________ ,蒸发浓缩,__________ ,过滤, ______________ ,低温干燥,得到CrCl3·6H2O(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体42.64g,则该实验的产率为_________ 。

已知:① Cr2O72-+H2O
 2CrO42-+2H+;
2CrO42-+2H+;② CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式
(3)使用下列用品来测定溶液的pH,合理的是
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体42.64g,则该实验的产率为
您最近一年使用:0次
2017-11-19更新
|
372次组卷
|
3卷引用:【全国百强校】宁夏回族自治区石嘴山市第三中学2019届高三上学期期中考试化学试题
3 . 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
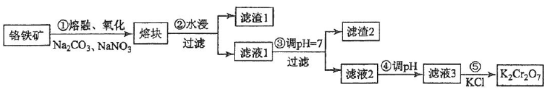
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________ 。该步骤不能使用陶瓷容器,原因是________________ 。
(2)滤渣1中含量最多的金属元素是____________ ,滤渣2的主要成分是_____________ 及含硅杂质。
(3)步骤④调滤液2的pH使之变____________ (填“大”或“小”),原因是___________________ (用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________ (填标号)得到的K2Cr2O7固体产品最多。
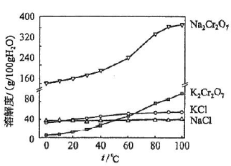
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________ 。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为________ 。

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为(2)滤渣1中含量最多的金属元素是
(3)步骤④调滤液2的pH使之变
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为
您最近一年使用:0次
2017-08-08更新
|
9607次组卷
|
21卷引用:宁夏石嘴山市第三中学2018届高三上学期期末考试理综-化学试题
宁夏石嘴山市第三中学2018届高三上学期期末考试理综-化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)甘肃省武威市第六中学2018届高三上学期第二次阶段性过关考试化学试题(已下线)《考前20天终极攻略》-5月28日 工艺流程分析(已下线)解密19 工艺流程题(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第5讲 无机框图题的解答策略【教学案】云南省弥勒市第二中学2020届高三上学期开学考试化学试题云南省南华县一中2020届高三上学期开学考试化学试题2020届高考化学二轮复习大题精准训练——定量分析化学实验中物质含量的测定2019-2020学年人教版高中化学高考基础复习专题10《无机化学基础》测试卷贵州省黔南布依族苗族自治州龙里中学2019-2020学年高三上学期期末考试理综化学试题云南省昭通市绥江县二中2019-2020学年高三上学期期末考试理综化学试题贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题贵州省施秉县一中2019-2020学年高三上学期期末考试化学试题贵州省剑河县第二中学2019-2020学年高三上学期期末考试化学试题云南省玉溪市新平县一中2019-2020学年高三上学期1月月考理综化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训2020届湖南省湘潭市高三教学质量监测卷化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题浙江省金华市东阳中学2019-2020学年高二下学期期中考试化学试题江西省景德镇市第一中学2021-2022学年高一上学期期中19班化学试题
10-11高三上·上海·期中
4 . 某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。
Au2O3+_____ +______ →______ +________ +_________
(2)反应中,被还原的元素是_______ ,还原剂是____________ 。
(3)将氧化剂与还原剂填入空格中,并用单线桥表示出电子转移的方向和数目。______
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂的个数之比为_______ 。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。
Au2O3+
(2)反应中,被还原的元素是
(3)将氧化剂与还原剂填入空格中,并用单线桥表示出电子转移的方向和数目。
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂的个数之比为
您最近一年使用:0次
2016-12-09更新
|
344次组卷
|
8卷引用:2017届宁夏石嘴山三中高三上第二次适应性考试化学卷
2017届宁夏石嘴山三中高三上第二次适应性考试化学卷(已下线)2011届上海市南汇中学高三上学期期中考试化学卷(已下线)2011-2012学年辽宁省抚顺县高中高一上学期期中考试化学试卷(已下线)2012-2013学年河北省唐山市第一中学高二下学期期末考试化学试卷2013—2014福建省闽侯一中高三上学期10月月考化学试卷2015-2016学年四川省双流中学高一下入学考试化学试卷步步为赢 初高中衔接教材化学暑假作业:第16课时 氧化还原反应的应用(已下线)2019年7月18日 《每日一题》2020届高考一轮复习—— 氧化还原反应的配平
名校
解题方法
5 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
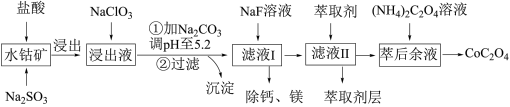
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将_____________ 还原(填离子符号)以便固体溶解。该步反应的离子方程式为____________________ (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为____________________ 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是____________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是________ ;使用萃取剂适宜的pH=____ (填序号)左右:

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=__________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=
您最近一年使用:0次
2016-12-09更新
|
199次组卷
|
5卷引用:2017届宁夏石嘴山市第三中学高三4月适应性(第二次模拟)考试理综化学试卷
13-14高三·海南海口·阶段练习
6 . 已知A为常见的金属单质,根据如图所示的转化关系回答下列问题。
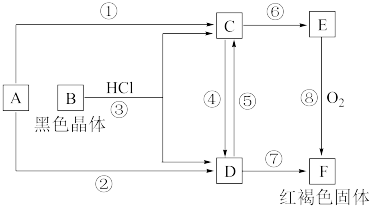
(1)确定A、B、C、D、E、F的化学式:
A为________ ,B为________ ,C为________ 。
D为________ ,E为________ ,F为________ 。
(2)写出⑧的化学方程式及④、⑤的离子方程式:___________________________ 。

(1)确定A、B、C、D、E、F的化学式:
A为
D为
(2)写出⑧的化学方程式及④、⑤的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
1001次组卷
|
4卷引用:宁夏石嘴山市第三中学2018届高三上学期期中考试化学试题
宁夏石嘴山市第三中学2018届高三上学期期中考试化学试题(已下线)2015届海南省海口市琼山区海政学校高三第四次月考化学试卷2015-2016学年辽宁省实验中学高一上12月月考化学试卷【全国百强校】江苏省苏州市第九高级中学2018-2019学年高一上学期十一月份月考化学试题



