名校
1 . 金属镓(Ga)是合成半导体材料砷化镓(GaAs)的重要基础材料,一种由砷化镓废料制备镓的工艺流程如下图。

已知:i.Ga(OH)3与Al(OH)3性质相似。 ii.NO2可以溶于浓HNO3中
(1)基态镓原子的核外电子排布式是_________ 。该元素位于元素周期表的_____ 区。
(2)酸浸溶解:
①上述流程中能加快反应速率的措施有___________ 。
②将GaAs与浓HNO3反应的化学方程式补充完整:____________ 。
□GaAs+□HNO3(浓)=□Ga(NO3)3+□H3AsO4+□______+□H2O
③其他条件相同时,研究镓的浸出率随时间变化情况,实验结果如下图。

推测NO2能够催化GaAs与浓硝酸的反应,设计实验证实了推测。
实验方案:用N2不断将生成的NO2吹出,测镓的浸出率随时间变化情况。预测该方案对应的镓的浸出率随时间变化情况(在上图中画出相应变化曲线)____________ 。
(3)除杂转化:
①上述工艺流程中浓氨水的作用是___________ 。
②Ga(OH)3沉淀与NaOH溶液反应的离子方程式为___________ 。
(4)电解制镓:以Pt为电极材料,电解NaGaO2溶液制金属镓,阴极反应式为___________ 。

已知:i.Ga(OH)3与Al(OH)3性质相似。 ii.NO2可以溶于浓HNO3中
(1)基态镓原子的核外电子排布式是
(2)酸浸溶解:
①上述流程中能加快反应速率的措施有
②将GaAs与浓HNO3反应的化学方程式补充完整:
□GaAs+□HNO3(浓)=□Ga(NO3)3+□H3AsO4+□______+□H2O
③其他条件相同时,研究镓的浸出率随时间变化情况,实验结果如下图。

推测NO2能够催化GaAs与浓硝酸的反应,设计实验证实了推测。
实验方案:用N2不断将生成的NO2吹出,测镓的浸出率随时间变化情况。预测该方案对应的镓的浸出率随时间变化情况(在上图中画出相应变化曲线)
(3)除杂转化:
①上述工艺流程中浓氨水的作用是
②Ga(OH)3沉淀与NaOH溶液反应的离子方程式为
(4)电解制镓:以Pt为电极材料,电解NaGaO2溶液制金属镓,阴极反应式为
您最近一年使用:0次
名校
2 . I.某小组对Cu与浓HNO3的反应进行研究。记录如下:
(1)Cu与浓HNO3反应的化学方程式是___________ 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(2)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是___________ 。
(3)乙认为溶液呈绿色是由溶解的NO2引起的。
进行实验2:先将NO2通入B中,再鼓入N2,结果证实假设成立。
则以上两步操作对应的现象分别是___________ 、___________ 。
(4)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O= HNO3+HNO2;
HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii. 能与Cu2+反应:Cu2+(蓝色)+4
能与Cu2+反应:Cu2+(蓝色)+4

 (绿色)
(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了 使溶液呈绿色。
使溶液呈绿色。
丙进行如下实验:
①亚硝酸分解的化学方程式是___________ 。
②请用平衡原理解释加入H2SO4后绿色溶液变蓝的原因:___________ 。
(5)根据实验得出结论:实验1中溶液A呈绿色的主要原因是___________ 。请依据实验现象阐述理由:___________ 。
| 装置 | 药品 | 现象 | |
| 实验1 |  | 0.64gCu片(0.01mol) Cu片和20.0 mL浓HNO3 | Cu片消失,得到绿色溶液A,放置较长时间后得到蓝色溶 液B,…… |
(1)Cu与浓HNO3反应的化学方程式是
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(2)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是
(3)乙认为溶液呈绿色是由溶解的NO2引起的。
进行实验2:先将NO2通入B中,再鼓入N2,结果证实假设成立。
则以上两步操作对应的现象分别是
(4)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O= HNO3+HNO2;
HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.
 能与Cu2+反应:Cu2+(蓝色)+4
能与Cu2+反应:Cu2+(蓝色)+4

 (绿色)
(绿色)据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了
 使溶液呈绿色。
使溶液呈绿色。丙进行如下实验:
| 操作 | 现象 | |
| 实验3 | i.配制与溶液A的c(H+)相同的HNO3溶液,取20.0mL,通入NO2气体 | 溶液呈黄色 |
| ii.再加0.01molCu(NO3)2固体搅拌至完全溶解 | 溶液变为绿色 | |
| iii.加水稀释 | 溶液立即变蓝 | |
| 实验4 | i.向20.0mL0.5mol/L Cu(NO3)2蓝色溶液中通入少量NO2 | 溶液呈绿色 |
| ii.加入稀H2SO4 | 有无色气体放出,遇空气变红棕色,溶液很快变为蓝色 |
②请用平衡原理解释加入H2SO4后绿色溶液变蓝的原因:
(5)根据实验得出结论:实验1中溶液A呈绿色的主要原因是
您最近一年使用:0次
名校
3 . 某研究小组制备氯气并对产生氯气的条件进行探究。

(1)装置A中用 与浓盐酸反应制取
与浓盐酸反应制取 ,利用了浓HCl的
,利用了浓HCl的___________ (填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是___________ 。
(3)B用于收集 ,请完善装置B并用箭头标明进出气体方向
,请完善装置B并用箭头标明进出气体方向___________ 。
(4)该小组欲研究盐酸的浓度对制 的影响,设计实验进行如下探究。
的影响,设计实验进行如下探究。
①已知 呈弱碱性。Ⅰ中溶液呈浅棕色是由于
呈弱碱性。Ⅰ中溶液呈浅棕色是由于 与浓盐酸发生了复分解反应,化学方程式是
与浓盐酸发生了复分解反应,化学方程式是___________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是___________ 。
③Ⅲ中无明显现象的原因,可能是 或
或 较低,设计实验Ⅳ进行探究:
较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是___________ ;将ⅰ、ⅱ作对比,得出的结论是___________ 。

(1)装置A中用
 与浓盐酸反应制取
与浓盐酸反应制取 ,利用了浓HCl的
,利用了浓HCl的(2)A中产生的气体不纯,含有的杂质可能是
(3)B用于收集
 ,请完善装置B并用箭头标明进出气体方向
,请完善装置B并用箭头标明进出气体方向(4)该小组欲研究盐酸的浓度对制
 的影响,设计实验进行如下探究。
的影响,设计实验进行如下探究。| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将 和 和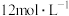 浓盐酸混合 浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热 和 和 稀盐酸混合物 稀盐酸混合物 | 无明显现象 |
 呈弱碱性。Ⅰ中溶液呈浅棕色是由于
呈弱碱性。Ⅰ中溶液呈浅棕色是由于 与浓盐酸发生了复分解反应,化学方程式是
与浓盐酸发生了复分解反应,化学方程式是②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是
 或
或 较低,设计实验Ⅳ进行探究:
较低,设计实验Ⅳ进行探究:
将实验Ⅲ、Ⅳ作对比,得出的结论是
您最近一年使用:0次
名校
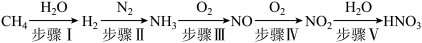
4 . 硝酸是重要的化工原料,工业生产硝酸的流程如下图所示:
已知:ⅰ. 受热易分解为
受热易分解为 、
、 等物质;
等物质;
ⅱ.原子利用率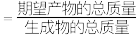 。
。
(1)步骤Ⅰ:制高纯氢
①反应器中初始反应的生成物有两种,且物质的量之比为1:4,甲烷与水蒸气反应的化学方程式是___________ 。
②所得 中含有少量CO气体,影响后续反应催化剂活性,可利用如下反应吸收CO:
中含有少量CO气体,影响后续反应催化剂活性,可利用如下反应吸收CO:
 (注:
(注: 代表
代表 ),利于CO被吸收的反应条件有
),利于CO被吸收的反应条件有___________ (写出两点)。
(2)步骤Ⅱ:合成氨
工业合成氨时,每生成1mol 放出46.1kJ热量,则合成氨的热化学方程式是
放出46.1kJ热量,则合成氨的热化学方程式是___________ 。
(3)步骤Ⅲ和步骤Ⅳ均是放热反应,步骤Ⅴ在反应前需将 冷却。
冷却。
①步骤Ⅴ的化学方程式是___________ 。
②冷却 有利于提高
有利于提高 产率,原因是
产率,原因是___________ (写出一点即可)。
③提高由 转化为
转化为 的整个过程中氮原子利用率的措施是
的整个过程中氮原子利用率的措施是___________ 。

已知:ⅰ.
 受热易分解为
受热易分解为 、
、 等物质;
等物质;ⅱ.原子利用率
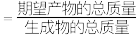 。
。(1)步骤Ⅰ:制高纯氢
①反应器中初始反应的生成物有两种,且物质的量之比为1:4,甲烷与水蒸气反应的化学方程式是
②所得
 中含有少量CO气体,影响后续反应催化剂活性,可利用如下反应吸收CO:
中含有少量CO气体,影响后续反应催化剂活性,可利用如下反应吸收CO:
 (注:
(注: 代表
代表 ),利于CO被吸收的反应条件有
),利于CO被吸收的反应条件有(2)步骤Ⅱ:合成氨
工业合成氨时,每生成1mol
 放出46.1kJ热量,则合成氨的热化学方程式是
放出46.1kJ热量,则合成氨的热化学方程式是(3)步骤Ⅲ和步骤Ⅳ均是放热反应,步骤Ⅴ在反应前需将
 冷却。
冷却。①步骤Ⅴ的化学方程式是
②冷却
 有利于提高
有利于提高 产率,原因是
产率,原因是③提高由
 转化为
转化为 的整个过程中氮原子利用率的措施是
的整个过程中氮原子利用率的措施是
您最近一年使用:0次
名校
解题方法
5 . 某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。该反应的化学方程式为:H2O2+S2O +2H+=S4O
+2H+=S4O +2H2O查阅资料知体系中存在两个主要反应:
+2H2O查阅资料知体系中存在两个主要反应:
反应ⅰ:_________
反应ⅱ:I2+2S2O =2I-+S4O
=2I-+S4O
(1)写出反应I的离子方程式___________
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均0.01mol/L)。
a.向酸化的H2O2溶液中加入___________ 溶液,溶液几秒后变为蓝色。
b.___________ ,溶液立即褪色。
(3)探究 对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为
对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为 )
)
①将b实验补充完整____________ 、____________ 。
②对比实验Ⅰ和实验Ⅱ,
__________  (填“>”或“<”)。
(填“>”或“<”)。
③结合(1)中现象解释溶液混合后一段时间才变蓝的原因___________ 。
④利用实验Ⅰ的数据,计算反应ii在 时间内平均反应速率(用
时间内平均反应速率(用 浓度的变化表示)
浓度的变化表示)___________ 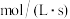 。
。
 +2H+=S4O
+2H+=S4O +2H2O查阅资料知体系中存在两个主要反应:
+2H2O查阅资料知体系中存在两个主要反应:反应ⅰ:_________
反应ⅱ:I2+2S2O
 =2I-+S4O
=2I-+S4O
(1)写出反应I的离子方程式
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均0.01mol/L)。
a.向酸化的H2O2溶液中加入
b.
(3)探究
 对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为
对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为 )
)| 实验序号 | Ⅰ | Ⅱ | |
| 试剂 | 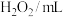 | 5 | ① |
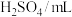 | 4 | 2 | |
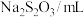 | 8 | 8 | |
 (含淀粉) (含淀粉) | 3 | 3 | |
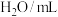 | 0 | ② | |
| 将上述溶液迅速混合观察现象 | 溶液变蓝所需时间为t1秒 | 溶液变蓝所需时间为t2秒 | |
②对比实验Ⅰ和实验Ⅱ,

 (填“>”或“<”)。
(填“>”或“<”)。③结合(1)中现象解释溶液混合后一段时间才变蓝的原因
④利用实验Ⅰ的数据,计算反应ii在
 时间内平均反应速率(用
时间内平均反应速率(用 浓度的变化表示)
浓度的变化表示)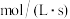 。
。
您最近一年使用:0次
名校
解题方法
6 . 某铬渣主要含有 以及少量的
以及少量的 、
、 等杂质,某研究小组设计以下流程获取
等杂质,某研究小组设计以下流程获取 ,实现铬渣资源化。
,实现铬渣资源化。

资料:
a.焙烧中加入氧化钙的目的是防止物料烧结,并提高物料焙烧温度。
b.常温下,水溶液中存在
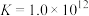 。
。
c. 与
与 类似,均具有两性。
类似,均具有两性。
d。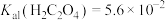
(1)为提高“酸浸”速率,可采取的措施有______ (至少写出两条)。
(2)焙烧时, 被
被 氧化为
氧化为 ,产物中还有
,产物中还有 ,写出该反应的化学方程式
,写出该反应的化学方程式______ 。
(3)滤液A中加入 发生的氧化反应:
发生的氧化反应: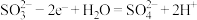 。
。
①实验表明,酸浸时调节pH越低,最终得到的铬回收率越高,原因是______ 。
②当加入 过量,过量的
过量,过量的 与
与 形成配合物
形成配合物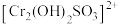 而稳定存在,对铬回收率的影响是
而稳定存在,对铬回收率的影响是______ (填“增大”、“减小”、或者“不影响”),理由是______ 。
(4)滤液A中 发生反应的离子方程式是
发生反应的离子方程式是______ 。
(5)草酸“除铁”的离子方程式是______ 。
(6)90℃时,加入 调节pH,不同pH对铬沉淀率的影响如下图所示,请解释铬沉淀率随着pH先增大后减小的原因
调节pH,不同pH对铬沉淀率的影响如下图所示,请解释铬沉淀率随着pH先增大后减小的原因______ 。

 以及少量的
以及少量的 、
、 等杂质,某研究小组设计以下流程获取
等杂质,某研究小组设计以下流程获取 ,实现铬渣资源化。
,实现铬渣资源化。
资料:
a.焙烧中加入氧化钙的目的是防止物料烧结,并提高物料焙烧温度。
b.常温下,水溶液中存在

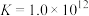 。
。c.
 与
与 类似,均具有两性。
类似,均具有两性。d。
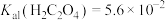
(1)为提高“酸浸”速率,可采取的措施有
(2)焙烧时,
 被
被 氧化为
氧化为 ,产物中还有
,产物中还有 ,写出该反应的化学方程式
,写出该反应的化学方程式(3)滤液A中加入
 发生的氧化反应:
发生的氧化反应: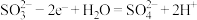 。
。①实验表明,酸浸时调节pH越低,最终得到的铬回收率越高,原因是
②当加入
 过量,过量的
过量,过量的 与
与 形成配合物
形成配合物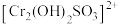 而稳定存在,对铬回收率的影响是
而稳定存在,对铬回收率的影响是(4)滤液A中
 发生反应的离子方程式是
发生反应的离子方程式是(5)草酸“除铁”的离子方程式是
(6)90℃时,加入
 调节pH,不同pH对铬沉淀率的影响如下图所示,请解释铬沉淀率随着pH先增大后减小的原因
调节pH,不同pH对铬沉淀率的影响如下图所示,请解释铬沉淀率随着pH先增大后减小的原因
您最近一年使用:0次
名校
7 . 实验小组利用如下图所示的装置制备氯气及探究氯气的性质。
资料:单质碘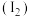 遇淀粉溶液变蓝,利用此现象可检验溶液中的
遇淀粉溶液变蓝,利用此现象可检验溶液中的 。
。
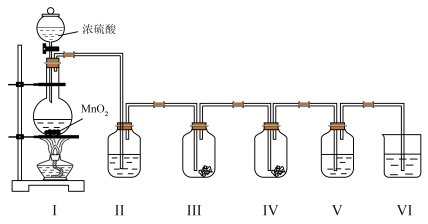
(1)Ⅰ中制备氯气时,发生反应的化学方程式是_______
(2)Ⅱ的目的是除去氯气中的水蒸气,则瓶中盛放的试剂是_______ 。
(3)利用Ⅲ、Ⅳ装置探究氯气与水反应的产物。
①实验前,向Ⅲ、Ⅳ中均放入干燥蓝色石蕊纸花,并向_______ 中滴少量水将纸花润湿。
②实验时,根据Ⅲ中的纸花不变色及_______ 现象,甲同学得出初步结论:氯气与水反应生成具有酸性及漂白性的物质。
③同学们分析后,认为用该实验装置不能得出“氯气与水反应有酸性物质生成”的结论,理由是_______ 。
(4)Ⅴ中盛有 淀粉溶液,随
淀粉溶液,随 通入,可获得
通入,可获得 具有氧化性的实验证据是
具有氧化性的实验证据是_______ 。
(5)Ⅵ中盛放的试剂是 溶液,其作用是
溶液,其作用是_______ ,发生反应的离子方程式是_______ 。
(6)利用如下装置也可以制取氯气,并利用氯气的氧化性制取 。
。
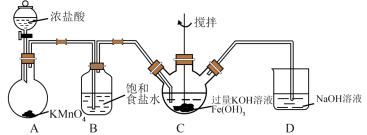
①装置A中, 被还原为
被还原为 ,写出反应的离子方程式:
,写出反应的离子方程式:_______ 。
②装置C中发生如下反应,将方程式配平:_______ 。
资料:单质碘
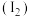 遇淀粉溶液变蓝,利用此现象可检验溶液中的
遇淀粉溶液变蓝,利用此现象可检验溶液中的 。
。
(1)Ⅰ中制备氯气时,发生反应的化学方程式是
(2)Ⅱ的目的是除去氯气中的水蒸气,则瓶中盛放的试剂是
(3)利用Ⅲ、Ⅳ装置探究氯气与水反应的产物。
①实验前,向Ⅲ、Ⅳ中均放入干燥蓝色石蕊纸花,并向
②实验时,根据Ⅲ中的纸花不变色及
③同学们分析后,认为用该实验装置不能得出“氯气与水反应有酸性物质生成”的结论,理由是
(4)Ⅴ中盛有
 淀粉溶液,随
淀粉溶液,随 通入,可获得
通入,可获得 具有氧化性的实验证据是
具有氧化性的实验证据是(5)Ⅵ中盛放的试剂是
 溶液,其作用是
溶液,其作用是(6)利用如下装置也可以制取氯气,并利用氯气的氧化性制取
 。
。
①装置A中,
 被还原为
被还原为 ,写出反应的离子方程式:
,写出反应的离子方程式:②装置C中发生如下反应,将方程式配平:
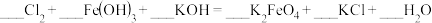
您最近一年使用:0次
23-24高三上·北京·阶段练习
解题方法
8 . 金属钒主要用于冶炼特种钢,被誉为“合金的维生素”。黏土钒矿主要成分为钒的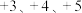 价的化合物以及
价的化合物以及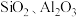 等,以黏土钒矿为原料提取金属钒的工艺流程通常有以下两种路线:
等,以黏土钒矿为原料提取金属钒的工艺流程通常有以下两种路线: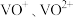 形式存在。
形式存在。
②钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数 与
与 的关系如图所示。
的关系如图所示。
①“气体X”和“气体Y”的化学式分别为___________ 、___________ 。
②写出“高温氧化”过程中发生反应的化学方程式___________ 。
③结合化学用语解释加入 溶液的作用
溶液的作用___________ 。
④写出沉钒时的离子方程式___________ 。
(2)关于路线2请分析:
①写出“酸浸氧化”时 转化为
转化为 发生反应的离子方程式
发生反应的离子方程式___________ 。
②加入 控制溶液的
控制溶液的 ,其目的是
,其目的是___________ 。
③沉钒时控制溶液 约为7,生成偏钒酸铵(NH4VO3)固体。沉钒率随温度变化如图,温度高于
约为7,生成偏钒酸铵(NH4VO3)固体。沉钒率随温度变化如图,温度高于 ,沉钒率下降的原因是
,沉钒率下降的原因是___________ 。___________ 。
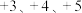 价的化合物以及
价的化合物以及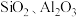 等,以黏土钒矿为原料提取金属钒的工艺流程通常有以下两种路线:
等,以黏土钒矿为原料提取金属钒的工艺流程通常有以下两种路线:路线1:
路线2:
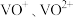 形式存在。
形式存在。②钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数
 与
与 的关系如图所示。
的关系如图所示。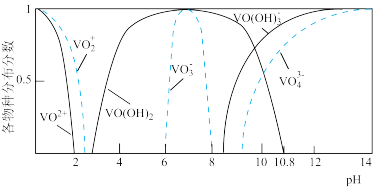
①“气体X”和“气体Y”的化学式分别为
②写出“高温氧化”过程中发生反应的化学方程式
③结合化学用语解释加入
 溶液的作用
溶液的作用④写出沉钒时的离子方程式
(2)关于路线2请分析:
①写出“酸浸氧化”时
 转化为
转化为 发生反应的离子方程式
发生反应的离子方程式②加入
 控制溶液的
控制溶液的 ,其目的是
,其目的是③沉钒时控制溶液
 约为7,生成偏钒酸铵(NH4VO3)固体。沉钒率随温度变化如图,温度高于
约为7,生成偏钒酸铵(NH4VO3)固体。沉钒率随温度变化如图,温度高于 ,沉钒率下降的原因是
,沉钒率下降的原因是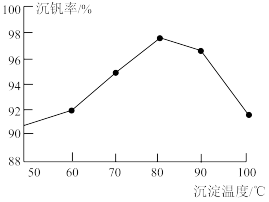
您最近一年使用:0次
名校
9 . 研究小组探究高铜酸钠(NaCuO2)的制备和性质。
资料:高铜酸钠为棕黑色固体,难溶于水。
【实验I】向2mL1mol/LNaClO溶液中滴加1mL1mol/LCuCl2溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。
(1) CuCl2溶液显酸性,用离子方程式解释原因:_____ ;制备时滴加的CuCl2溶液不宜过量。
探究棕黑色沉淀的组成。
【实验Ⅱ】将一份浊液a过滤、洗涤、干燥,得到固体b.取少量固体b,滴加稀H2SO4,沉淀溶解,有气泡产生,得到蓝色溶液。
(2)①另取少量固体b进行实验,证实了固体中钠元素的存在,实验操作的名称是______ 。
②经进一步检验确认棕黑色固体是NaCuO2。NaCuO2与稀H2SO4反应的离子方程式是______ 。
探究实验条件对NaCuO2制备的影响。
【实验Ⅲ】向另一份浊液a中继续滴加1.5mLlmol/L CuCl2溶液,沉淀由棕黑色变为蓝绿色,溶液的pH约为5,有产生。
(3)①对Cl2的来源,甲同学认为是NaCuO2和 反应生成了Cl2,乙同学认为该说法不严谨,提出了生成Cl2的其他原因:
反应生成了Cl2,乙同学认为该说法不严谨,提出了生成Cl2的其他原因:___________ 。
②探究继续滴加CuCl2溶液,NaCuO2能氧化Cl-的原因。
i.提出假设1:c(Cl-)增大,Cl-的还原性增强。实验证明假设成立。
操作和现象是:取少量NaCuO2固体于试管中,___________ 。
ii.提出假设2:___________ ,经证实该假设也成立。
【实验Ⅳ】向1mL1mol/LNaClO溶液中滴加0.5mL1mol/LCuSO4溶液,迅速生成蓝色沉淀,振荡后得到棕黑色浊液。浊液放置过程中,沉淀表面缓慢产生气泡并出现蓝色固体,该气体能使带火星木条复燃但不能使湿润的淀粉KI试纸变蓝。
(4)通过以上实验,对于NaCuO2化学性质的认识是___________ 。
(5)根据上述实验,制备在水溶液中稳定存在的NaCuO2,应选用的试剂是NaClO溶液、___________ 溶液和___________ 溶液。
资料:高铜酸钠为棕黑色固体,难溶于水。
【实验I】向2mL1mol/LNaClO溶液中滴加1mL1mol/LCuCl2溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。
(1) CuCl2溶液显酸性,用离子方程式解释原因:
探究棕黑色沉淀的组成。
【实验Ⅱ】将一份浊液a过滤、洗涤、干燥,得到固体b.取少量固体b,滴加稀H2SO4,沉淀溶解,有气泡产生,得到蓝色溶液。
(2)①另取少量固体b进行实验,证实了固体中钠元素的存在,实验操作的名称是
②经进一步检验确认棕黑色固体是NaCuO2。NaCuO2与稀H2SO4反应的离子方程式是
探究实验条件对NaCuO2制备的影响。
【实验Ⅲ】向另一份浊液a中继续滴加1.5mLlmol/L CuCl2溶液,沉淀由棕黑色变为蓝绿色,溶液的pH约为5,有产生。
(3)①对Cl2的来源,甲同学认为是NaCuO2和
 反应生成了Cl2,乙同学认为该说法不严谨,提出了生成Cl2的其他原因:
反应生成了Cl2,乙同学认为该说法不严谨,提出了生成Cl2的其他原因:②探究继续滴加CuCl2溶液,NaCuO2能氧化Cl-的原因。
i.提出假设1:c(Cl-)增大,Cl-的还原性增强。实验证明假设成立。
操作和现象是:取少量NaCuO2固体于试管中,
ii.提出假设2:
【实验Ⅳ】向1mL1mol/LNaClO溶液中滴加0.5mL1mol/LCuSO4溶液,迅速生成蓝色沉淀,振荡后得到棕黑色浊液。浊液放置过程中,沉淀表面缓慢产生气泡并出现蓝色固体,该气体能使带火星木条复燃但不能使湿润的淀粉KI试纸变蓝。
(4)通过以上实验,对于NaCuO2化学性质的认识是
(5)根据上述实验,制备在水溶液中稳定存在的NaCuO2,应选用的试剂是NaClO溶液、
您最近一年使用:0次
名校
10 . 高铁酸钾(K2FeO4)是一种新型的污水处理剂。
(1) K2FeO4的制备
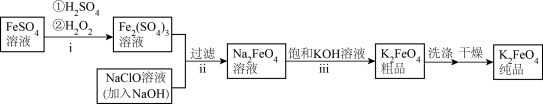
①i中反应的离子方程式是___________ 。
②将ii中反应的离子方程式补充完整:___________ 。
□ □
□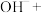 □
□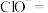 □
□ □___________
□___________ □___________
□___________
③iii中反应能够发生是因为溶解度:Na2FeO4___________ K2FeO4 (填“>”或“<”)。
(2) K2FeO4的性质
i.将K2FeO4固体溶于蒸馏水中,有少量无色气泡(O2),液体有丁达尔效应。
ii.将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
iii.将K2FeO4固体溶于稀硫酸中,产生无色气泡的速率明显比ⅰ快。
①K2FeO4溶于蒸馏水的化学反应方程式是___________ 。
②K2FeO4的氧化性与溶液pH的关系是___________ 。
(3) K2FeO4的应用
K2FeO4可用于生活垃圾渗透液的脱氮(将 转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如图所示:
转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如图所示:

①脱氮的最佳pH约为8,pH小于8时,脱氮效果随pH减小而减弱,结合 转化为N2的氧化反应分析原因:
转化为N2的氧化反应分析原因:___________ 。
②pH大于8时,脱氮效果随pH的升高而减弱,分析可能的原因:___________ 。
(1) K2FeO4的制备

①i中反应的离子方程式是
②将ii中反应的离子方程式补充完整:
□
 □
□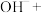 □
□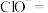 □
□ □___________
□___________ □___________
□___________③iii中反应能够发生是因为溶解度:Na2FeO4
(2) K2FeO4的性质
i.将K2FeO4固体溶于蒸馏水中,有少量无色气泡(O2),液体有丁达尔效应。
ii.将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
iii.将K2FeO4固体溶于稀硫酸中,产生无色气泡的速率明显比ⅰ快。
①K2FeO4溶于蒸馏水的化学反应方程式是
②K2FeO4的氧化性与溶液pH的关系是
(3) K2FeO4的应用
K2FeO4可用于生活垃圾渗透液的脱氮(将
 转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如图所示:
转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如图所示:
①脱氮的最佳pH约为8,pH小于8时,脱氮效果随pH减小而减弱,结合
 转化为N2的氧化反应分析原因:
转化为N2的氧化反应分析原因:②pH大于8时,脱氮效果随pH的升高而减弱,分析可能的原因:
您最近一年使用:0次



