1 . 高铁酸钾(K2FeO4)是新型高效净水剂,某实验小组制备K2FeO4并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中反应的离子方程式为_______ 。
②请在B方框内将除杂装置补充完整,并标明所用试剂_______ 。
③C中得到紫色固体和溶液。C中主要反应的化学方程式为_______ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
由方案Ⅰ中溶液变红可知a中含有的离子为_______ ,但该离子的产生不能判断一定是由Cl-还原K2FeO4得到的,该离子还可能由_______ 产生(用离子方程式表示)。
②根据K2FeO4的制备实验得出:氧化性Cl2_______  (填“>”或“<”),由方案Ⅱ实验表明,Cl2和
(填“>”或“<”),由方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中反应的离子方程式为
②请在B方框内将除杂装置补充完整,并标明所用试剂
③C中得到紫色固体和溶液。C中主要反应的化学方程式为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),由方案Ⅱ实验表明,Cl2和
(填“>”或“<”),由方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
2 . 钨冶炼渣主要含锰、铁、钙、镁、硅的氧化物及少量重金属盐。工业上利用钨冶炼渣制备电池级硫酸锰(含MnSO4的质量分数98%以上)的工艺如图所示。
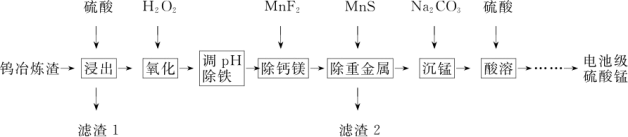
回答下列问题:
(1)为提高钨冶炼渣的浸出速率,可采用的方法有___________ (写出2种)。“滤渣 1”的主要成分是___________ 。
(2)写出“氧化”步骤的离子方程式___________ 。
(3)“调 pH除铁”步骤中的最优试剂是___________ 。
A.H2SO4 B.CO2 C.NaOH D.MnCO3
(4)为使Ca2+和 Mg2+完全沉淀,除去钙镁后的溶液中c(F-)应不低于___________ mol/L。[已知:Ksp(CaF2)=1.6×10-10,Ksp(MgF2)=9×10-11]。
(5)“沉锰”步骤的化学方程式为___________ 。

回答下列问题:
(1)为提高钨冶炼渣的浸出速率,可采用的方法有
(2)写出“氧化”步骤的离子方程式
(3)“调 pH除铁”步骤中的最优试剂是
A.H2SO4 B.CO2 C.NaOH D.MnCO3
(4)为使Ca2+和 Mg2+完全沉淀,除去钙镁后的溶液中c(F-)应不低于
(5)“沉锰”步骤的化学方程式为
您最近一年使用:0次
2021-01-14更新
|
283次组卷
|
4卷引用:辽宁省2020-2021学年高二上学期期末考试化学试题
解题方法
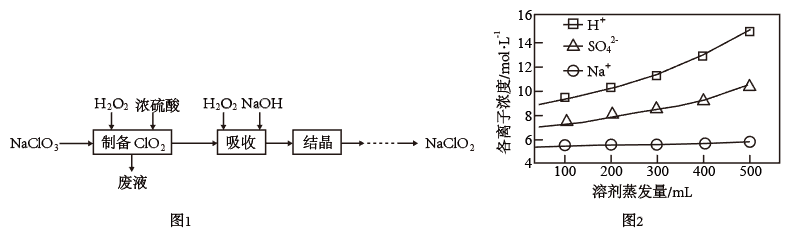
3 . 过氧化氢法制备亚氯酸钠(NaClO2)的流程如图1:
已知:①NaClO2常温下稳定,潮湿的NaClO2加热到130℃分解。
②ClO2气体在碱性溶液中会转化为ClO 和ClO
和ClO 。
。
(1)制备ClO2气体的化学方程式为_______ 。
(2)取1L废液,蒸发结晶,测定不同蒸发量下,残留液中各离子的浓度如图2,则析出的晶体为_______ (填化学式)。
(3)吸收时的主要反应为2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O。
①吸收时,需控制反应温度为3℃,可采取的措施为_______ 。
②温度过高,产品的纯度会降低,主要原因是_______ 。
(4)从NaClO2溶液获得产品的可行措施有_______ (填序号)。
a.减压蒸发 b.溶液雾状喷出干燥 c.300℃热空气烘干
(5)准确称取所得亚氯酸钠样品mg于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知ClO +4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的1/10于锥形瓶中,加几滴淀粉溶液,用cmol•L-lNa2S2O3标准液滴定,重复3次,测得平均消耗标准液VmL(已知I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的1/10于锥形瓶中,加几滴淀粉溶液,用cmol•L-lNa2S2O3标准液滴定,重复3次,测得平均消耗标准液VmL(已知I2+2S2O =2I-+S4O
=2I-+S4O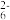 ),该样品中NaClO2的纯度为
),该样品中NaClO2的纯度为_______ (用含m、c、V的代数式表示)。

已知:①NaClO2常温下稳定,潮湿的NaClO2加热到130℃分解。
②ClO2气体在碱性溶液中会转化为ClO
 和ClO
和ClO 。
。(1)制备ClO2气体的化学方程式为
(2)取1L废液,蒸发结晶,测定不同蒸发量下,残留液中各离子的浓度如图2,则析出的晶体为
(3)吸收时的主要反应为2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O。
①吸收时,需控制反应温度为3℃,可采取的措施为
②温度过高,产品的纯度会降低,主要原因是
(4)从NaClO2溶液获得产品的可行措施有
a.减压蒸发 b.溶液雾状喷出干燥 c.300℃热空气烘干
(5)准确称取所得亚氯酸钠样品mg于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知ClO
 +4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的1/10于锥形瓶中,加几滴淀粉溶液,用cmol•L-lNa2S2O3标准液滴定,重复3次,测得平均消耗标准液VmL(已知I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的1/10于锥形瓶中,加几滴淀粉溶液,用cmol•L-lNa2S2O3标准液滴定,重复3次,测得平均消耗标准液VmL(已知I2+2S2O =2I-+S4O
=2I-+S4O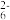 ),该样品中NaClO2的纯度为
),该样品中NaClO2的纯度为
您最近一年使用:0次
名校
解题方法
4 . 铬是人体必需的微量元素,对维持人体正常的生理功能有着重要的作用。铬是胰岛素不可缺少的辅助成分,它参与糖代谢过程,能够促进脂肪和蛋白质的合成,对于人体的生长发育起着积极的促进作用。虽然铬对维护人体健康有着十分重要的作用,但食用不当也会带来很大的危害。由于无机铬很不容易被人体所吸收,铬只有以有机化合物的形式进入人体内才能被吸收。而在铬的化合物中,六价铬具有很强的毒性,尤以铬酸盐和重铬酸盐的毒性最为突出。
(1)铬原子的基态电子排布式为_______ 。
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5℃、沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①丙酮中碳原子采取的杂化方式为_______ ;
②CS2属于_______ (填极性”或“非极性”)分子,其电子式为_______ ;
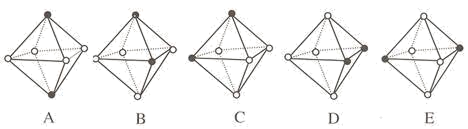
(3)CrCl3·6H2O(相对分子质量为266.5)有多种不同颜色的异构体(均是配合物,配位数为6)。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665gCrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为_______ (填化学式)。下列是暗绿色晶体配离子的空间结构(中心原子位于正八面体的中心,已省去),其中B与_______ 具有完全相同的结构。(填字母)
(4)六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,使其转化为毒性较低的Cr(III)。最常见的是铁氧磁体法,即把FeSO4·7H2O加入含Cr(VI)的废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III),调节溶液pH达8~10,使溶液中的Fe(II)、Fe(III)、Cr(III)析出组成相当于Fe(II)[Fex(III)·Cr2-x(III)]O4(磁性材料铁氧体的组成)沉淀。试回答:
①若废水中六价铬以Cr2O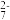 存在。试写出在酸性条件下硫酸亚铁还原Cr2O
存在。试写出在酸性条件下硫酸亚铁还原Cr2O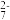 的离子方程式并配平
的离子方程式并配平_______ 。
②根据上述结果可确定铁氧磁体中x=_______ 。
(1)铬原子的基态电子排布式为
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5℃、沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①丙酮中碳原子采取的杂化方式为
②CS2属于
(3)CrCl3·6H2O(相对分子质量为266.5)有多种不同颜色的异构体(均是配合物,配位数为6)。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665gCrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为

(4)六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,使其转化为毒性较低的Cr(III)。最常见的是铁氧磁体法,即把FeSO4·7H2O加入含Cr(VI)的废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III),调节溶液pH达8~10,使溶液中的Fe(II)、Fe(III)、Cr(III)析出组成相当于Fe(II)[Fex(III)·Cr2-x(III)]O4(磁性材料铁氧体的组成)沉淀。试回答:
①若废水中六价铬以Cr2O
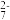 存在。试写出在酸性条件下硫酸亚铁还原Cr2O
存在。试写出在酸性条件下硫酸亚铁还原Cr2O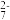 的离子方程式并配平
的离子方程式并配平②根据上述结果可确定铁氧磁体中x=
您最近一年使用:0次
2021-01-09更新
|
379次组卷
|
2卷引用:辽宁省五校2021届高三上学期期末联考化学试题
5 . 磷酸亚铁锂是锂离子电池中常用的正极材料, (磷酸铁)是制备磷酸亚铁锂的前驱体。用磷铁渣(含Fe、FeP、
(磷酸铁)是制备磷酸亚铁锂的前驱体。用磷铁渣(含Fe、FeP、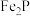 及
及 )制备
)制备 的工艺流程如下:
的工艺流程如下:
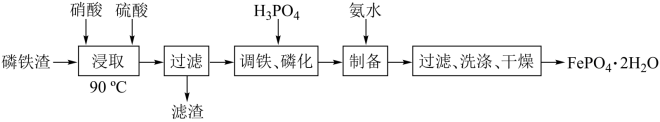
已知 溶于强酸。
溶于强酸。
(1)锂在元素周期表中的位置为___________ 。 的电离方程式为
的电离方程式为___________ 。
(2)“浸取”时,在密闭反应器中依次加入硝酸、硫酸,硝酸首先分解生成 和
和 ,
, 将铁和磷分别氧化为
将铁和磷分别氧化为 、
、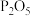 。
。
①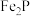 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
②加入硫酸的目的是___________ 。
(3)“制备”时发生反应的离子方程式为___________ ;上述流程制得的 中含有的杂质是
中含有的杂质是___________ 。
(4) 与
与 及C在高温条件下生成
及C在高温条件下生成 和等物质的量的
和等物质的量的 、CO,该反应中还原剂与氧化剂的物质的量之比为
、CO,该反应中还原剂与氧化剂的物质的量之比为___________ 。
 (磷酸铁)是制备磷酸亚铁锂的前驱体。用磷铁渣(含Fe、FeP、
(磷酸铁)是制备磷酸亚铁锂的前驱体。用磷铁渣(含Fe、FeP、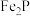 及
及 )制备
)制备 的工艺流程如下:
的工艺流程如下:
已知
 溶于强酸。
溶于强酸。(1)锂在元素周期表中的位置为
 的电离方程式为
的电离方程式为(2)“浸取”时,在密闭反应器中依次加入硝酸、硫酸,硝酸首先分解生成
 和
和 ,
, 将铁和磷分别氧化为
将铁和磷分别氧化为 、
、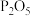 。
。①
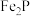 与
与 反应的化学方程式为
反应的化学方程式为②加入硫酸的目的是
(3)“制备”时发生反应的离子方程式为
 中含有的杂质是
中含有的杂质是(4)
 与
与 及C在高温条件下生成
及C在高温条件下生成 和等物质的量的
和等物质的量的 、CO,该反应中还原剂与氧化剂的物质的量之比为
、CO,该反应中还原剂与氧化剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
6 . 镍是一种常用的有机催化剂,且在电磁领域应用广泛。某工厂以含镍废料(主要含NiO、Fe2O3、FeO、Al2O3、SiO2、CaO)为原料制备镍单质的流程如图:
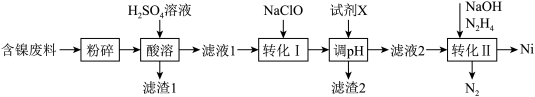
已知:ⅰ.Ni2+在弱酸性环境中易水解,氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度);
ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Fe(OH)2]=8×10-16,Ksp[Al(OH)3]=1×10-33,Ksp[Ni(OH)2]=2×10-15,离子浓度低于1×10-5 mol·L-1时,认为沉淀完全。
回答下列问题:
(1)“粉碎”的目的是___________ ;“滤渣1”的主要成分为___________ 、___________ 。
(2)“转化Ⅰ”的目的为___________ (用离子方程式表示)。
(3)为了更加环保,有人用H2O2代替NaClO进行“转化Ⅰ”,发现所用H2O2远远高于理论用量,分析造成这一结果的原因为___________ 。
(4)调pH的目的是沉淀溶液中的铁和铝,调节pH=5时,___________ (选填“能”或“不能”)达到目的,“试剂X”可以是___________ (填选项字母)。
A.FeO B.Fe2O3 C.NiO D.Al2O3
(5)N2H4的电子式为___________ ;“转化Ⅱ”中发生反应的离子方程式为___________ 。

已知:ⅰ.Ni2+在弱酸性环境中易水解,氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度);
ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Fe(OH)2]=8×10-16,Ksp[Al(OH)3]=1×10-33,Ksp[Ni(OH)2]=2×10-15,离子浓度低于1×10-5 mol·L-1时,认为沉淀完全。
回答下列问题:
(1)“粉碎”的目的是
(2)“转化Ⅰ”的目的为
(3)为了更加环保,有人用H2O2代替NaClO进行“转化Ⅰ”,发现所用H2O2远远高于理论用量,分析造成这一结果的原因为
(4)调pH的目的是沉淀溶液中的铁和铝,调节pH=5时,
A.FeO B.Fe2O3 C.NiO D.Al2O3
(5)N2H4的电子式为
您最近一年使用:0次
2020-12-24更新
|
282次组卷
|
2卷引用:辽宁省兴城市高级中学2022-2023学年高二上学期期末线上质量检测化学试题
7 . 按要求回答问题
(1)有下列物质:①石墨;②氯水;③氢氧化钠固体;④稀硫酸;⑤熔融氯化钾;⑥醋酸;
⑦液态氯化氢;⑧硫酸钡;⑨液氨;⑩蔗糖。
其中属于电解质的有_____ ;属于非电解质的有______ .(填编号)
(2)某无色透明溶液中可能含有K+、Fe2+、Fe3+、Mg2+、Ba2+、 、Cl-、
、Cl-、 、
、 、
、 中的若干种离子。某同学取 50 mL 的溶液进行如下实验:
中的若干种离子。某同学取 50 mL 的溶液进行如下实验:
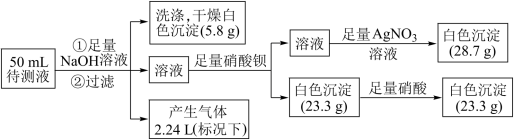
根据实验判断下列说法中正确的是_____
A.原溶液中一定只含有 、Mg2+、
、Mg2+、 、Cl-
、Cl-
B.原溶液中一定不存在 Fe2+、Fe3+、Ba2+、 、
、
C.原溶液中可能含有
D.原溶液中 c(K+)=2mol/L
(3)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O=Se+2 +4H+,则SeO2、H2SO4(浓)、SO2 的氧化性由强到弱的顺序是
+4H+,则SeO2、H2SO4(浓)、SO2 的氧化性由强到弱的顺序是_____ 。
(4)已知 4NO2+2CO(NH2)2→2CO2+4N2+4H2O+O2(已知尿素中 N 为-3 价),该反应的氧化产物为_____ ;若吸收 0.15mol NO2,则转移电子_____ mol。
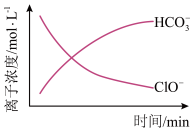
(5)处理某废水时,反应过程中部分离子浓度与反应进程 关系如图,反应过程中主要存在 N2、 、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式
、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式__ 。
(1)有下列物质:①石墨;②氯水;③氢氧化钠固体;④稀硫酸;⑤熔融氯化钾;⑥醋酸;
⑦液态氯化氢;⑧硫酸钡;⑨液氨;⑩蔗糖。
其中属于电解质的有
(2)某无色透明溶液中可能含有K+、Fe2+、Fe3+、Mg2+、Ba2+、
 、Cl-、
、Cl-、 、
、 、
、 中的若干种离子。某同学取 50 mL 的溶液进行如下实验:
中的若干种离子。某同学取 50 mL 的溶液进行如下实验:
根据实验判断下列说法中正确的是
A.原溶液中一定只含有
 、Mg2+、
、Mg2+、 、Cl-
、Cl-B.原溶液中一定不存在 Fe2+、Fe3+、Ba2+、
 、
、
C.原溶液中可能含有

D.原溶液中 c(K+)=2mol/L
(3)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O=Se+2
 +4H+,则SeO2、H2SO4(浓)、SO2 的氧化性由强到弱的顺序是
+4H+,则SeO2、H2SO4(浓)、SO2 的氧化性由强到弱的顺序是(4)已知 4NO2+2CO(NH2)2→2CO2+4N2+4H2O+O2(已知尿素中 N 为-3 价),该反应的氧化产物为
(5)处理某废水时,反应过程中部分离子浓度与反应进程 关系如图,反应过程中主要存在 N2、
 、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式
、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式
您最近一年使用:0次
解题方法
8 . 四氧化三锰既是磁性材料锰锌铁氧体(ZnaMnbFecO4,Fe元素为+3价,Zn、Mn元素化合价相同)的重要生产原料,也常被用作氮氧化物分解的催化剂。近年来对制备高品质四氧化三锰的研究越来越受到重视。以硫酸锰为原料制备四氧化三锰的工艺流程如图:
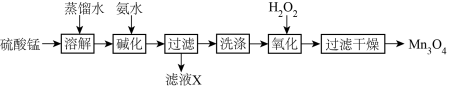
回答下列问题:
(1)“溶解”时需用玻璃棒,其作用为_____ 。
(2)“碱化”时反应离子方程式为______ 。
(3)滤液X中含有的溶质为_____ (填化学式)。
(4)简述“碱化”得到的沉淀是否洗涤干净的方法:_______ 。
(5)“氧化”时发生的化学反应方程式为_____ 。
(6)取30.2gMnSO4经上述工艺过程后,生成____ g Mn3O4(假设Mn元素不损失)。

回答下列问题:
(1)“溶解”时需用玻璃棒,其作用为
(2)“碱化”时反应离子方程式为
(3)滤液X中含有的溶质为
(4)简述“碱化”得到的沉淀是否洗涤干净的方法:
(5)“氧化”时发生的化学反应方程式为
(6)取30.2gMnSO4经上述工艺过程后,生成
您最近一年使用:0次
解题方法
9 . 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
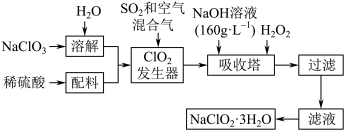
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO3•3H2O;
②纯ClO2易分解爆炸, 一般用稀有气体或空气稀释到 10% 以下较安全;
③HClO2 可看成是强酸;
④ClO2常温下为气态 。
(1)160 g•L-1 NaOH溶液的物质的量浓度为______________ mol•L-1,若要计算该溶液溶质的质量分数,还需要的一个条件是_______________________ 。
(2)在发生器中鼓入空气的作用可能是______________ (填序号)。
A. 将 SO2氧化成SO3,增强酸性
B. 稀释 ClO2以防止爆炸
C. 将 NaClO3氧化成ClO2
(3)ClO2 发生器中发生的化学反应方程式为_____ ,吸收塔内的反应的离子反应方程式为_______ ;
(4)吸收塔中为防止 NaClO2被 还原成 NaCl所用还原剂的还原性应适中。 除H2O2外,还可以选择的还原剂是_____ (填序号)。
A Na2O2 B Na2S C FeCl2 D O3

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO3•3H2O;
②纯ClO2易分解爆炸, 一般用稀有气体或空气稀释到 10% 以下较安全;
③HClO2 可看成是强酸;
④ClO2常温下为气态 。
(1)160 g•L-1 NaOH溶液的物质的量浓度为
(2)在发生器中鼓入空气的作用可能是
A. 将 SO2氧化成SO3,增强酸性
B. 稀释 ClO2以防止爆炸
C. 将 NaClO3氧化成ClO2
(3)ClO2 发生器中发生的化学反应方程式为
(4)吸收塔中为防止 NaClO2被 还原成 NaCl所用还原剂的还原性应适中。 除H2O2外,还可以选择的还原剂是
A Na2O2 B Na2S C FeCl2 D O3
您最近一年使用:0次
10 . 氮的氧化物和硫的氧化物是主要的大气污染物,烟气脱硫脱硝是环境治理的热点问题。回答下列问题:
(1)目前柴油汽车都用尿素水解液消除汽车尾气中的NO,水解液中的NH3将NO还原为无害的物质。该反应中氧化剂与还原剂物质的量之比为___ 。
(2)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO 。
。
①KMnO4脱硫(SO2)的离子方程式为___ 。
②KMnO4/CaCO3浆液中KMnO4与CaCO3最合适的物质的量之比为___ 。
(3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如图所示:

图a和图b中可知脱硫脱硝最佳条件是___ 。
(1)目前柴油汽车都用尿素水解液消除汽车尾气中的NO,水解液中的NH3将NO还原为无害的物质。该反应中氧化剂与还原剂物质的量之比为
(2)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO
 。
。①KMnO4脱硫(SO2)的离子方程式为
②KMnO4/CaCO3浆液中KMnO4与CaCO3最合适的物质的量之比为
(3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如图所示:

图a和图b中可知脱硫脱硝最佳条件是
您最近一年使用:0次



