解题方法
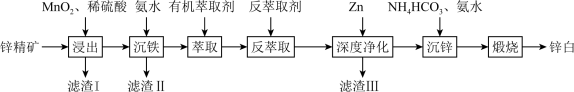
1 . 氧化锌又称锌白,作为添加剂在多种材料和产品中有广泛应用,一种以锌精矿(主要成分是ZnS,还有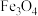 、CuO、
、CuO、 等杂质)为原料制备锌白的工艺流程如下:
等杂质)为原料制备锌白的工艺流程如下:
已知:25℃时相关物质的 如下表:
如下表:
回答下列问题:
(1)滤渣Ⅰ的主要成分除过量 外,还有S和
外,还有S和_______ (填化学式)。“浸出”时, 氧化ZnS的离子方程式为
氧化ZnS的离子方程式为_______ 。
(2)“沉铁”时,滴加氨水需要调节pH最低为_______ (通常认为残留在溶液中离子浓度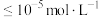 时,沉淀完全)。
时,沉淀完全)。
(3)“萃取,反萃取”时发生的反应是 。有机萃取剂能分离
。有机萃取剂能分离 和
和 ,为了提高反萃取效率,反萃取剂应该呈
,为了提高反萃取效率,反萃取剂应该呈_______ (填“酸”“碱”或“中”)性。
(4)“深度净化”中加Zn的目的是_______ 。
(5)“沉锌”时,恰好完全反应,过滤、洗涤得到碱式碳酸锌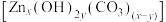 ,反应的离子方程式为
,反应的离子方程式为_______ 。检验沉淀洗涤干净的方法是_______ 。
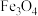 、CuO、
、CuO、 等杂质)为原料制备锌白的工艺流程如下:
等杂质)为原料制备锌白的工艺流程如下:
已知:25℃时相关物质的
 如下表:
如下表:| 物质 |  |  |  |  |  |
 | 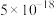 | 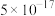 | 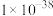 | 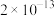 |  |
(1)滤渣Ⅰ的主要成分除过量
 外,还有S和
外,还有S和 氧化ZnS的离子方程式为
氧化ZnS的离子方程式为(2)“沉铁”时,滴加氨水需要调节pH最低为
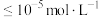 时,沉淀完全)。
时,沉淀完全)。(3)“萃取,反萃取”时发生的反应是
 。有机萃取剂能分离
。有机萃取剂能分离 和
和 ,为了提高反萃取效率,反萃取剂应该呈
,为了提高反萃取效率,反萃取剂应该呈(4)“深度净化”中加Zn的目的是
(5)“沉锌”时,恰好完全反应,过滤、洗涤得到碱式碳酸锌
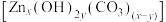 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 中国“奋斗者”号深潜器研制及海试的成功,标志着我国在钛合金材料制备方面实现了重大突破。工业上用钛矿石(主要成分: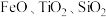 等)为原料制取钛并得到副产物绿矾(
等)为原料制取钛并得到副产物绿矾( ),工艺流程如下:
),工艺流程如下:
② 易水解,只能存在于强酸性溶液中
易水解,只能存在于强酸性溶液中
请回答以下问题:
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是_______ 。
(2)加入适量铁粉的目的是_______ 。操作1名称为_______ 。
(3)固体2的主要成分是_______ 。
(4)在高温下, 和焦炭的混合物中通入
和焦炭的混合物中通入 得到
得到 和一种可燃性气体,请写出反应的化学方程式
和一种可燃性气体,请写出反应的化学方程式_______ 。
(5)用过量的钠在高温条件下与 反应可制得钛,写出此反应的化学方程式
反应可制得钛,写出此反应的化学方程式_______ 。该反应必须在高温下进行,你认为还应该控制的反应条件是_______ 。
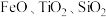 等)为原料制取钛并得到副产物绿矾(
等)为原料制取钛并得到副产物绿矾( ),工艺流程如下:
),工艺流程如下: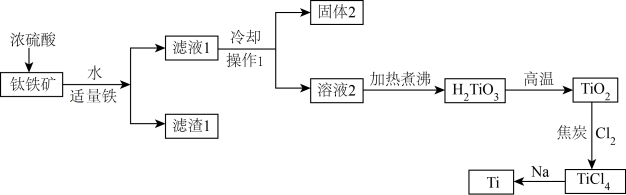

②
 易水解,只能存在于强酸性溶液中
易水解,只能存在于强酸性溶液中请回答以下问题:
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是
(2)加入适量铁粉的目的是
(3)固体2的主要成分是
(4)在高温下,
 和焦炭的混合物中通入
和焦炭的混合物中通入 得到
得到 和一种可燃性气体,请写出反应的化学方程式
和一种可燃性气体,请写出反应的化学方程式(5)用过量的钠在高温条件下与
 反应可制得钛,写出此反应的化学方程式
反应可制得钛,写出此反应的化学方程式
您最近一年使用:0次
2022-07-20更新
|
478次组卷
|
4卷引用:辽宁省大连市2021-2022学年高一下学期期末考试化学试题
辽宁省大连市2021-2022学年高一下学期期末考试化学试题(已下线)综合突破02 期末压轴80题之非选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)河南省开封市杞县新世纪中学2022—2023学年高二上学期开学联考化学试题四川省青神中学校2022-2023学年高二下学期3月月考化学试题
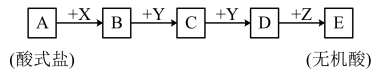
3 . Ⅰ.已知下列物质均由短周期元素组成,X无论是盐酸还是氢氧化钠,转化均能进行,又已知C的相对分子质量比D少16,A、B、C、D、E中均含有同一元素。_______ 。
(2)当X是氢氧化钠溶液时,C的化学式_______ 。
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式_______ 。
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是_______ (填字母)。
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
(5)以铬铁矿(主要成分为FeO和 ,含有少量
,含有少量 、
、 等杂质)为主要原料生产化工原料重铬酸钠
等杂质)为主要原料生产化工原料重铬酸钠 并制取铬,其主要工艺流程如下:
并制取铬,其主要工艺流程如下: 氧化为
氧化为 。
。
①“操作②”是_______ 。
②工业上可用固体A制取粗硅,写出反应的化学方程式:_______ 。
③写出溶液D转化为溶液E过程中反应的离子方程式:_______ 。
(2)当X是氢氧化钠溶液时,C的化学式
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
(5)以铬铁矿(主要成分为FeO和
 ,含有少量
,含有少量 、
、 等杂质)为主要原料生产化工原料重铬酸钠
等杂质)为主要原料生产化工原料重铬酸钠 并制取铬,其主要工艺流程如下:
并制取铬,其主要工艺流程如下: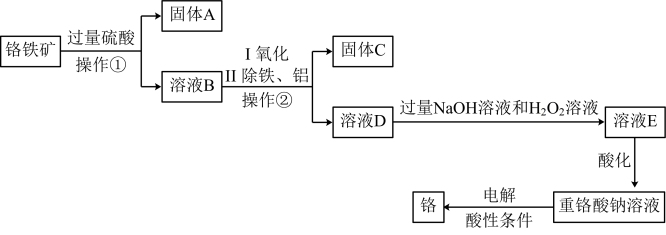
 氧化为
氧化为 。
。①“操作②”是
②工业上可用固体A制取粗硅,写出反应的化学方程式:
③写出溶液D转化为溶液E过程中反应的离子方程式:
您最近一年使用:0次
2022-07-19更新
|
409次组卷
|
3卷引用:辽宁省协作校2021-2022学年高一下学期期末考试化学试题
辽宁省协作校2021-2022学年高一下学期期末考试化学试题(已下线)专题06 化学与可持续发展-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)河南省开封市杞县新世纪中学2022—2023学年高二上学期开学联考化学试题
解题方法
4 . 海洋资源的综合利用是21世纪海祥开发利用的重点发展领域之一、从海水中可以制取氯、溴、镁等多种化工产品。在元素周期表中,溴(Br)位于第四周期,与Cl同主族。氯气可用于海水提溴,其工艺流程如下:
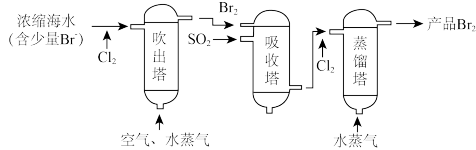
(1)进入吹出塔前海水中的 与
与 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)已知: 具有较强的氧化性,可氧化
具有较强的氧化性,可氧化 ,从吸收塔流出的溶液主要含
,从吸收塔流出的溶液主要含____ (写离子符号)。
(3)两次通入 的目的是富集浓缩溴,最终每获得
的目的是富集浓缩溴,最终每获得 ,理论上需消耗
,理论上需消耗_______ 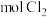 。
。
(4)某同学利用如图所示装置模拟吹出塔、吸收塔的实验,请回答下列问题:
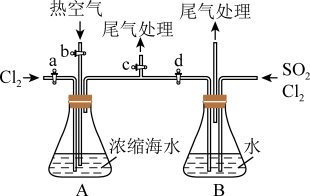
①进行吹出塔中实验时,应关闭活塞_______ ,打开活塞_______ 。
②可根据_______ (填现象),简单判断热空气的流速,通入热空气能吹出 的原因是
的原因是_______ 。
③装置B中要先通入 ,反应完全后再通入
,反应完全后再通入 ,简单判断通入的
,简单判断通入的 ,已反应完全的依据:
,已反应完全的依据:_______ 。

(1)进入吹出塔前海水中的
 与
与 发生反应的离子方程式为
发生反应的离子方程式为(2)已知:
 具有较强的氧化性,可氧化
具有较强的氧化性,可氧化 ,从吸收塔流出的溶液主要含
,从吸收塔流出的溶液主要含(3)两次通入
 的目的是富集浓缩溴,最终每获得
的目的是富集浓缩溴,最终每获得 ,理论上需消耗
,理论上需消耗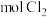 。
。(4)某同学利用如图所示装置模拟吹出塔、吸收塔的实验,请回答下列问题:

①进行吹出塔中实验时,应关闭活塞
②可根据
 的原因是
的原因是③装置B中要先通入
 ,反应完全后再通入
,反应完全后再通入 ,简单判断通入的
,简单判断通入的 ,已反应完全的依据:
,已反应完全的依据:
您最近一年使用:0次
2022-07-15更新
|
274次组卷
|
3卷引用:辽宁省辽阳市2021-2022学年高一下学期期末考试化学试题
解题方法
5 . 某校化学实验小组学生为了验证非金属元素氯的非金属性强于硫和氮,设计了一套实验装置如图(已知氯气能把氨气氧化生成氮气和氯化氢)。
(1)配平A中反应的化学方程式:_______ _______HCl(浓)+_______KMnO4=_______MnCl2+_______KCl+_______Cl2↑+_______ H2O。该反应中氧化剂与还原剂物质的量之比为_______ 。
(2)B中浸有NaOH溶液的棉花团的作用为_______ ;B中的现象为_______ ,由该现象得非金属性:Cl>>S。
(3)E中反应化学方程式为_______ 。
(4)D中出现白烟,涉及的反应化学方程式为_______ 、_______ 。
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为_______ (填名称)。
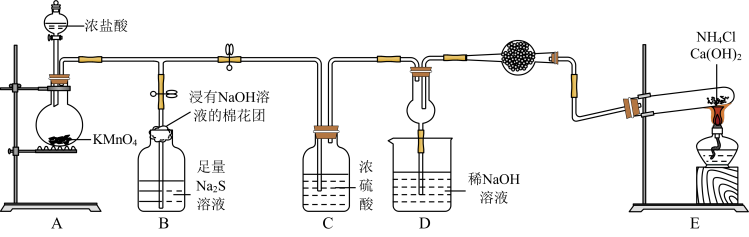
(1)配平A中反应的化学方程式:
(2)B中浸有NaOH溶液的棉花团的作用为
(3)E中反应化学方程式为
(4)D中出现白烟,涉及的反应化学方程式为
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为
您最近一年使用:0次
2022-07-14更新
|
316次组卷
|
3卷引用:辽宁省朝阳市建平县2021-2022学年高一下学期期末考试化学试题
辽宁省朝阳市建平县2021-2022学年高一下学期期末考试化学试题黑龙江省齐齐哈尔市八校联考2022-2023学年高一下学期期末考试化学试题(已下线)专题01 硫、氮、硅及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)
解题方法
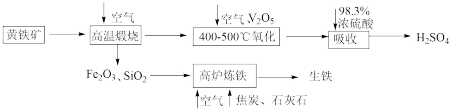
6 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药等。工业上以黄铁矿(主要成分为FeS2,含有少量SiO2杂质)为主要原料制备硫酸的工艺流程如下图所示:
回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是_______ ;煅烧时发生反应的化学方程式为_______ 。
(2)“氧化”时,发生反应的化学方程式为_______ 。
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是_______ 。
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:_______ ;若投入Fe2O3的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中Fe2O3的转化率为_______ 。

回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是
(2)“氧化”时,发生反应的化学方程式为
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:
您最近一年使用:0次
2022-07-12更新
|
316次组卷
|
2卷引用:辽宁省凌源市高中2022-2023学年高二下学期3月联考化学试题
名校
解题方法
7 . 科学、安全、有效和合理地开发自然资源,对生产、生活有重要价值。请回答下列问题:
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:
II.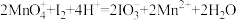
①氧化过程的离子方程式为_______ 。
②根据I2的特性,分离操作X应为_______ 、冷却结晶。
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是_______ 。
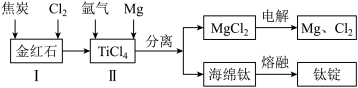
(2)以金红石(主要成分为TiO2)为原料,制取Ti的工艺流程如图所示:_______ 。
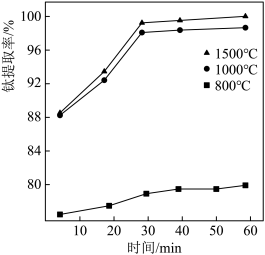
②II中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为_______ ℃。_______ 。
④海绵钛除杂时得到的MgCl2可以循环使用,在上述工艺流程中可循环使用的物质还有_______ (填化学式)。
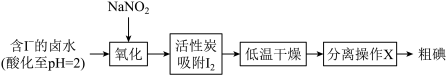
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:
II.
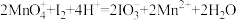
①氧化过程的离子方程式为
②根据I2的特性,分离操作X应为
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是
(2)以金红石(主要成分为TiO2)为原料,制取Ti的工艺流程如图所示:
②II中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为
④海绵钛除杂时得到的MgCl2可以循环使用,在上述工艺流程中可循环使用的物质还有
您最近一年使用:0次
2022-07-12更新
|
708次组卷
|
6卷引用:辽宁省锦州市2021-2022学年高一下学期期末考试化学试卷
辽宁省锦州市2021-2022学年高一下学期期末考试化学试卷辽宁省沈阳市新民市第一高级中学2021-2022学年高一下学期期末考试化学试题黑龙江省齐齐哈尔市八校联考2022-2023学年高一下学期期末考试化学试题安徽省六安第一中学2022-2023学年高一下学期期末考试化学试题(已下线)猜想03 气体的制取、无机实验探究、无机综合应用(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)名校期末好题汇编-化学与可持续发展(非选择题)
名校
解题方法
8 . 某兴趣小组利用经过初步处理的含有Fe2+的废液制备硫酸亚铁晶体的流程如图:____ ,若NaHCO3溶液浓度偏低可能会形成胶体,验证的方法为____ 。
(2)加入铁粉的作用是____ 。
(3)测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液。配平下面方程式,并用双线桥法表示电子转移过程:____ 。
KMnO4+___FeSO4+___H2SO4=___MnSO4+___K2SO4+___Fe2(SO4)3+___H2O。
(4)已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为____ 。
(5)硫酸亚铁在空气中煅烧生成Fe2O3和一种酸性氧化物,该反应的化学方程式为____ ,该反应中每产生1molFe2O3,转移的电子数为____ NA。

(2)加入铁粉的作用是
(3)测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液。配平下面方程式,并用双线桥法表示电子转移过程:
KMnO4+___FeSO4+___H2SO4=___MnSO4+___K2SO4+___Fe2(SO4)3+___H2O。
(4)已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为
(5)硫酸亚铁在空气中煅烧生成Fe2O3和一种酸性氧化物,该反应的化学方程式为
您最近一年使用:0次
2022-03-16更新
|
220次组卷
|
2卷引用:辽宁省渤海大学附属高级中学2021-2022学年高一上学期期末质量检测化学试题
9 . 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
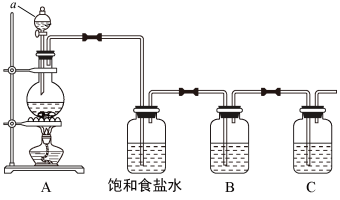
(1)仪器a的名称为___________
(2)请写出A装置中发生反应的化学方程式___________ 。
(3)饱和食盐水的作用是___________ 。
(4)装置B中盛放的试剂是___________ (选填下列所给试剂的编号),反应离子方程式是___________ 。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液
(5)还有哪些事实能够说明氯元素的非金属性比疏元素的非金属性强___________ (填编号)
① 比
比 稳定
稳定
② 氧化性比
氧化性比 强
强
③ 酸性比
酸性比 强
强
④ 酸性比
酸性比 强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
⑥ 与铁反应生成
与铁反应生成 ,而S与铁反应生成
,而S与铁反应生成

(1)仪器a的名称为
(2)请写出A装置中发生反应的化学方程式
(3)饱和食盐水的作用是
(4)装置B中盛放的试剂是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液(5)还有哪些事实能够说明氯元素的非金属性比疏元素的非金属性强
①
 比
比 稳定
稳定 ②
 氧化性比
氧化性比 强
强 ③
 酸性比
酸性比 强
强④
 酸性比
酸性比 强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子⑥
 与铁反应生成
与铁反应生成 ,而S与铁反应生成
,而S与铁反应生成
您最近一年使用:0次
解题方法
10 . 某钴矿石的主要成分有 、
、 、
、 、
、 、
、 和
和 等。由该矿石粉制备
等。由该矿石粉制备 固体的方法如图(部分催化剂已略)。
固体的方法如图(部分催化剂已略)。
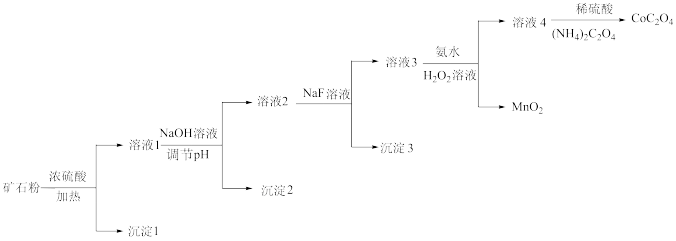
已知:金属离子沉淀的 :
:
(1) 原子的核外电子排布式为
原子的核外电子排布式为_______ 。
(2)向溶液1中加入 溶液,将
溶液,将 转化为
转化为 沉淀,应调节
沉淀,应调节 至少大于
至少大于_______ 。
(3)向溶液2中加入 溶液,去除的离子是
溶液,去除的离子是_______ 。
(4)向溶液3中加入氨水和过氧化氢溶液,将 转化为
转化为 。该反应的离子方程式为:
。该反应的离子方程式为:_______ 。
(5)溶液4中,若将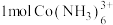 全部转化为
全部转化为 沉淀,需要消耗
沉淀,需要消耗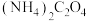
_______  。
。
(6)关于上述流程,下列说法正确的是_______ (填序号)。
a.若矿石粉中存在少量 ,经上述流程也可制得纯度相同的
,经上述流程也可制得纯度相同的
b.向溶液3中加入氨水,作用仅是调节溶液的pH
c.流程中,仅通过调节溶液的pH无法将金属元素完全分离
 、
、 、
、 、
、 、
、 和
和 等。由该矿石粉制备
等。由该矿石粉制备 固体的方法如图(部分催化剂已略)。
固体的方法如图(部分催化剂已略)。
已知:金属离子沉淀的
 :
: |  |  |  |  | |
| 开始沉淀时 | 1.5 | 6.3 | 8.9 | 8.2 | 7.4 |
| 完全沉淀时 | 2.8 | 8.3 | 10.9 | 10.2 | 9.4 |
 原子的核外电子排布式为
原子的核外电子排布式为(2)向溶液1中加入
 溶液,将
溶液,将 转化为
转化为 沉淀,应调节
沉淀,应调节 至少大于
至少大于(3)向溶液2中加入
 溶液,去除的离子是
溶液,去除的离子是(4)向溶液3中加入氨水和过氧化氢溶液,将
 转化为
转化为 。该反应的离子方程式为:
。该反应的离子方程式为:(5)溶液4中,若将
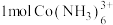 全部转化为
全部转化为 沉淀,需要消耗
沉淀,需要消耗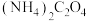
 。
。(6)关于上述流程,下列说法正确的是
a.若矿石粉中存在少量
 ,经上述流程也可制得纯度相同的
,经上述流程也可制得纯度相同的
b.向溶液3中加入氨水,作用仅是调节溶液的pH
c.流程中,仅通过调节溶液的pH无法将金属元素完全分离
您最近一年使用:0次



