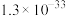名校
1 . 焦亚硫酸钠 常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
I.焦亚硫酸钠的制备
实验室制备少量 的装置如图所示。
的装置如图所示。 左右,向
左右,向 过饱和溶液中通入
过饱和溶液中通入 ,当溶液的
,当溶液的 为4.1时,停止通入
为4.1时,停止通入 ,
, 静置结晶,经减压抽滤、洗涤、
静置结晶,经减压抽滤、洗涤、 干燥,可获得
干燥,可获得 固体。
固体。
(1) 的VSEPR模型名称为
的VSEPR模型名称为__________ 。
(2)控制反应温度在 左右的原因是
左右的原因是_____________ 。
(3)装置 的作用是
的作用是__________ 。
(4)工业上亦可用 (固体)与
(固体)与 气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:
气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:_______________ 。
(5)因为 具有
具有_________ 性,所以产品 中不可避免地存在
中不可避免地存在 。检验产品中含有
。检验产品中含有 的方法是
的方法是_____________ 。
Ⅱ.焦亚硫酸钠纯度的测定
工业焦亚硫酸钠优质品要求焦亚硫酸钠的质量分数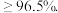 通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为
通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为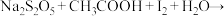
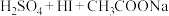 (未配平),
(未配平), 。
。
准确称取 样品,快速置于预先加入
样品,快速置于预先加入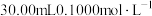 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处 ,用
,用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 标准溶液
标准溶液 。
。
(6)滴定终点的现象是_____________ 。
(7)该样品中焦亚硫酸钠的质量分数为__________  ,
,__________ (填“是”或“不是”)优质品。
 常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:I.焦亚硫酸钠的制备
实验室制备少量
 的装置如图所示。
的装置如图所示。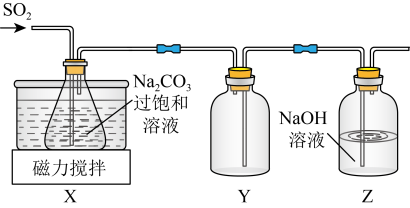
 左右,向
左右,向 过饱和溶液中通入
过饱和溶液中通入 ,当溶液的
,当溶液的 为4.1时,停止通入
为4.1时,停止通入 ,
, 静置结晶,经减压抽滤、洗涤、
静置结晶,经减压抽滤、洗涤、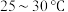 干燥,可获得
干燥,可获得 固体。
固体。(1)
 的VSEPR模型名称为
的VSEPR模型名称为(2)控制反应温度在
 左右的原因是
左右的原因是(3)装置
 的作用是
的作用是(4)工业上亦可用
 (固体)与
(固体)与 气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:
气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:(5)因为
 具有
具有 中不可避免地存在
中不可避免地存在 。检验产品中含有
。检验产品中含有 的方法是
的方法是Ⅱ.焦亚硫酸钠纯度的测定
工业焦亚硫酸钠优质品要求焦亚硫酸钠的质量分数
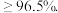 通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为
通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为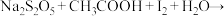
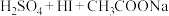 (未配平),
(未配平), 。
。准确称取
 样品,快速置于预先加入
样品,快速置于预先加入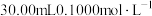 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处 ,用
,用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 标准溶液
标准溶液 。
。(6)滴定终点的现象是
(7)该样品中焦亚硫酸钠的质量分数为
 ,
,
您最近一年使用:0次
7日内更新
|
141次组卷
|
3卷引用:河北省保定市九校2024届高三下学期二模化学试题
名校
解题方法
2 . 钼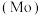 及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和
及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 的形式存在,从镍钼矿中分离钼的一种工艺流程如图。
的形式存在,从镍钼矿中分离钼的一种工艺流程如图。 在“焙烧”过程中转化为
在“焙烧”过程中转化为 ;
;
②钼酸铵 为白色晶体,具有很高的水溶性,不溶于乙醇。
为白色晶体,具有很高的水溶性,不溶于乙醇。
(1)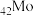 与
与 同族,基态
同族,基态 原子的价层电子排布式为
原子的价层电子排布式为__________ 。
(2)“焙烧”中 元素转化为
元素转化为 ,同时有
,同时有 生成,写出
生成,写出 在“焙烧”时发生反应的化学方程式:
在“焙烧”时发生反应的化学方程式:________________ 。
(3)下列说法正确的是__________(填标号)。
(4) 中存在的相互作用有__________(填标号)。
中存在的相互作用有__________(填标号)。
(5)经过结晶、过滤、洗涤、干燥等操作得到 ,洗涤时所选用的最佳试剂为
,洗涤时所选用的最佳试剂为__________ 。
(6)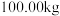 该镍钼矿(
该镍钼矿( 元素的质量分数为
元素的质量分数为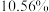 )通过该工艺最终得到
)通过该工艺最终得到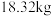 钼酸铵产品,则该工艺中钼酸铵的产率为
钼酸铵产品,则该工艺中钼酸铵的产率为__________  。(保留一位小数,产率=
。(保留一位小数,产率=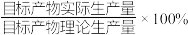 )
)
(7)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在 原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为
原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为__________ , 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为__________
 及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和
及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 的形式存在,从镍钼矿中分离钼的一种工艺流程如图。
的形式存在,从镍钼矿中分离钼的一种工艺流程如图。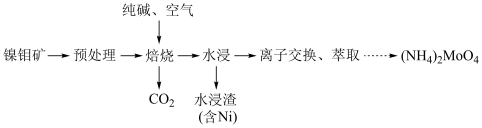
 在“焙烧”过程中转化为
在“焙烧”过程中转化为 ;
;②钼酸铵
 为白色晶体,具有很高的水溶性,不溶于乙醇。
为白色晶体,具有很高的水溶性,不溶于乙醇。(1)
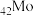 与
与 同族,基态
同族,基态 原子的价层电子排布式为
原子的价层电子排布式为(2)“焙烧”中
 元素转化为
元素转化为 ,同时有
,同时有 生成,写出
生成,写出 在“焙烧”时发生反应的化学方程式:
在“焙烧”时发生反应的化学方程式:(3)下列说法正确的是__________(填标号)。
A.电负性: |
B.离子半径: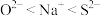 |
C.第一电离能: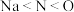 |
D.基态 中成对电子数与未成对电子数之比为 中成对电子数与未成对电子数之比为 |
(4)
 中存在的相互作用有__________(填标号)。
中存在的相互作用有__________(填标号)。| A.分子间作用力 | B.金属键 |
| C.共价键 | D.离子键 |
(5)经过结晶、过滤、洗涤、干燥等操作得到
 ,洗涤时所选用的最佳试剂为
,洗涤时所选用的最佳试剂为(6)
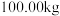 该镍钼矿(
该镍钼矿( 元素的质量分数为
元素的质量分数为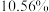 )通过该工艺最终得到
)通过该工艺最终得到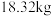 钼酸铵产品,则该工艺中钼酸铵的产率为
钼酸铵产品,则该工艺中钼酸铵的产率为 。(保留一位小数,产率=
。(保留一位小数,产率=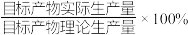 )
)(7)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在
 原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为
原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为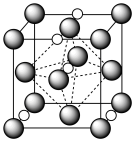
您最近一年使用:0次
7日内更新
|
145次组卷
|
3卷引用:河北省保定市九校2024届高三下学期二模化学试题
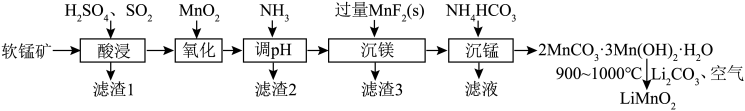
3 . 层状LiMnO2在电动车、空间技术等范畴具有十分广阔的应用前景。LiMnO2可由软锰矿(主要成分是MnO2,含少量Fe2O3、Al2O3、SiO2、MgO等)制备,其制备流程如图:
回答下列问题:
(1) LiMnO2中锰元素的化合价为______ ;“酸浸”后过滤,所得滤液中主要含有的金属阳离子有______ 。
(2)为了提高“酸浸”的浸取速率,可采取的措施有______ (写出两点)。
(3)“氧化”步骤需要加入过量MnO2,该步反应的离子方程式为______ 。
(4)常温下,“调pH”后溶液pH=5,则滤渣2的主要成分是______ 。
(5)滤渣3与浓H2SO4反应可以释放HF,同时得到的副产物是______ 。
(6)测定 LiMnO2样品中锰含量:取10g LiMnO2样品,粉碎后加入浓盐酸、30%H2O2溶液,充分反应,生成Mn(Ⅱ)。加入蒸馏水标定溶液体积为250mL,移取25mL后加入KB指示剂,用0.15mol/L的EDTA标准溶液滴定,平均消耗60mL标准溶液。样品中锰含量为______ %(已知:EDTA与Mn2+反应的化学计量数之比为1∶1)。
物质 |
|
|
|
|
|
|
|
|
|
|
|
(1) LiMnO2中锰元素的化合价为
(2)为了提高“酸浸”的浸取速率,可采取的措施有
(3)“氧化”步骤需要加入过量MnO2,该步反应的离子方程式为
(4)常温下,“调pH”后溶液pH=5,则滤渣2的主要成分是
(5)滤渣3与浓H2SO4反应可以释放HF,同时得到的副产物是
(6)测定 LiMnO2样品中锰含量:取10g LiMnO2样品,粉碎后加入浓盐酸、30%H2O2溶液,充分反应,生成Mn(Ⅱ)。加入蒸馏水标定溶液体积为250mL,移取25mL后加入KB指示剂,用0.15mol/L的EDTA标准溶液滴定,平均消耗60mL标准溶液。样品中锰含量为
您最近一年使用:0次
7日内更新
|
184次组卷
|
3卷引用:2024届河北省部分高中高三下学期二模化学试题
名校
4 . 常温下,二甲基亚砜( )为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸点为189℃。实验室模拟“
)为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸点为189℃。实验室模拟“ 氧化法”制备二甲基亚砜的装置如图所示(加热装置及夹持装置已省略)。
氧化法”制备二甲基亚砜的装置如图所示(加热装置及夹持装置已省略)。

①制备二甲基亚砜的反应原理为
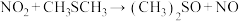 。
。②二甲基硫醚和二甲基亚砜的密度分别为
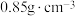 和
和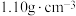 。
。③
 微热易分解为NO、
微热易分解为NO、 和
和 。
。实验过程:将仪器A中制得的气体通入15.00mL二甲基硫醚中,控制温度为60∼80℃,反应一段时间得到二甲基亚砜粗品,粗品经减压蒸馏后共收集到11.10mL二甲基亚砜纯品。回答下列问题:
(1)通入
 的目的是
的目的是a.碱石灰 b.
 c.硅胶
c.硅胶(2)冷凝管进出水的方向
(3)二甲基亚砜能与水混溶的原因可能为
(4)NaOH溶液吸收尾气中NO和
 生成亚硝酸盐的化学方程式为
生成亚硝酸盐的化学方程式为(5)本实验的产率是
您最近一年使用:0次
7日内更新
|
196次组卷
|
6卷引用:2024届河北省保定市唐县第一中学高三下学期二模化学试题
解题方法
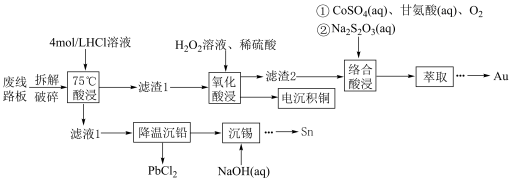
5 . 废旧手机的废线路板中富含Cu、Sn、Ni、Pb等金属和少量Ag、Au,具有较高的回收价值,其中部分金属的回收工艺流程如下: 微溶于水,可与
微溶于水,可与 结合生成
结合生成 配离子:
配离子: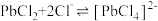 。
。
②25℃时,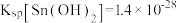 ,
,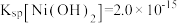 。
。
回答下列问题:
(1)“拆解破碎”的目的是_______ 。
(2)“75℃酸浸”中,金属Sn与盐酸反应的离子方程式为_______ ,选用浓度较大的4 mol·L 盐酸可提高铅元素的浸出率,理由是
盐酸可提高铅元素的浸出率,理由是_______ (从平衡移动角度分析)。
(3)“滤渣1”的主要成分是_______ (填化学式),“氧化酸浸”中,生成Cu²⁺反应的离子方程式为_______ 。
(4) 的排放标准为
的排放标准为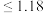 mg·L
mg·L 。“沉锡”残余液排放前应调节溶液的pH范围为
。“沉锡”残余液排放前应调节溶液的pH范围为_____ 。
(5)“络合酸浸”中,Co2+作催化剂,催化Au浸出,化学方程式为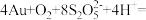
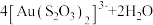 ,其反应过程按如下步骤进行:
,其反应过程按如下步骤进行:
① 先与甘氨酸根(简写为
先与甘氨酸根(简写为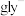 )形成配合物
)形成配合物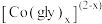 (
(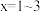 )。
)。
②在氧气作用下,Co(Ⅱ)被氧化成Co(Ⅲ):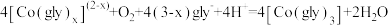 。
。
③Au溶解。
④加入硫代硫酸钠溶液,发生反应: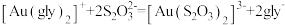 。
。
步骤③Au溶解的离子方程式为_______ 。
(6)锡有白锡和灰锡两种单质。白锡晶体中锡原子的堆积方式如图所示,该六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为 ,白锡晶体的密度为
,白锡晶体的密度为_______  (列出计算式)。
(列出计算式)。
 微溶于水,可与
微溶于水,可与 结合生成
结合生成 配离子:
配离子: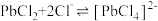 。
。②25℃时,
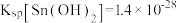 ,
,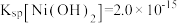 。
。回答下列问题:
(1)“拆解破碎”的目的是
(2)“75℃酸浸”中,金属Sn与盐酸反应的离子方程式为
 盐酸可提高铅元素的浸出率,理由是
盐酸可提高铅元素的浸出率,理由是(3)“滤渣1”的主要成分是
(4)
 的排放标准为
的排放标准为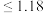 mg·L
mg·L 。“沉锡”残余液排放前应调节溶液的pH范围为
。“沉锡”残余液排放前应调节溶液的pH范围为(5)“络合酸浸”中,Co2+作催化剂,催化Au浸出,化学方程式为
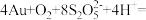
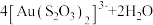 ,其反应过程按如下步骤进行:
,其反应过程按如下步骤进行:①
 先与甘氨酸根(简写为
先与甘氨酸根(简写为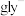 )形成配合物
)形成配合物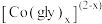 (
(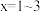 )。
)。②在氧气作用下,Co(Ⅱ)被氧化成Co(Ⅲ):
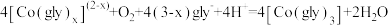 。
。③Au溶解。
④加入硫代硫酸钠溶液,发生反应:
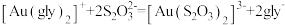 。
。步骤③Au溶解的离子方程式为
(6)锡有白锡和灰锡两种单质。白锡晶体中锡原子的堆积方式如图所示,该六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为
 ,白锡晶体的密度为
,白锡晶体的密度为 (列出计算式)。
(列出计算式)。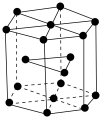
您最近一年使用:0次
7日内更新
|
64次组卷
|
2卷引用:2024届河北省承德市部分示范高中高三下学期三模化学试题
名校
6 . 砷的化合物可用于半导体领域。一种从酸性高浓度含砷废水[砷主要以亚砷酸( )形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
)形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
I. ;
;
II.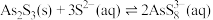 ;
;
III.砷酸( )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 等还原;
等还原;
IV.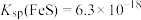 ,
,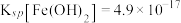 。
。
回答下列问题:
(1)“沉砷”时,亚砷酸转化为 的化学方程式为
的化学方程式为_______ 。
(2)“沉砷”时产生的废气可用_______ 溶液吸收处理(填化学式)。
(3)“NaOH溶液浸取”后,所得“滤渣”的主要成分是_______ (填化学式),“滤渣”中_______  (填“含有”或“不含有”)。
(填“含有”或“不含有”)。
(4)向滤液II中通入氧气进行“氧化脱硫”,反应的离子方程式为_______ 。
(5)“沉砷”过程中FeS不可用过量的 替换,原因是
替换,原因是_______ (从平衡移动的角度解释)。
(6)该流程最后一步用 还原”砷酸,发生反应的化学方程式为
还原”砷酸,发生反应的化学方程式为_______ 。
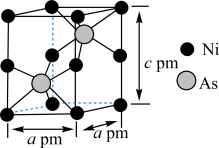
(7)某含砷化合物晶体的晶胞如图所示,As原子位于紧邻Ni原子构成的正三棱柱的体心。晶胞参数为apm、apm、cpm,则该晶体的密度为_______ 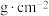 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 )形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
)形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下: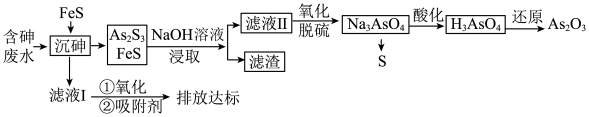
I.
 ;
;II.
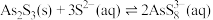 ;
;III.砷酸(
 )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 等还原;
等还原;IV.
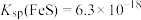 ,
,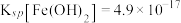 。
。回答下列问题:
(1)“沉砷”时,亚砷酸转化为
 的化学方程式为
的化学方程式为(2)“沉砷”时产生的废气可用
(3)“NaOH溶液浸取”后,所得“滤渣”的主要成分是
 (填“含有”或“不含有”)。
(填“含有”或“不含有”)。(4)向滤液II中通入氧气进行“氧化脱硫”,反应的离子方程式为
(5)“沉砷”过程中FeS不可用过量的
 替换,原因是
替换,原因是(6)该流程最后一步用
 还原”砷酸,发生反应的化学方程式为
还原”砷酸,发生反应的化学方程式为(7)某含砷化合物晶体的晶胞如图所示,As原子位于紧邻Ni原子构成的正三棱柱的体心。晶胞参数为apm、apm、cpm,则该晶体的密度为
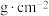 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
7 . 由废旧铜包钢线缆[含Fe、Cu和少量 、碳]回收铜,并制备磷酸亚铁锂,有望代替传统的锂离子电池正极材料。其工艺流程如图所示。
、碳]回收铜,并制备磷酸亚铁锂,有望代替传统的锂离子电池正极材料。其工艺流程如图所示。
(1)常温下进行“酸溶”时,稀硝酸不宜用浓硝酸代替,原因为_______ (写一条)。
(2)滤渣1的主要成分为_______ (填名称)。滤渣2主要成分_______ (填化学式)。
(3)写出用 溶液通过湿法制备Cu的离子反应方程式:
溶液通过湿法制备Cu的离子反应方程式:_______ 。
(4)若滤液2中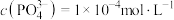 ,则“转化”过程调pH不能高于
,则“转化”过程调pH不能高于_______ {已知:常温下,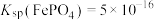 、
、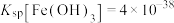 、
、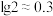 。忽略溶液体积变化}。
。忽略溶液体积变化}。
(5)“焙烧”反应的化学方程式为_______ ;该工序需在氩气氛围中进行的原因为_______ 。
(6)上述工艺中可以循环利用的物质为_______ (填化学式)。
 、碳]回收铜,并制备磷酸亚铁锂,有望代替传统的锂离子电池正极材料。其工艺流程如图所示。
、碳]回收铜,并制备磷酸亚铁锂,有望代替传统的锂离子电池正极材料。其工艺流程如图所示。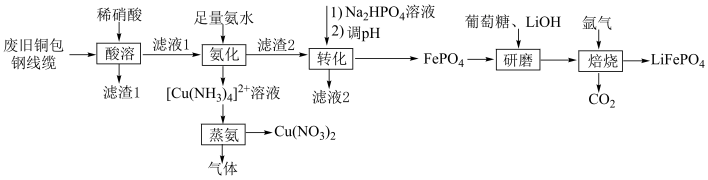
(1)常温下进行“酸溶”时,稀硝酸不宜用浓硝酸代替,原因为
(2)滤渣1的主要成分为
(3)写出用
 溶液通过湿法制备Cu的离子反应方程式:
溶液通过湿法制备Cu的离子反应方程式:(4)若滤液2中
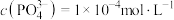 ,则“转化”过程调pH不能高于
,则“转化”过程调pH不能高于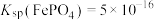 、
、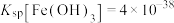 、
、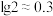 。忽略溶液体积变化}。
。忽略溶液体积变化}。(5)“焙烧”反应的化学方程式为
(6)上述工艺中可以循环利用的物质为
您最近一年使用:0次
名校
解题方法
8 . 钴广泛应用于机械制造、电子电器、航空航天、电池制造等行业,是国家重要的战略资源。用含钴废料(主要成分为 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题:
① 具有强氧化性。
具有强氧化性。
② ,
, 。
。
(1)为提高含钴废料的浸出效率,可采取的措施是___________ (任写一条)。
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ ;浸出渣的主要成分为___________ (填化学式)。
(3)向“浸出液”中加入适量的 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)①“除钙镁”后,滤液中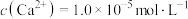 时,
时,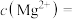
___________  。
。
②若“调pH”时溶液的pH偏低,将会导致 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是___________ 。
(5)将 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: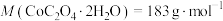 ]
] ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为___________ 。
 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题: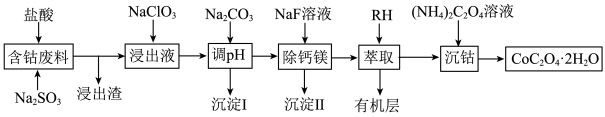
①
 具有强氧化性。
具有强氧化性。②
 ,
, 。
。(1)为提高含钴废料的浸出效率,可采取的措施是
(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)向“浸出液”中加入适量的
 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为(4)①“除钙镁”后,滤液中
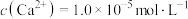 时,
时,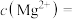
 。
。②若“调pH”时溶液的pH偏低,将会导致
 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是(5)将
 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: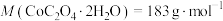 ]
]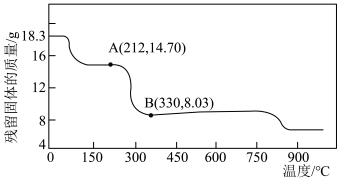
 ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为
您最近一年使用:0次
7日内更新
|
139次组卷
|
5卷引用:2024届河北省保定市十校高三下学期三模化学试题
名校
9 . 从经济价值、环境保护等多重背景下考虑,废旧锂离子电池中的锂、镍、钴、锰金属的回收利用已刻不容缓。某科研团队对废旧三元锂电池进行处理,工艺如图所示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为 ,且其中所含镍、钴、锰的化合价均为+3价;杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价;杂质主要为 。
。
b.碳酸锂的溶解度随温度升高而减小。
请回答下列问题:
(1)镍位于元素周期表第__________ 周期第__________ 族。
(2)写出粉料中的 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:__________ 。
(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为__________ ℃,浸出时间为__________ min。除以上两因素外,任写一种对设出率有影响的因素:__________ 。__________ 。
(5)“共沉淀”后的滤液中含有大量 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:__________ 、__________ 、洗涤、干燥。

a.正极片预处理后的粉料中主要成分与终端产品2相同,均为
 ,且其中所含镍、钴、锰的化合价均为+3价;杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价;杂质主要为 。
。b.碳酸锂的溶解度随温度升高而减小。
请回答下列问题:
(1)镍位于元素周期表第
(2)写出粉料中的
 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为
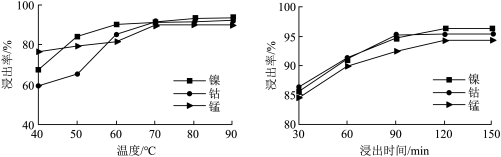
(5)“共沉淀”后的滤液中含有大量
 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
您最近一年使用:0次
10 . 从钼精矿焙烧烟尘(含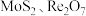 ,少量
,少量 )中回收铼的工艺流程如图所示:
)中回收铼的工艺流程如图所示: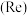 元素易被氧化。②
元素易被氧化。②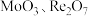 易溶于水生成
易溶于水生成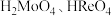 ,其它钼、铼的氧化物难溶于水。③钼元素与硫酸根可形成配离子。
,其它钼、铼的氧化物难溶于水。③钼元素与硫酸根可形成配离子。
回答下列问题:
(1) 焙烧产物基本全部为
焙烧产物基本全部为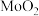 。焙烧时
。焙烧时 反应的化学方程式为:
反应的化学方程式为:
①
②_______ 。
(2)水浸时,加入 的作用是
的作用是_______ 。
(3)已知 在水中的溶解度:
在水中的溶解度:
水浸液中,钼的浓度约为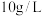 ,可能原因为
,可能原因为_______ 。钼、铼的浸出率随温度的变化关系如图1所示,则水浸时,适宜的温度为_______ ℃左右。 )与树脂上的官能团发生交换反应达到平衡。浸取液中
)与树脂上的官能团发生交换反应达到平衡。浸取液中 浓度对铼的吸附率影响如图2所示,铼的浸出率随
浓度对铼的吸附率影响如图2所示,铼的浸出率随 浓度变化的原因为
浓度变化的原因为_______ 。
(5) 的立方晶胞结构如下图所示,则
的立方晶胞结构如下图所示,则 配位数为
配位数为_______ ,若晶胞密度为 ,则晶胞参数
,则晶胞参数
_______  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 ,少量
,少量 )中回收铼的工艺流程如图所示:
)中回收铼的工艺流程如图所示: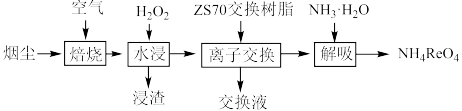
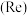 元素易被氧化。②
元素易被氧化。②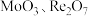 易溶于水生成
易溶于水生成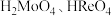 ,其它钼、铼的氧化物难溶于水。③钼元素与硫酸根可形成配离子。
,其它钼、铼的氧化物难溶于水。③钼元素与硫酸根可形成配离子。回答下列问题:
(1)
 焙烧产物基本全部为
焙烧产物基本全部为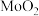 。焙烧时
。焙烧时 反应的化学方程式为:
反应的化学方程式为:①

②
(2)水浸时,加入
 的作用是
的作用是(3)已知
 在水中的溶解度:
在水中的溶解度:温度 | 18 | 30 | 45 | 60 | 70 | 80 |
溶解度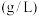 | 0.106 | 0.257 | 0.365 | 0.421 | 0.466 | 0.518 |
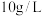 ,可能原因为
,可能原因为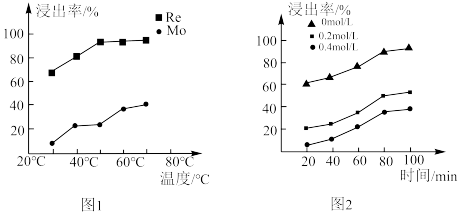
 )与树脂上的官能团发生交换反应达到平衡。浸取液中
)与树脂上的官能团发生交换反应达到平衡。浸取液中 浓度对铼的吸附率影响如图2所示,铼的浸出率随
浓度对铼的吸附率影响如图2所示,铼的浸出率随 浓度变化的原因为
浓度变化的原因为(5)
 的立方晶胞结构如下图所示,则
的立方晶胞结构如下图所示,则 配位数为
配位数为 ,则晶胞参数
,则晶胞参数
 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。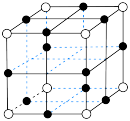
您最近一年使用:0次