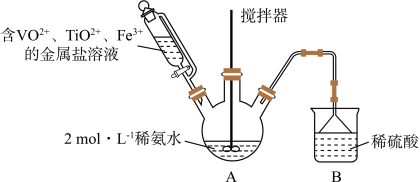
1 . 某课外小组采用廉价原料NH4VO3、TiO2和Fe2O3,制出含VO2+、TiO2+和Fe3+的金属盐溶液,然后选择氨水作沉淀剂进行共沉淀反应,对共沉淀物[含VO(OH)2、Ti(OH)4、Fe(OH)3]进行煅烧还原制备合金样品,钒基固溶体合金是一类重要的贮氢材料。制备共沉淀物的装置如下图:_______ 、_______ 、_______ 。
(2)装置C中支管插入三颈烧瓶中的作用是_______ 。
(3)制备VO2+时,用草酸将 还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为
还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为_______ 。
(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是_______ 。
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是_______ 。
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是_______ 。
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol/L酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁的质量分数为_______ 。
(2)装置C中支管插入三颈烧瓶中的作用是
(3)制备VO2+时,用草酸将
 还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为
还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol/L酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁的质量分数为
您最近一年使用:0次
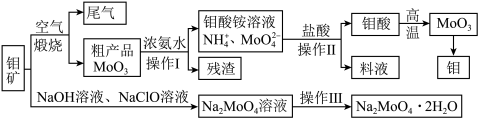
2 . 过渡性金属元素在工业生产中有很重要的作用,如金属钼用于制火箭、卫星的合金构件,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼精矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体(Na2MoO4·2H2O)的主要流程图如下:_______ ,已知Rb(铷)质子数为37,在第五周期ⅠA,Mo的质子数为42,那么Mo在周期表中的位置为第五周期_______ 族。
(2)用浓氨水溶解粗产品的离子方程式是_______ ,由图中信息可以判断MoO3是_______ 氧化物。(填“酸性”、“碱性”或“两性”)
(3)操作Ⅰ是_______ ,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是_______ 。
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:_______ 。
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
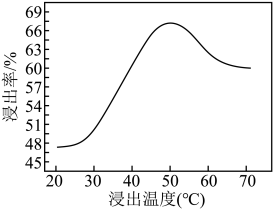
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是_______ (写一点)。 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为_______ 。
(2)用浓氨水溶解粗产品的离子方程式是
(3)操作Ⅰ是
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是
 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为
您最近一年使用:0次
3 . 某矿物炼铜后的矿渣固体主要成分为 、
、 、
、 以及少量的CuO、PbO、
以及少量的CuO、PbO、 等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。
等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。 ;
;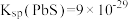 ;
;
②CuO和PbO均具有一定的“两性”,“碱浸”时均能溶于氢氧化钠溶液。
回答下列问题:
(1)“碱浸”时应进行加热、搅拌等操作,目的是___________ 。
(2)下图为温度和NaOH溶液浓度对确浸出率的影响,实际生产中“碱浸”工序的反应条件为80℃、 的NaOH溶液,而不用更高温度和更大浓度NaOH溶液的原因是
的NaOH溶液,而不用更高温度和更大浓度NaOH溶液的原因是___________ 。 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)滤渣3的主要成分为___________ 。滤液1中 沉淀完全时,
沉淀完全时, 的最大值是
的最大值是___________  (保留小数点后2位。某离子浓度低于
(保留小数点后2位。某离子浓度低于 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(5)在 溶液中通入
溶液中通入 制Se的离子方程式为
制Se的离子方程式为___________ 。
(6)电解后电解液可返回___________ 工序循环使用。
 、
、 、
、 以及少量的CuO、PbO、
以及少量的CuO、PbO、 等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。
等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。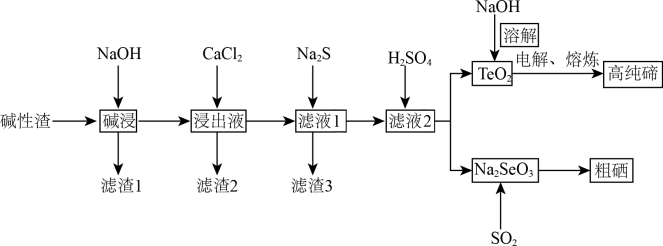
 ;
;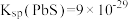 ;
;②CuO和PbO均具有一定的“两性”,“碱浸”时均能溶于氢氧化钠溶液。
回答下列问题:
(1)“碱浸”时应进行加热、搅拌等操作,目的是
(2)下图为温度和NaOH溶液浓度对确浸出率的影响,实际生产中“碱浸”工序的反应条件为80℃、
 的NaOH溶液,而不用更高温度和更大浓度NaOH溶液的原因是
的NaOH溶液,而不用更高温度和更大浓度NaOH溶液的原因是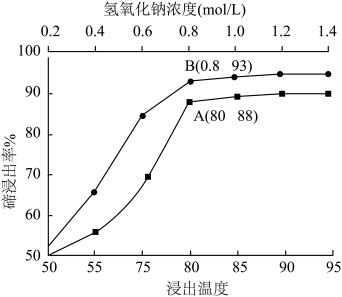
 发生反应的离子方程式为
发生反应的离子方程式为(4)滤渣3的主要成分为
 沉淀完全时,
沉淀完全时, 的最大值是
的最大值是 (保留小数点后2位。某离子浓度低于
(保留小数点后2位。某离子浓度低于 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(5)在
 溶液中通入
溶液中通入 制Se的离子方程式为
制Se的离子方程式为(6)电解后电解液可返回
您最近一年使用:0次
解题方法
4 . 镁及其化合物是实验设计的热点载体。某学习小组设计实验探究镁与二氧化氮反应的产物,实验装置如图所示。 能与水反应;②反应完后E中有
能与水反应;②反应完后E中有 。
。
回答下列问题:
(1)仪器a的名称为___________ ;a中试剂是___________ 。
(2)实验时,为了防止Mg与空气中氧气等反应,操作为___________ 。
(3)实验测得Mg与 反应生成MgO、
反应生成MgO、 和
和 ,其中
,其中 和
和 的物质的量相等,则C中反应的化学方程式为
的物质的量相等,则C中反应的化学方程式为___________ 。装置D的作用是___________ 。
(4)E装置中发生反应的离子方程式为___________ 。
(5)写出氮化镁与水反应的化学方程式___________ 。
(6)已知浓硝酸分解反应为: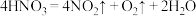 ,干燥生成的气体后,该气体混合物能使带火星的木条复燃,由此某同学得出
,干燥生成的气体后,该气体混合物能使带火星的木条复燃,由此某同学得出 气体能支持燃烧的说法,你认为该说法正确吗?并说明理由
气体能支持燃烧的说法,你认为该说法正确吗?并说明理由___________ 。
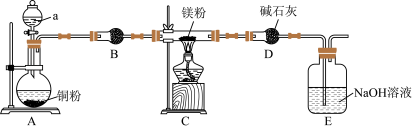
 能与水反应;②反应完后E中有
能与水反应;②反应完后E中有 。
。回答下列问题:
(1)仪器a的名称为
(2)实验时,为了防止Mg与空气中氧气等反应,操作为
(3)实验测得Mg与
 反应生成MgO、
反应生成MgO、 和
和 ,其中
,其中 和
和 的物质的量相等,则C中反应的化学方程式为
的物质的量相等,则C中反应的化学方程式为(4)E装置中发生反应的离子方程式为
(5)写出氮化镁与水反应的化学方程式
(6)已知浓硝酸分解反应为:
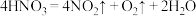 ,干燥生成的气体后,该气体混合物能使带火星的木条复燃,由此某同学得出
,干燥生成的气体后,该气体混合物能使带火星的木条复燃,由此某同学得出 气体能支持燃烧的说法,你认为该说法正确吗?并说明理由
气体能支持燃烧的说法,你认为该说法正确吗?并说明理由
您最近一年使用:0次
5 . 镍、钴均是一种重要的战略资源,广泛应用于飞机发动机、锂离子电池等领域。以红土镍矿常压盐酸浸液(含 、
、 、
、 、
、 、
、 和
和 )为原料提取Ni、Co。工艺流程如下:
)为原料提取Ni、Co。工艺流程如下:
回答下列问题:
(1)滤渣1的成分是 、
、___________ 。
(2)“调 ”时,发生反应的主要化学方程式为
”时,发生反应的主要化学方程式为___________ 。
(3)“碱性氧化”时,由 转化为
转化为 的离子方程式为
的离子方程式为___________ ,常温下,若pH控制为9,则溶液中 浓度最多为
浓度最多为___________ mol·L 。
。
(4)“析晶”时,通入的酸性气体A为___________ (化学式)。
(5)①“电解”时Ni在___________ (“阴”或“阳”)极析出。
②Ni可以进一步制备超导体 ,其立方晶胞如图。C与Ni最小间距小于Ni与Mg最小间距,x为整数,则Ni在晶胞中的位置为
,其立方晶胞如图。C与Ni最小间距小于Ni与Mg最小间距,x为整数,则Ni在晶胞中的位置为___________ (“顶点”“面心”或“体心”),晶体中一个C周围与其最近的Ni的个数为___________ 。
 、
、 、
、 、
、 、
、 和
和 )为原料提取Ni、Co。工艺流程如下:
)为原料提取Ni、Co。工艺流程如下: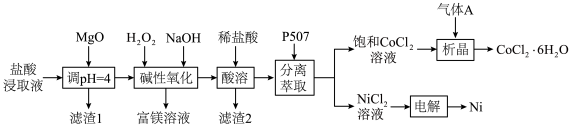
| 物质 |  |  |  |  |  |  |
 |  | 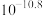 | 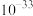 | 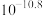 |  |  |
(1)滤渣1的成分是
 、
、(2)“调
 ”时,发生反应的主要化学方程式为
”时,发生反应的主要化学方程式为(3)“碱性氧化”时,由
 转化为
转化为 的离子方程式为
的离子方程式为 浓度最多为
浓度最多为 。
。(4)“析晶”时,通入的酸性气体A为
(5)①“电解”时Ni在
②Ni可以进一步制备超导体
 ,其立方晶胞如图。C与Ni最小间距小于Ni与Mg最小间距,x为整数,则Ni在晶胞中的位置为
,其立方晶胞如图。C与Ni最小间距小于Ni与Mg最小间距,x为整数,则Ni在晶胞中的位置为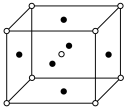
您最近一年使用:0次
6 . 四氧化三铁俗称磁性氧化铁,常用于制造录音磁带和电讯器材,也可作颜料和抛光剂。某工厂以硫铁矿烧渣(主要含有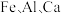 等元素的氧化物及
等元素的氧化物及 )为原料,制备
)为原料,制备 的工艺流程如图所示。
的工艺流程如图所示。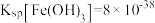 、
、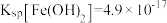 、
、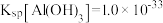 。
。
回答下列问题:
(1)“酸溶”硫铁矿烧渣时,为了加快酸溶速率可采取的措施有___________ (任写两条)。
(2)料渣1的主要成分有___________ (填化学式)。
(3)常温下,已知溶液中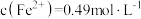 ,要使
,要使 沉淀完全,则“调
沉淀完全,则“调 ”的范围是
”的范围是___________ (保留2位有效数字,一般离子浓度 认为沉淀完全)。
认为沉淀完全)。
(4)加入 “沉铁”时,发生反应的离子方程式为
“沉铁”时,发生反应的离子方程式为___________ 。
(5)①“煅烧1”的目的是将 转化为
转化为 ,若“煅烧2”阶段发生反应时
,若“煅烧2”阶段发生反应时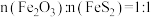 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
②“煅烧2”时温度对 的纯度有很大影响。已知温度对
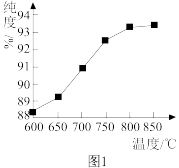
的纯度有很大影响。已知温度对 纯度的影响如图1所示,则“煅烧2”时,温度最好控制在
纯度的影响如图1所示,则“煅烧2”时,温度最好控制在___________  。
。 )的晶胞如图2所示。已知:该晶胞底边边长为
)的晶胞如图2所示。已知:该晶胞底边边长为 ,高为
,高为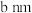 ,l号原子的高为
,l号原子的高为 。
。 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。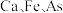 原子的个数之比为
原子的个数之比为___________ ;距2号原子最近的铁有___________ 个。
②该晶体的密度为___________  ,1号原子的坐标为
,1号原子的坐标为___________ 。
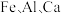 等元素的氧化物及
等元素的氧化物及 )为原料,制备
)为原料,制备 的工艺流程如图所示。
的工艺流程如图所示。
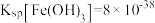 、
、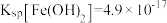 、
、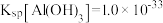 。
。回答下列问题:
(1)“酸溶”硫铁矿烧渣时,为了加快酸溶速率可采取的措施有
(2)料渣1的主要成分有
(3)常温下,已知溶液中
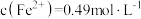 ,要使
,要使 沉淀完全,则“调
沉淀完全,则“调 ”的范围是
”的范围是 认为沉淀完全)。
认为沉淀完全)。(4)加入
 “沉铁”时,发生反应的离子方程式为
“沉铁”时,发生反应的离子方程式为(5)①“煅烧1”的目的是将
 转化为
转化为 ,若“煅烧2”阶段发生反应时
,若“煅烧2”阶段发生反应时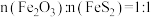 ,则该反应的化学方程式为
,则该反应的化学方程式为②“煅烧2”时温度对
 的纯度有很大影响。已知温度对
的纯度有很大影响。已知温度对 纯度的影响如图1所示,则“煅烧2”时,温度最好控制在
纯度的影响如图1所示,则“煅烧2”时,温度最好控制在 。
。
 )的晶胞如图2所示。已知:该晶胞底边边长为
)的晶胞如图2所示。已知:该晶胞底边边长为 ,高为
,高为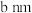 ,l号原子的高为
,l号原子的高为 。
。 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。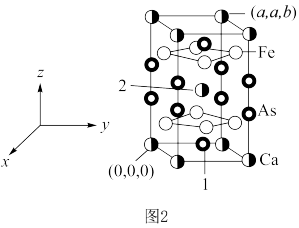
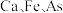 原子的个数之比为
原子的个数之比为②该晶体的密度为
 ,1号原子的坐标为
,1号原子的坐标为
您最近一年使用:0次
名校
解题方法
7 . 铌 的原子序数为41,其单质具有良好的超导性,可应用于原子能领域。烧绿石精矿可用于冶炼金属铌,某烧绿石精矿的成分为
的原子序数为41,其单质具有良好的超导性,可应用于原子能领域。烧绿石精矿可用于冶炼金属铌,某烧绿石精矿的成分为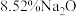 ,
,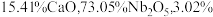 其他不反应的杂质。从烧绿石中提取
其他不反应的杂质。从烧绿石中提取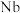 的工艺流程如图所示:
的工艺流程如图所示:
(1)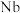 在元素周期表中的位置是
在元素周期表中的位置是___________ 。
(2)上述烧绿石中铌元素的含量为___________ 。
(3)“酸浸”时,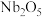 转化为
转化为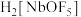 的化学方程式为
的化学方程式为___________ 。
(4)“沉淀”时,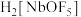 与氨水反应生成
与氨水反应生成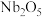 、
、___________ 、 。
。
(5)“还原”时,发生反应的化学方程式为___________ 。
(6)“萃取”“反萃取”后都需要进行的分离操作是___________ 。
(7)废液中的 ,在一定条件可转化为可溶于酸的难溶性盐
,在一定条件可转化为可溶于酸的难溶性盐 。某温度下,用
。某温度下,用 调节
调节 浊液的
浊液的 ,测得体系中
,测得体系中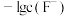 或
或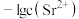 与
与 的关系如图所示。则该温度下难溶盐
的关系如图所示。则该温度下难溶盐 的溶度积常数为
的溶度积常数为___________ 。
 的原子序数为41,其单质具有良好的超导性,可应用于原子能领域。烧绿石精矿可用于冶炼金属铌,某烧绿石精矿的成分为
的原子序数为41,其单质具有良好的超导性,可应用于原子能领域。烧绿石精矿可用于冶炼金属铌,某烧绿石精矿的成分为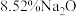 ,
,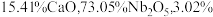 其他不反应的杂质。从烧绿石中提取
其他不反应的杂质。从烧绿石中提取 的工艺流程如图所示:
的工艺流程如图所示: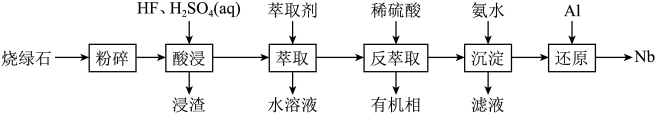
(1)
 在元素周期表中的位置是
在元素周期表中的位置是(2)上述烧绿石中铌元素的含量为
(3)“酸浸”时,
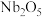 转化为
转化为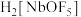 的化学方程式为
的化学方程式为(4)“沉淀”时,
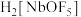 与氨水反应生成
与氨水反应生成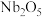 、
、 。
。(5)“还原”时,发生反应的化学方程式为
(6)“萃取”“反萃取”后都需要进行的分离操作是
(7)废液中的
 ,在一定条件可转化为可溶于酸的难溶性盐
,在一定条件可转化为可溶于酸的难溶性盐 。某温度下,用
。某温度下,用 调节
调节 浊液的
浊液的 ,测得体系中
,测得体系中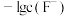 或
或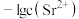 与
与 的关系如图所示。则该温度下难溶盐
的关系如图所示。则该温度下难溶盐 的溶度积常数为
的溶度积常数为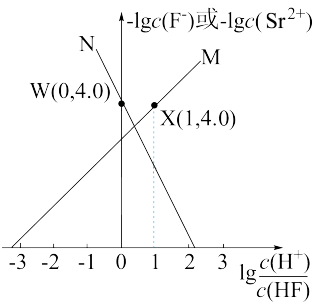
您最近一年使用:0次
解题方法
8 . 偏磷酸钡Ba(PO3)2具有耐高温、透光性良好等性能,是制备磷酸盐光学玻璃的基础物质。利用湿法磷酸(主要成分为H3PO4,含有少量Mg2+、Fe3+、 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示: 时:①
时:①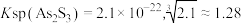 ;
;
②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为___________ 。
(2)“滤渣2”的主要成分有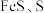 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为___________ ; 下,当
下,当 沉淀完全时,
沉淀完全时, 至少为
至少为___________  [当
[当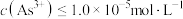 时认为沉淀完全]。
时认为沉淀完全]。
(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为___________ (填化学式)。
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是___________ 。
(5)“结晶”后得到 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为___________ ;比较 键角:
键角: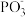
_________  (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是___________ 。
 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
 时:①
时:①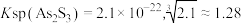 ;
;②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为
(2)“滤渣2”的主要成分有
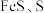 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为 下,当
下,当 沉淀完全时,
沉淀完全时, 至少为
至少为 [当
[当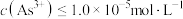 时认为沉淀完全]。
时认为沉淀完全]。(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是
(5)“结晶”后得到
 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为 键角:
键角: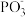
 (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是
您最近一年使用:0次
2024-04-15更新
|
238次组卷
|
3卷引用:2024届贵州省高三下学期二模化学试题
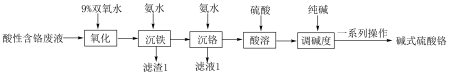
9 . 碱式硫酸铬[ ]主要用于鞣制皮革、作媒染剂及生产氢氧化铬和活性黑染料。以酸性含铬废液(主要含有
]主要用于鞣制皮革、作媒染剂及生产氢氧化铬和活性黑染料。以酸性含铬废液(主要含有 、
、 ,还含有少量
,还含有少量 、
、 、
、 )为原料制备碱式硫酸铬的工艺流程如图所示,回答下列问题:
)为原料制备碱式硫酸铬的工艺流程如图所示,回答下列问题:
已知:常温下,部分金属阳离子开始沉淀和完全沉淀(离子浓度小于或等于 )时的pH如下表。
)时的pH如下表。
(1)Cr在元素周期表中的位置为_______ 。
(2)加入9%双氧水的作用是_______ (用离子方程式表示)。
(3)“沉铁”时调pH的范围为_______ ~_______ 。
(4)“沉铬”过程发生反应的离子方程式是_______ ,从滤液1中可回收一种氮肥,该物质是_______ (填化学式)。
(5)金属铬的晶胞结构如图,已知晶胞参数为anm。
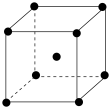
①该晶胞中含铬原子的个数为_______ 。
②铬原子的配位数为_______ 。
③铬原子之间的最短距离为_______ nm(用含a的代数式表示)。
 ]主要用于鞣制皮革、作媒染剂及生产氢氧化铬和活性黑染料。以酸性含铬废液(主要含有
]主要用于鞣制皮革、作媒染剂及生产氢氧化铬和活性黑染料。以酸性含铬废液(主要含有 、
、 ,还含有少量
,还含有少量 、
、 、
、 )为原料制备碱式硫酸铬的工艺流程如图所示,回答下列问题:
)为原料制备碱式硫酸铬的工艺流程如图所示,回答下列问题:
已知:常温下,部分金属阳离子开始沉淀和完全沉淀(离子浓度小于或等于
 )时的pH如下表。
)时的pH如下表。| 离子 |  |  |  |
| 开始沉淀的pH | 7.6 | 1.9 | 4.4 |
| 完全沉淀的pH | 9.6 | 3.1 | 5.6 |
(1)Cr在元素周期表中的位置为
(2)加入9%双氧水的作用是
(3)“沉铁”时调pH的范围为
(4)“沉铬”过程发生反应的离子方程式是
(5)金属铬的晶胞结构如图,已知晶胞参数为anm。

①该晶胞中含铬原子的个数为
②铬原子的配位数为
③铬原子之间的最短距离为
您最近一年使用:0次
解题方法
10 . SrCO3可用于金属冶炼和锶盐制备等。以天青石(成分为SrSO4、BaSO4、CaSO4、SiO2)为原料制备SrCO3的工艺流程如图。
回答下列问题:
(1)天青石磨成粉的目的是_______ 。
(2)天青石粉中的SrSO4与氨水、NH4HCO3溶液反应的离子方程式为_____ ;NH4HCO3溶液中c(NH3·H2O)+c(OH-)+c( )
)_____ (填“>”“<”或“=”)c(H2CO3)+c(H+);将滤液1蒸发浓缩、冷却结晶可得副产物_______ (填化学式)。
(3)滤渣的主要成分为_______ (填化学式)。
(4)打浆酸溶后的滤液加热至95~100C.加NaOH溶液调pH=14的目的是_______ 。
(5)碱析后获得Sr(OH)2的操作为_______ 。
(6)以SrCO3和TiO2为原料,在1300~1500℃下煅烧,可制得优良的光学材料及人造宝石SrTiO3.SrTiO3的晶胞结构如图所示,设NA为阿伏加德罗常数的值,晶胞参数为apm。_______ 。
②SrTiO3晶体的密度为_______ 。

回答下列问题:
(1)天青石磨成粉的目的是
(2)天青石粉中的SrSO4与氨水、NH4HCO3溶液反应的离子方程式为
 )
)(3)滤渣的主要成分为
(4)打浆酸溶后的滤液加热至95~100C.加NaOH溶液调pH=14的目的是
(5)碱析后获得Sr(OH)2的操作为
(6)以SrCO3和TiO2为原料,在1300~1500℃下煅烧,可制得优良的光学材料及人造宝石SrTiO3.SrTiO3的晶胞结构如图所示,设NA为阿伏加德罗常数的值,晶胞参数为apm。
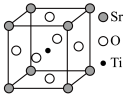
②SrTiO3晶体的密度为
您最近一年使用:0次
2024-04-01更新
|
174次组卷
|
2卷引用:贵州省安顺市部分学校2024届高三下学期二模考试化学试题



