解题方法
1 . 亚硝酸钠(NaNO2)用途很广泛:可制药,作食品防腐剂、显色剂,作印染工业的媒染剂、漂白剂、缓蚀剂等,某兴趣小组欲制备亚硝酸钠并进行一定的实验探究,查阅资料可知:①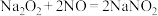 ;②
;②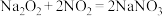 ;③
;③ 可被酸性
可被酸性 氧化成
氧化成 ,现用下图所示装置制备
,现用下图所示装置制备 :
:
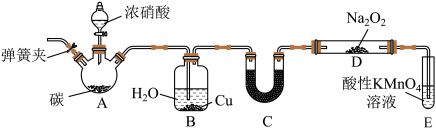
(1)连接仪器之后,加入药品之前需要进行的操作是_____ ;过氧化钠的电子式是_____ 。
(2)仪器B中Cu的作用是_____ 。(用离子方程式表示)
(3)U形管C中的试剂可以是_____ 。
(4)试管E中反应的离子方程式为_____ 。
(5)以上装置有设计缺陷,会使产品NaNO2中杂质增多,改进方法是_____ 。
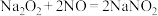 ;②
;②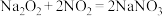 ;③
;③ 可被酸性
可被酸性 氧化成
氧化成 ,现用下图所示装置制备
,现用下图所示装置制备 :
:
(1)连接仪器之后,加入药品之前需要进行的操作是
(2)仪器B中Cu的作用是
(3)U形管C中的试剂可以是
(4)试管E中反应的离子方程式为
(5)以上装置有设计缺陷,会使产品NaNO2中杂质增多,改进方法是
您最近一年使用:0次
2 . 钯(Pd)是重要的金属元素,在有机合成工业上用途广泛。自然界中,钯含量少,常伴生在其他矿藏中,如硫化镍铜矿、镍黄铁矿等。以硫化镍铜矿(含有CuS、NiS、 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:

已知“酸浸”后的固体剩余物为 、PdO(不与碱反应)。回答下列问题:
、PdO(不与碱反应)。回答下列问题:
(1)“灼烧”时产生的污染性气体是_______ (填化学式)。
(2)写出“除硅”反应的离子方程式:_______ 。
(3)“系列操作”包括_______ 、过滤、洗涤、干燥。
(4)“还原”时反应还生成无污染的气体,化学方程式为_______ 。
(5)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有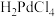 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:_______ 。
(6)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为_______ 。
 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:
已知“酸浸”后的固体剩余物为
 、PdO(不与碱反应)。回答下列问题:
、PdO(不与碱反应)。回答下列问题:(1)“灼烧”时产生的污染性气体是
(2)写出“除硅”反应的离子方程式:
(3)“系列操作”包括
(4)“还原”时反应还生成无污染的气体,化学方程式为
(5)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有
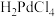 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:(6)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
3 . 铁是人类较早使用的金属之一,铁及其化合物在生产、生活中有重要的用途。运用所学知识回答下列问题。
(1) 的价层电子排布式为
的价层电子排布式为___________ 。
(2)实验室鉴别 胶体与饱和
胶体与饱和 溶液的方法是
溶液的方法是___________ 。
(3)工业上用黄铁矿制硫酸的第一步反应化学反应方程式为___________ 。
(4)电子工业用 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
①为检验 腐蚀铜后所得溶液中含有
腐蚀铜后所得溶液中含有 ,应使用的试剂为
,应使用的试剂为___________ 。
②欲从腐蚀后的废液中回收铜并重新获得 溶液循环利用,现有下列试剂:
溶液循环利用,现有下列试剂:
A.浓硝酸 B.铁粉 C.氯气 D.烧碱 E.浓氨水
需要用到的试剂除盐酸外还需要___________ (填字母)。
(5)高铁酸钠( )是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,
)是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么, 、
、 、
、 三种消毒杀菌剂的消毒效率最高的是
三种消毒杀菌剂的消毒效率最高的是___________ 。
(6)近年来, 作为制备锂离子电池正极材料
作为制备锂离子电池正极材料 的重要原料而成为研究热点。一种以
的重要原料而成为研究热点。一种以 、
、 、氨水为主要原料制备
、氨水为主要原料制备 ,并测定产物样品中铁元素的质量分数,主要步骤如下:
,并测定产物样品中铁元素的质量分数,主要步骤如下:
i.取 样品,加入过量盐酸充分溶解,再滴加
样品,加入过量盐酸充分溶解,再滴加 (还原剂)至溶液呈浅黄色;
(还原剂)至溶液呈浅黄色;
ii.加入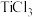 ,恰好将i中残余的少量
,恰好将i中残余的少量 还原为
还原为 ;
;
iii.用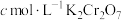 标准溶液滴定
标准溶液滴定 ,消耗
,消耗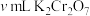 标准溶液。
标准溶液。
①步骤iii的离子方程式是:___________ 。
②产物中铁元素的质量分数为___________ 。
(1)
 的价层电子排布式为
的价层电子排布式为(2)实验室鉴别
 胶体与饱和
胶体与饱和 溶液的方法是
溶液的方法是(3)工业上用黄铁矿制硫酸的第一步反应化学反应方程式为
(4)电子工业用
 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。①为检验
 腐蚀铜后所得溶液中含有
腐蚀铜后所得溶液中含有 ,应使用的试剂为
,应使用的试剂为②欲从腐蚀后的废液中回收铜并重新获得
 溶液循环利用,现有下列试剂:
溶液循环利用,现有下列试剂:A.浓硝酸 B.铁粉 C.氯气 D.烧碱 E.浓氨水
需要用到的试剂除盐酸外还需要
(5)高铁酸钠(
 )是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,
)是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么, 、
、 、
、 三种消毒杀菌剂的消毒效率最高的是
三种消毒杀菌剂的消毒效率最高的是(6)近年来,
 作为制备锂离子电池正极材料
作为制备锂离子电池正极材料 的重要原料而成为研究热点。一种以
的重要原料而成为研究热点。一种以 、
、 、氨水为主要原料制备
、氨水为主要原料制备 ,并测定产物样品中铁元素的质量分数,主要步骤如下:
,并测定产物样品中铁元素的质量分数,主要步骤如下:i.取
 样品,加入过量盐酸充分溶解,再滴加
样品,加入过量盐酸充分溶解,再滴加 (还原剂)至溶液呈浅黄色;
(还原剂)至溶液呈浅黄色;ii.加入
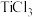 ,恰好将i中残余的少量
,恰好将i中残余的少量 还原为
还原为 ;
;iii.用
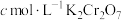 标准溶液滴定
标准溶液滴定 ,消耗
,消耗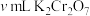 标准溶液。
标准溶液。①步骤iii的离子方程式是:
②产物中铁元素的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 氧化还原反应在日常生活和工业生产中有重要应用。
I.K2Cr2O7是火柴工业用作制造火柴头的原料之一
已知反应: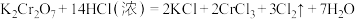
(1)用“双线桥”标明该反应中电子转移的方向和数目。__________
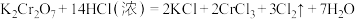
(2)该反应中被氧化的元素是___________ ,还原产物是___________ 。
(3)该反应中氧化剂与还原剂的微粒个数比为___________ 。
Ⅱ.阅读下面一段材料并回答问题。
【性状】暗紫色具有金属光泽的粉末,无臭无味
【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用
【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理
【用量】消毒净化1L水投放5mgK2FeO4即可达到卫生标准
……
(4) K2FeO4中铁元素的化合价为___________ 。
(5)下列关于K2FeO4的说法中,不正确的是___________ 。
a.是强氧化性的盐 b.固体保存需要防潮
b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)工业制备K2FeO4需要在碱性环境下进行,现提供反应体系中7种物质,Fe(NO3)3、Cl2、H2O、KOH、K2FeO4、KCl、KNO3请写出制备K2FeO4的化学反应方程式___________ 。
(7)将K2FeO4与水反应的化学方程式补充完整并配平:____________
___________ +___________
+___________ =___________
=___________ (胶体)+___________+___________
(胶体)+___________+___________
该反应消耗1个K2FeO4时,转移的电子数为___________ 个
(8)消毒净化198L水,按照卫生标准投入K2FeO4,则K2FeO4与水充分反应后产生的KOH质量为___________ g。
I.K2Cr2O7是火柴工业用作制造火柴头的原料之一
已知反应:
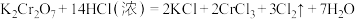
(1)用“双线桥”标明该反应中电子转移的方向和数目。
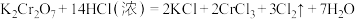
(2)该反应中被氧化的元素是
(3)该反应中氧化剂与还原剂的微粒个数比为
Ⅱ.阅读下面一段材料并回答问题。
高铁酸钾使用说明书
【化学式】K2FeO4【性状】暗紫色具有金属光泽的粉末,无臭无味
【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用
【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理
【用量】消毒净化1L水投放5mgK2FeO4即可达到卫生标准
……
(4) K2FeO4中铁元素的化合价为
(5)下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐
 b.固体保存需要防潮
b.固体保存需要防潮c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)工业制备K2FeO4需要在碱性环境下进行,现提供反应体系中7种物质,Fe(NO3)3、Cl2、H2O、KOH、K2FeO4、KCl、KNO3请写出制备K2FeO4的化学反应方程式
(7)将K2FeO4与水反应的化学方程式补充完整并配平:
___________
 +___________
+___________ =___________
=___________ (胶体)+___________+___________
(胶体)+___________+___________
该反应消耗1个K2FeO4时,转移的电子数为
(8)消毒净化198L水,按照卫生标准投入K2FeO4,则K2FeO4与水充分反应后产生的KOH质量为
您最近一年使用:0次
5 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)“维生素 可以将食物中的
可以将食物中的 转化为
转化为 ”,说明维生素
”,说明维生素
___________ 具有(填“氧化性”或“还原性”)。
(2) 常用检查输送
常用检查输送 的管道是否,其反应如下:___
的管道是否,其反应如下:___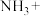 ___
___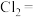 ____
____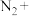 ____
____
①配平上述氧化还原反应___________ 。
②该反应中,氧化剂是___________ (填化学式),被氧化的元素是___________ (填元素名称)。
(3)二氧化氯是一种高效消毒剂。工业上制备 的反应为
的反应为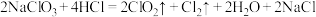 。
。
①该反应中的还原产物是___________ (写化学式),反应中每生成1个 分子,转移电子的数目为
分子,转移电子的数目为___________ 。
②用双线桥标出反应中电子转移的方向和数目___________ 。
③ 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是___________ 。
A. B.
B. C.
C. D.
D.
(1)“维生素
 可以将食物中的
可以将食物中的 转化为
转化为 ”,说明维生素
”,说明维生素
(2)
 常用检查输送
常用检查输送 的管道是否,其反应如下:___
的管道是否,其反应如下:___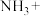 ___
___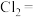 ____
____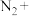 ____
____
①配平上述氧化还原反应
②该反应中,氧化剂是
(3)二氧化氯是一种高效消毒剂。工业上制备
 的反应为
的反应为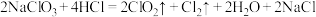 。
。①该反应中的还原产物是
 分子,转移电子的数目为
分子,转移电子的数目为②用双线桥标出反应中电子转移的方向和数目
③
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
名校
解题方法
6 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性。由于
,其水溶液呈碱性。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: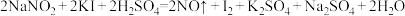
(1)在下面方框中写出氧化剂和还原剂的化学式及其系数,并用单线桥法标出电子转移的方向和数目:______

(2)从物质分类角度来看, 是
是___________ (填字母代号)。
a.酸 b.盐 c.碱 d.非电解质 e.电解质
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ (填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和NaCl的是
和NaCl的是___________ (填序号)。
A.分别溶于水,并滴加几滴酚酞溶液
B.分别加强热并收集气体检验
C.用筷子分别蘸取固体品尝味道
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式:___________ ,产生氮气分子和转移电子数目比为:___________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性。由于
,其水溶液呈碱性。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: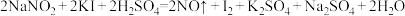
(1)在下面方框中写出氧化剂和还原剂的化学式及其系数,并用单线桥法标出电子转移的方向和数目:

(2)从物质分类角度来看,
 是
是a.酸 b.盐 c.碱 d.非电解质 e.电解质
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)下列方法不能用来区分固体
 和NaCl的是
和NaCl的是A.分别溶于水,并滴加几滴酚酞溶液
B.分别加强热并收集气体检验
C.用筷子分别蘸取固体品尝味道
(5)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C. |
D.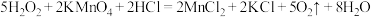 |
您最近一年使用:0次
7 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
(2)我国从2000年起逐步用 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为___________ 。
(5)请完成该过程的化学方程式并配平。
______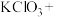 _______
_______ ______
______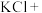 _______
_______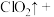 _______
_______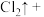 ______(________)
______(________) ___________
若反应生成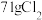 ,被氧化的HCl质量为
,被氧化的HCl质量为___________ 。
(6)已知氧化性: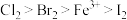 ,则:
,则:
① 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: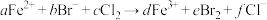 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是___________ 。
A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
② 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为___________ 。
(7)实验室用下列方法均可制取氯气
①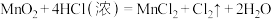
②
③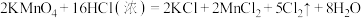
④
若各反应转移的电子数相同,①②③④生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、
 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为(5)请完成该过程的化学方程式并配平。
______
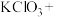 _______
_______ ______
______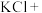 _______
_______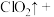 _______
_______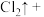 ______(________)
______(________) 若反应生成
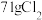 ,被氧化的HCl质量为
,被氧化的HCl质量为(6)已知氧化性:
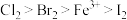 ,则:
,则:①
 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: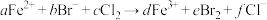 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
②
 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为(7)实验室用下列方法均可制取氯气
①
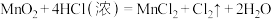
②

③
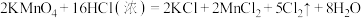
④

若各反应转移的电子数相同,①②③④生成的氯气质量比为
您最近一年使用:0次
2023-10-11更新
|
799次组卷
|
3卷引用:湖北武汉市第六中学2023-2024学年高一上学期10月月考化学试题
解题方法
8 . 氮、磷元素的单质和它们的化合物用途广泛,与生产、生活有密切关系。
请回答下列问题。
(1)下列属于氮的固定的是___________ 。
a.工业上N2和H2合成NH3 b.NH3催化氧化生成NO
c.N2和O2放电条件下生成NO d.NH3与灼热的氧化铜反应生成N2
(2)N2H4(联氨)可用作喷气式发动机推进剂、火箭燃料,可由次氯酸钠与氨反应制取,其化学反应方程式为___________ 。
(3)实验室中向浓氨水中加CaO固体可以快速制备氨气,请解释其反应原理___________ 。
(4)Si3N4是一种性能优异的无机非金属材料,它的熔点高硬度大,电绝缘性好,化学性质稳定,但生产成本较高。根据以上描述推测Si3N4可能有哪些用途___________ 。
a.制作坩埚 b.用作建筑陶瓷 c.制作耐高温轴承 d.制作切削刀具
(5)磷元素可以形成多种含氧酸。
①已知4.0gNaOH最多可中和100mL1mol·L−1H3PO2溶液,则NaH2PO2是___________ (填“正盐”或“酸式盐”)。
②已知常温下酸性:H3PO3>CH3COOH>H2PO ,则H3PO3与足量CH3COONa溶液混合的离子反应方程式为
,则H3PO3与足量CH3COONa溶液混合的离子反应方程式为___________ 。
请回答下列问题。
(1)下列属于氮的固定的是
a.工业上N2和H2合成NH3 b.NH3催化氧化生成NO
c.N2和O2放电条件下生成NO d.NH3与灼热的氧化铜反应生成N2
(2)N2H4(联氨)可用作喷气式发动机推进剂、火箭燃料,可由次氯酸钠与氨反应制取,其化学反应方程式为
(3)实验室中向浓氨水中加CaO固体可以快速制备氨气,请解释其反应原理
(4)Si3N4是一种性能优异的无机非金属材料,它的熔点高硬度大,电绝缘性好,化学性质稳定,但生产成本较高。根据以上描述推测Si3N4可能有哪些用途
a.制作坩埚 b.用作建筑陶瓷 c.制作耐高温轴承 d.制作切削刀具
(5)磷元素可以形成多种含氧酸。
①已知4.0gNaOH最多可中和100mL1mol·L−1H3PO2溶液,则NaH2PO2是
②已知常温下酸性:H3PO3>CH3COOH>H2PO
 ,则H3PO3与足量CH3COONa溶液混合的离子反应方程式为
,则H3PO3与足量CH3COONa溶液混合的离子反应方程式为
您最近一年使用:0次
解题方法
9 . 无水氯化镨( )是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含ZnS、FeS、
)是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含ZnS、FeS、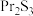 、
、 等)制备氯化镨晶体(
等)制备氯化镨晶体(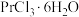 )。
)。

已知:① ;
;
② ;
;
③该条件下,溶液中部分金属离子生成氢氧化物开始沉淀和沉淀完全时的pH如表所示:
④沉淀时加入氨水逐步调节溶液的pH至6.5,此时滤渣Ⅱ中不含Pr的化合物。
回答下列问题:
(1)为了提高镨元素的浸出率,可采取的措施有_______ (填一种即可)。
(2)滤渣I的主要成分为 和S:
和S:
①写出 的一种用途:
的一种用途:_______ 。
②S可用来处理体温计破碎时渗出的液态Hg,还可用来制黑火药(由硫黄粉、硝酸钾和木炭混合而成,爆炸时的生成物为硫化钾、氮气和二氧化碳),写出黑火药爆炸时发生反应的化学方程式:_______ 。
(3)加入 的目的是
的目的是_______ ,其发生反应的离子方程式为_______
(4)滤渣Ⅱ的主要成分为_______ (填化学式)。
(5)利用表中的数据求出
_______ 。
 )是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含ZnS、FeS、
)是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含ZnS、FeS、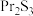 、
、 等)制备氯化镨晶体(
等)制备氯化镨晶体(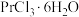 )。
)。
已知:①
 ;
;②
 ;
;③该条件下,溶液中部分金属离子生成氢氧化物开始沉淀和沉淀完全时的pH如表所示:
| 金属离子 |  |  |  |
| 开始沉淀的pH | 5.4 | 2.2 | 7.5 |
沉淀完全( )时的pH )时的pH | 6.4 | 3.2 | 9.0 |
回答下列问题:
(1)为了提高镨元素的浸出率,可采取的措施有
(2)滤渣I的主要成分为
 和S:
和S:①写出
 的一种用途:
的一种用途:②S可用来处理体温计破碎时渗出的液态Hg,还可用来制黑火药(由硫黄粉、硝酸钾和木炭混合而成,爆炸时的生成物为硫化钾、氮气和二氧化碳),写出黑火药爆炸时发生反应的化学方程式:
(3)加入
 的目的是
的目的是(4)滤渣Ⅱ的主要成分为
(5)利用表中的数据求出

您最近一年使用:0次
23-24高二上·广东深圳·期末
名校
解题方法
10 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、Al2O3、SiO2和FeO)为原料,采用酸溶法制取 和MgSO4·7H2O,工业流程如图所示:
和MgSO4·7H2O,工业流程如图所示:
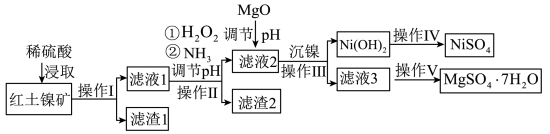
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“滤液1”中加入H2O2的作用是___________ (用离子反应方程式表示)。
(2)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是___________ 。
(3)Ksp[Ni(OH)2]=1.0×10-15,“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为___________ mol/L。
(4)工业上使用Ni(OH)2在碱性溶液中电解,在电解池的阳极可制得电极材料NiOOH,该电极反应方程式为___________ 。
(5)用滴定法测定NiSO4产品中镍元素含量。取5.90g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.100mol∙L-1的Na2H2Y标准液滴定,重复操作2~3次,消耗Na2H2Y标准液平均值为12.00mL。
已知:i.Ni2++H2Y2-=[NiY]2-+2H+;
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的颜色变化为___________ ;
②样品中镍元素的质量分数为___________ %(保留3位有效数字);
③以下操作,会使测定结果偏低的有___________ 。
A.滴定终点读数时,俯视滴定管刻度
B.盛装Na2H2Y标准液的滴定管未润洗
C.滴定前,发现装有滴定管尖嘴处有一个气泡,滴定后,气泡消失
D.滴定终点读数后,发现尖嘴处悬挂了一滴溶液
 和MgSO4·7H2O,工业流程如图所示:
和MgSO4·7H2O,工业流程如图所示:
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
| 沉淀物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
| 沉淀完全(c<10-5mol/L)时的pH | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“滤液1”中加入H2O2的作用是
(2)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是
(3)Ksp[Ni(OH)2]=1.0×10-15,“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为(4)工业上使用Ni(OH)2在碱性溶液中电解,在电解池的阳极可制得电极材料NiOOH,该电极反应方程式为
(5)用滴定法测定NiSO4产品中镍元素含量。取5.90g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.100mol∙L-1的Na2H2Y标准液滴定,重复操作2~3次,消耗Na2H2Y标准液平均值为12.00mL。
已知:i.Ni2++H2Y2-=[NiY]2-+2H+;
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的颜色变化为
②样品中镍元素的质量分数为
③以下操作,会使测定结果偏低的有
A.滴定终点读数时,俯视滴定管刻度
B.盛装Na2H2Y标准液的滴定管未润洗
C.滴定前,发现装有滴定管尖嘴处有一个气泡,滴定后,气泡消失
D.滴定终点读数后,发现尖嘴处悬挂了一滴溶液
您最近一年使用:0次



