1 . 某化学兴趣小组同学利用以下装置制取 并探究红色纸条褪色的原因(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。
并探究红色纸条褪色的原因(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。

(1)装置I可用于制取 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。
(2)装置II的作用是_______ 。装置的III作用是_______ 。
(3)装置IV中a处红色纸条无明显变化,b处红色纸条褪色,同学猜测使b处红色纸条褪色的物质是_______ 。
(4)装置V中 溶液可吸收
溶液可吸收 并制得漂白液,写出该反应的离子方程式
并制得漂白液,写出该反应的离子方程式_______ 。
 并探究红色纸条褪色的原因(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。
并探究红色纸条褪色的原因(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。
(1)装置I可用于制取
 ,写出该反应的化学方程式
,写出该反应的化学方程式(2)装置II的作用是
(3)装置IV中a处红色纸条无明显变化,b处红色纸条褪色,同学猜测使b处红色纸条褪色的物质是
(4)装置V中
 溶液可吸收
溶液可吸收 并制得漂白液,写出该反应的离子方程式
并制得漂白液,写出该反应的离子方程式
您最近一年使用:0次
解题方法
2 . 在加热的条件下,用MnO2与100mL物质的量浓度为12mol/L的浓盐酸反应,制得氯气2.24L(标准状况)。
(1)用双线桥法表示电子转移________ 。
(2)需要消耗MnO2多少克________ ?
(3)被氧化的HCl的物质的量是多少________ ?
(1)用双线桥法表示电子转移
(2)需要消耗MnO2多少克
(3)被氧化的HCl的物质的量是多少
您最近一年使用:0次
名校
3 .  又称次氯酸酐,是强氧化剂,极易溶于水,沸点为
又称次氯酸酐,是强氧化剂,极易溶于水,沸点为 ,
, 以上分解为
以上分解为 和
和 ,高浓度时易爆炸。某学习小组利用
,高浓度时易爆炸。某学习小组利用 和潮湿的碳酸钠反应生成
和潮湿的碳酸钠反应生成 ,再用水吸收
,再用水吸收 制备
制备 溶液,装置如下,回答下列问题:
溶液,装置如下,回答下列问题:
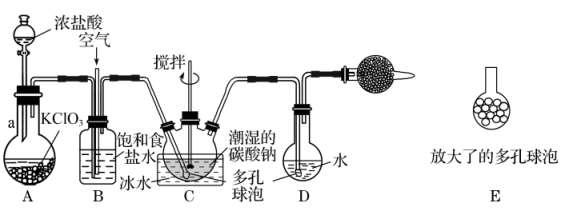
(1)仪器a的名称是_______ ,A中发生反应的离子方程式为_______ 。
(2)实验中须控制 与空气(不参与反应)的体积比为1∶3,装置B的作用
与空气(不参与反应)的体积比为1∶3,装置B的作用_______ (答出2条即可)
(3)装置C中生成 、
、 ,反应的化学方程式为
,反应的化学方程式为_______ ,为使反应充分进行,实验中采取的措施有_______ 。
(4)若装置C不冷却,则进入装置D中的 会大量减少,可能的原因是
会大量减少,可能的原因是_______ 。
(5)测定装置D中 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取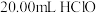 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为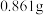 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为_______  (
( 可被
可被 还原成
还原成 )。
)。
 又称次氯酸酐,是强氧化剂,极易溶于水,沸点为
又称次氯酸酐,是强氧化剂,极易溶于水,沸点为 ,
, 以上分解为
以上分解为 和
和 ,高浓度时易爆炸。某学习小组利用
,高浓度时易爆炸。某学习小组利用 和潮湿的碳酸钠反应生成
和潮湿的碳酸钠反应生成 ,再用水吸收
,再用水吸收 制备
制备 溶液,装置如下,回答下列问题:
溶液,装置如下,回答下列问题:
(1)仪器a的名称是
(2)实验中须控制
 与空气(不参与反应)的体积比为1∶3,装置B的作用
与空气(不参与反应)的体积比为1∶3,装置B的作用(3)装置C中生成
 、
、 ,反应的化学方程式为
,反应的化学方程式为(4)若装置C不冷却,则进入装置D中的
 会大量减少,可能的原因是
会大量减少,可能的原因是(5)测定装置D中
 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取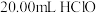 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为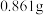 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为 (
( 可被
可被 还原成
还原成 )。
)。
您最近一年使用:0次
名校
4 . 某化学兴趣小组设计了如图装置制取 ,并进行相关性质实验,且可利用装置G储存多余的氯气。
,并进行相关性质实验,且可利用装置G储存多余的氯气。

实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
(1)A中发生反应的化学方程式为_______ 。
(2)储气瓶b可以收集氯气,则b内盛放的试剂名称是_______ 。
(3)装置B中 被
被 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(4)在装置D中能看到的实验现象是_______ 。
(5)在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为 和
和 ,则E中发生反应的化学方程式为
,则E中发生反应的化学方程式为_______ 。
(6)装置F中盛有 溶液,其作用是
溶液,其作用是_______ 。
 ,并进行相关性质实验,且可利用装置G储存多余的氯气。
,并进行相关性质实验,且可利用装置G储存多余的氯气。
实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
(1)A中发生反应的化学方程式为
(2)储气瓶b可以收集氯气,则b内盛放的试剂名称是
(3)装置B中
 被
被 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为(4)在装置D中能看到的实验现象是
(5)在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为
 和
和 ,则E中发生反应的化学方程式为
,则E中发生反应的化学方程式为(6)装置F中盛有
 溶液,其作用是
溶液,其作用是
您最近一年使用:0次
2022-10-14更新
|
505次组卷
|
2卷引用:甘肃省张掖市高台县第一中学2021-2022学年高一上学期期中考试化学试题
名校
5 . 用如图各装置制备并检验氯气的性质。下列说法正确的是

| A.①中实验室制氯气,即使二氧化锰过量,盐酸也不能全部反应完 |
| B.②中充分光照后,溶液会充满量筒 |
C.③中若气球变瘪,证明氯气可与 溶液反应 溶液反应 |
| D.④中生成蓝色的烟,若在集气瓶中加入水,所得溶液呈蓝绿色 |
您最近一年使用:0次
2022-10-14更新
|
495次组卷
|
2卷引用:甘肃省张掖市高台县第一中学2021-2022学年高一上学期期中考试化学试题
解题方法
6 . 取含26.1gMnO2的软锰矿石跟200mL10mol/L的浓盐酸反应完全,已知:MnO2+4HCl(浓)→MnCl2+Cl2↑+2H2O。计算:
(1)生成的氯气在标准状况的体积为多少升___ ?
(2)在反应中被消耗的HCl的质量为多少克___ ?
(3)在反应后的溶液中加入足量的硝酸银溶液,试计算产生沉淀的质量___ ?(不考虑氯化氢的挥发)。
(1)生成的氯气在标准状况的体积为多少升
(2)在反应中被消耗的HCl的质量为多少克
(3)在反应后的溶液中加入足量的硝酸银溶液,试计算产生沉淀的质量
您最近一年使用:0次
解题方法
7 . 如图是实验室制取、提纯氯气及研究氯气性质的装置图。请回答:

(1)实验室制备氯气的化学反应方程为_______ 。
(2)若要收集到干燥纯净的氯气,A、B瓶所装的试剂分别为_______ 和_______ 。
(3)若D瓶中装有硝酸银溶液,则观察到的现象是_______ ;
(4)E装置中通常盛放的是_______ 溶液。

(1)实验室制备氯气的化学反应方程为
(2)若要收集到干燥纯净的氯气,A、B瓶所装的试剂分别为
(3)若D瓶中装有硝酸银溶液,则观察到的现象是
(4)E装置中通常盛放的是
您最近一年使用:0次
名校
8 . 如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
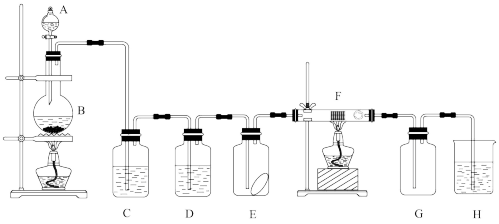
(1)写出实验室制氯气的离子方程式并用“单线桥”法标明电子转移的方向和数目:_______
(2)装置C中盛装的溶液是_______ ,D中试剂的作用是_______ 。
(3)在空气中点燃纯净的氢气,然后把导管缓慢伸入盛满气体(B中产生的气体)的集气瓶中,请描述实验现象_______
(4)E中的红色布条是否褪色?_______ ,F中的反应现象为_______ 。
(5)新制氯水呈黄绿色说明其中含有_______ ,(填化学式,下同),将AgNO3溶液滴入可观察到白色沉淀说明其中含有_______ 。
(6)H中的试剂为_______ ,用来吸收多余氯气。该反应的化学方程式为_______ 。

(1)写出实验室制氯气的离子方程式并用“单线桥”法标明电子转移的方向和数目:
(2)装置C中盛装的溶液是
(3)在空气中点燃纯净的氢气,然后把导管缓慢伸入盛满气体(B中产生的气体)的集气瓶中,请描述实验现象
(4)E中的红色布条是否褪色?
(5)新制氯水呈黄绿色说明其中含有
(6)H中的试剂为
您最近一年使用:0次
9 . 无水氯化锌是白色固体,易吸水潮解,常用作有机合成的脱水剂、缩合剂和催化剂,还用作活性炭的活化剂。某校化学课题小组的同学设计如下实验方案制备无水ZnCl2,并进行纯度测定,涉及的实验装置如图所示:

回答下列问题:
(1)按气流从左到右的方向,装置合理的连接顺序为h→___________ (填仪器接口小写字母,装置不可重复使用)。装置D中橡皮管的作用___________ 。
(2)写出装置D中反应的离子方程式:___________ 。
(3)装置C中的药品为___________ ,其作用___________ 。
(4)氯化锌纯度的测定:取a g试样配成100 mL溶液,取25.00 mL,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用b mol/LEDTA(Na2H2Y)标准溶液滴定Zn2+,反应的离子方程式为Zn2++H2Y2-=ZnY2-+2H+,达到滴定终点时,消耗EDTA标准溶液的平均体积为12.50 mL。
①配制100 mL ZnCl2溶液需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________ 。
②该氯化锌试样中氯化锌的质量分数为___________ (用含a、b的代数式表示)。

回答下列问题:
(1)按气流从左到右的方向,装置合理的连接顺序为h→
(2)写出装置D中反应的离子方程式:
(3)装置C中的药品为
(4)氯化锌纯度的测定:取a g试样配成100 mL溶液,取25.00 mL,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用b mol/LEDTA(Na2H2Y)标准溶液滴定Zn2+,反应的离子方程式为Zn2++H2Y2-=ZnY2-+2H+,达到滴定终点时,消耗EDTA标准溶液的平均体积为12.50 mL。
①配制100 mL ZnCl2溶液需要用到的玻璃仪器有量筒、烧杯、玻璃棒、
②该氯化锌试样中氯化锌的质量分数为
您最近一年使用:0次
名校
10 . 84消毒液的有效成分是NaClO,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备NaClO,并探究氯气的性质。经查阅到资料可知:“氯气与水的反应是放热反应,在加热条件下氯气与碱液发生如下反应:3Cl2+6NaOH 5NaCl+NaClO3+3H2O。
5NaCl+NaClO3+3H2O。

回答下列问题:
(1)装置A、D中发生反应的离子方程式分别为:A:_______ ;D:_______ ;
(2)装置B能否省去的_______ (填“能”或“不能”),理由是_______ ;
(3)装置D中采用冰水浴冷却的目的是_______ 。
(4)理论上制备14.9g次氯酸钠,需要Cl2_______ g,消耗MnO2_______ g。
(5)如图是检验Cl2性质的装置图示,完成下列问题。

①装置a中浓H2SO4的作用是_______ ;该装置能否省去_______ (填“能”或“不能)
②装置b、c实验现象分别为:b_______ ;c_______ ;对比b和c中现象得出的结论是_______ 。
 5NaCl+NaClO3+3H2O。
5NaCl+NaClO3+3H2O。
回答下列问题:
(1)装置A、D中发生反应的离子方程式分别为:A:
(2)装置B能否省去的
(3)装置D中采用冰水浴冷却的目的是
(4)理论上制备14.9g次氯酸钠,需要Cl2
(5)如图是检验Cl2性质的装置图示,完成下列问题。

①装置a中浓H2SO4的作用是
②装置b、c实验现象分别为:b
您最近一年使用:0次



