名校
解题方法
1 . 下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是
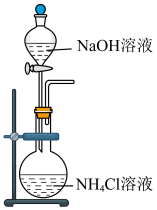 | 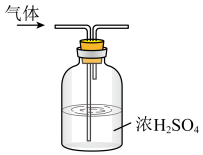 | 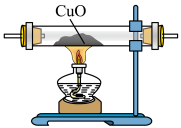 | 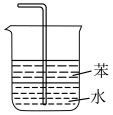 |
| A.用装置制取氨 | B.用装置除去氨中的水蒸气 | C.用装置验证氨具有还原性 | D.用装置吸收尾气 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-20更新
|
222次组卷
|
53卷引用:山东省济南市2020-2021学年高一上学期学情诊断考试化学试题
山东省济南市2020-2021学年高一上学期学情诊断考试化学试题2016届山东省烟台市高三上学期期中测试化学试卷(已下线)5.2.2 氨与铵盐(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)(已下线)【浙江新东方】双师169高一下(已下线)【浙江新东方】双师173高一下上海市南洋模范中学2020-2021学年高一下学期期中考试化学试题江苏省仪征中学2020-2021学年高一下学期4月学情检测化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高一下学期期末考试化学(理)试题江苏省2020-2021学年高一下学期5月百校联考化学试题河北省沧州市第一中学2020-2021学年高一下学期第二次检测化学试题云南省梁河县第一中学2021-2022学年高二上学期开学考试化学试题安徽省合肥市第一中学2021-2022学年高三上学期10月月考化学试题2015届江苏省南通市高三三模化学试卷2016届宁夏六盘山高级中学高三上第二次月考理综化学试卷2015-2016学年江苏省扬州中学高一下3月月考化学试卷2016-2017学年云南省临沧一中高二上起点考试化学卷2017届江苏省丹阳高级中学高三上期初考试化学试卷2017届河北省定州中学高三高补班12月月考化学卷2017届江苏省南通市高三高考全真模拟(五)化学 试卷2016-2017学年黑龙江省大庆实验中学高一下学期第一次月考(4月)化学试卷江苏省常熟市2018届高三上学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【押题专练】【全国百强校】甘肃省天水一中2018-2019学年高一下学期第一阶段考试化学试题(已下线)2019年8月25日 《每日一题》2020年高考一轮复习—— 每周一测2020届高三化学二轮冲刺新题专练——气体制取流程的规范操作(提升练)2020届高三化学一轮复习 化学基础实验(选择题和大题训练)湖北省荆州市2019-2020学年高一上学期期末考试化学试题湖北省武汉市黄陂区第六中学2019-2020学年高一3月月考化学试卷(已下线)3.3.2 氨的转化与生成练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第3节 氮的循环 课时2 氨的转化与生成高一必修第二册(人教2019版)第五章 第二节 氮及其化合物 课时2 氨与铵盐(已下线)练习11 氮的循环-2020-2021学年【补习教材·寒假作业】高一化学(鲁科版2019)云南省宣威市第三中学2021-2022学年高一下学期4月考试化学试题浙江省台州市三门启超中学等两校2021-2022学年高一下学期期中联考化学试题上海市七宝中学2021-2022学年高一下学期线上检测4月月考化学试题广西三新教学质量测评2021-2022学年高一4月段考化学试题贵州省六盘水市六枝特区2021-2022学年高一下学期期中教学质量检测化学试题(已下线)第14讲 氮及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)黑龙江省哈尔滨师范大学附属中学2021-2022学年高一下学期期末考试化学试题(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)云南省石屏县第一中学2021-2022学年高一下学期3月份考试化学试题湖北省罗田县第一中学2021-2022学年高一下学期3月月考化学试题江苏省新高考基地学校2022-2023学年高三上学期第三次大联考化学试题(已下线)5.2.2 氨和铵盐——同步学习必备知识(已下线)第四章 非金属及其化合物 第24练 常见气体的实验室制备、净化和收集江苏省南京市第五高级中学2022-2023学年高一下学期3月月考化学试题(已下线)专题04 常见气体的实验室制取(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)安徽省六安第一中学2022-2023学年高一下学期第一次阶段检测化学试题江苏省扬州市邗江区2022-2023学年高一下学期期中调研测试化学试题北京市第五十中学2022-2023学年高一下学期期中考试化学试题上海市民办南模中学2022-2023学年高一下学期期中考试化学试题第2课时 氨与铵态氮肥黑龙江省牡丹江市第三高级中学2022-2023学年高一下学期期末考试化学试题
名校
2 . 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示(其中Ⅲ、Ⅳ中均为浓硫酸):
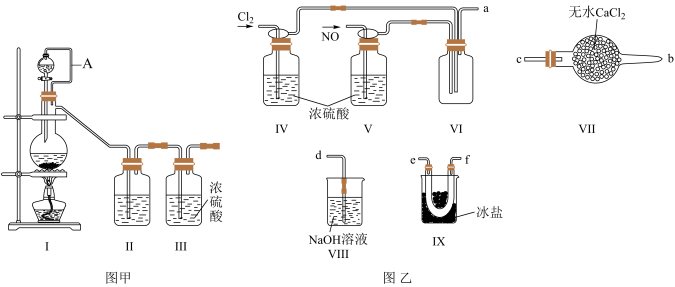
(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
(2)将制得的NO和Cl2通入图乙对应装置制备NOCl。
①装置连接顺序为a→_______ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是_______ 。
③有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、Cl2通入装置Ⅴ中,你同意此观点吗?你的理由是_______ 。
④实验开始的时候,先通入氯气,再通入NO,原因为_______ 。

(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | 浓盐酸 | ① |
| 制备纯净NO | Cu | 稀硝酸 | ② |
①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是
③有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、Cl2通入装置Ⅴ中,你同意此观点吗?你的理由是
④实验开始的时候,先通入氯气,再通入NO,原因为
您最近一年使用:0次
3 . 碳酰氯(COCl2)俗名光气,熔点为-118℃,沸点为8.2℃,遇水迅速水解,生成氯化氢。光气可由氯仿(CHCl3)和氧气在光照条件下合成。下列说法错误的是
| A.装置的连接顺序应为c→b→a→f→e→b→a→d |
| B.装置丙的主要作用是吸收尾气中的氯化氢 |
C.装置丁中发生反应的化学方程式为 |
D.冰水混合物的作用是降温,防止 挥发 挥发 |
您最近一年使用:0次
2023-04-15更新
|
925次组卷
|
5卷引用: 山东省青岛第十七中学2020-2021学年高三下学期期中考试化学试题
解题方法
4 . 利用氧化还原反应可以制备新物质。在实验室中利用二氧化锰与浓盐酸反应制备干燥、纯净的氯气,所用装置如图所示:

(1)连接上述装置的正确顺序(填各接口处的字母):E→_______ 。
(2)烧瓶中发生反应的化学方程式为_______ 。
(3)装置中,饱和食盐水的作用是_______ ;NaOH溶液的作用是_______ 。
(4)化学实验中常用湿润的淀粉—KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到_______ 。
(5)若二氧化锰与浓盐酸的反应中有14.6g HCl被氧化,将产生的氯气通入足量的F中充分反应,转移的电子数为_______ (用NA表示阿伏加德罗常数)。

(1)连接上述装置的正确顺序(填各接口处的字母):E→
(2)烧瓶中发生反应的化学方程式为
(3)装置中,饱和食盐水的作用是
(4)化学实验中常用湿润的淀粉—KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到
(5)若二氧化锰与浓盐酸的反应中有14.6g HCl被氧化,将产生的氯气通入足量的F中充分反应,转移的电子数为
您最近一年使用:0次
解题方法
5 . 下图是实验室制取、提纯氯气及研究氯气性质的装置图。请回答:

(1)盛放浓盐酸的仪器名称是_______ ,实验室制备氯气的化学反应方程式为_______ 。
(2)若要收集到干燥纯净的氯气,A、B瓶所装的试剂分别为_______ 和_______ 。
(3)若D瓶中装有硝酸银溶液,则观察到的现象是_______ ;
(4)E装置中通常盛放的是_______ 溶液,该装置中发生反应的离子方程式为_______ 。

(1)盛放浓盐酸的仪器名称是
(2)若要收集到干燥纯净的氯气,A、B瓶所装的试剂分别为
(3)若D瓶中装有硝酸银溶液,则观察到的现象是
(4)E装置中通常盛放的是
您最近一年使用:0次
6 . 某同学利用如下实验装置制备氯气。回答下列问题:

(1)仪器a的名称为_______ 。
(2)利用二氧化锰与浓盐酸反应制备并收集Cl2时,依次连接装置A、B、C、D、E并加入适当的试剂。装置B中饱和食盐水的作用是_______ ;装置E的作用是_______ ;其反应的化学方程式为_______ 。
(3)某同学欲制取2.24L(标况)氯气,其做法是称取8.7g二氧化锰与40mL10mol·L—1的浓盐酸反应,其做法能否达到目的_______ (填“能”、“或“不能”)。通过计算和文字叙述说明之_______ 。

(1)仪器a的名称为
(2)利用二氧化锰与浓盐酸反应制备并收集Cl2时,依次连接装置A、B、C、D、E并加入适当的试剂。装置B中饱和食盐水的作用是
(3)某同学欲制取2.24L(标况)氯气,其做法是称取8.7g二氧化锰与40mL10mol·L—1的浓盐酸反应,其做法能否达到目的
您最近一年使用:0次
7 . 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
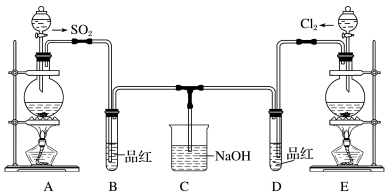
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗中的液体顺利滴下:___________ 。
(2)实验室用装置E制备Cl2,其反应的化学方程式为___________ 。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D 两个试管分别加热;两个试管中的现象分别为:B:___________ ,D:___________ 。
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为___________ 。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)___________ 。

(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗中的液体顺利滴下:
(2)实验室用装置E制备Cl2,其反应的化学方程式为
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D 两个试管分别加热;两个试管中的现象分别为:B:
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
您最近一年使用:0次
2022-12-11更新
|
245次组卷
|
2卷引用:山东省菏泽市单县第二中学2021-2022学年高一上学期(实验班)12月段考化学试题
解题方法
8 . 铁、氯元素的单质及化合物与生产、生活密切相关,请回答下列问题。
(1)铁元素与人体健康密切相关,工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,原因是NaNO2把人体内血红蛋白中的Fe2+转化为Fe3+而失去与O2结合的能力。上述事实说明NaNO2具有_______ 性,工业盐中毒后,可服用维生素C来缓解中毒状况,说明维生素C具有_______ 性。
(2)含氯消毒剂在生产生活中有着广泛的用途。
①写出实验室实中用二氧化锰与浓盐酸制取氯气的离子方程式_______ ,在制备和收集氯气的实验过程中,下列选项正确的是_______ (填字母)。
a.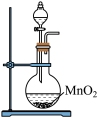 b.
b. 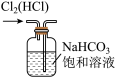 c.
c. 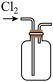 d.
d. 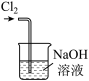
A.用装置a制取氯气 B.用装置b除去氯气中的少量氯化氢
C.用装置c收集氯气 D.用装置d吸收多余的氯气
②实验室也可以用高锰酸钾与浓盐酸制取氯气。已知KMnO4与浓盐酸反应的化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。0.1molKMnO4发生上述反应,消耗_______ molHCl,其中有_______ molHCl被氧化。分别利用二氧化锰和高锰酸钾制备等量的氯气,消耗HCl的物质的量之比为_______ 。
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的数目为_______ 。
④氯气通入石灰乳中可以制得漂白粉,氯气被氧化得到的产物是_______ ,还原剂与氧化剂的质量之比为_______ 。某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与 的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为_______ 。
(1)铁元素与人体健康密切相关,工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,原因是NaNO2把人体内血红蛋白中的Fe2+转化为Fe3+而失去与O2结合的能力。上述事实说明NaNO2具有
(2)含氯消毒剂在生产生活中有着广泛的用途。
①写出实验室实中用二氧化锰与浓盐酸制取氯气的离子方程式
a.
 b.
b.  c.
c.  d.
d. 
A.用装置a制取氯气 B.用装置b除去氯气中的少量氯化氢
C.用装置c收集氯气 D.用装置d吸收多余的氯气
②实验室也可以用高锰酸钾与浓盐酸制取氯气。已知KMnO4与浓盐酸反应的化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。0.1molKMnO4发生上述反应,消耗
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的数目为
④氯气通入石灰乳中可以制得漂白粉,氯气被氧化得到的产物是
 的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
您最近一年使用:0次
名校
9 . 氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备 KClO3和 NaClO,并探究 NaClO 的性质。

回答下列问题:
(1)写出A中发生反应的化学方程式并标明电子转移的方向和数目_______ 。
(2)B的作用是_______ 。
(3)完成C中反应的离子方程式为:_______ 。
_______Cl2+_______OH- 1ClO
1ClO + _______ +_______
+ _______ +_______
(4)探究NaClO的性质:

①I中溶液褪色的原因是_______ 。
②Ⅲ中产生黄绿色气体的原因是_______ (写离子方程式)。
(5)通过上述实验可知,影响氧化还原反应的因素有_______ 。

回答下列问题:
(1)写出A中发生反应的化学方程式并标明电子转移的方向和数目
(2)B的作用是
(3)完成C中反应的离子方程式为:
_______Cl2+_______OH-
 1ClO
1ClO + _______ +_______
+ _______ +_______(4)探究NaClO的性质:

①I中溶液褪色的原因是
②Ⅲ中产生黄绿色气体的原因是
(5)通过上述实验可知,影响氧化还原反应的因素有
您最近一年使用:0次
10 . 用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,2.24LH2O中含有的原子数目为0.3NA |
| B.常温常压下,4.6gNO2与N2O4混合物中含有的氧原子数目为0.2NA |
| C.0.15mol/L K2CO3溶液中含有的钾离子数目为0.3NA |
| D.含有4mol HCl的浓盐酸与足量MnO2共热,生成标准状况下22.4L Cl2 |
您最近一年使用:0次
2022-10-26更新
|
333次组卷
|
2卷引用:山东省青岛第二中学2021-2022学年高一上学期期中考试化学试题



