名校
1 . I.海洋约占地球表面积的71%,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如 、MgSO4等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和食盐水用以生产NaOH、
、MgSO4等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和食盐水用以生产NaOH、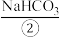 、
、 、
、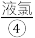 、
、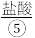 等,苦卤经过氯气氧化,热空气吹出
等,苦卤经过氯气氧化,热空气吹出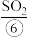 吸收等一系列操作可获得Br2.电解熔融氯化钠可冶炼
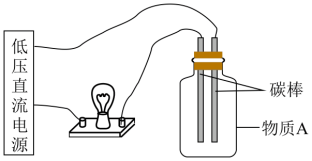
吸收等一系列操作可获得Br2.电解熔融氯化钠可冶炼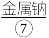 ;海底埋藏大量可燃冰
;海底埋藏大量可燃冰 是一种清洁能源。
是一种清洁能源。
(1)上述标有序号的物质中属于电解质的是___________ (填序号,下同),既不属于电解质也不属于非电解质的是___________ 。
(2)写出③溶于水的电离方程式:___________ 。
(3)在下图所示的装置里,若灯泡亮,广口瓶内的物质A可以是___________ 。(填序号)
(4) 能被水吸收制备次氯酸(HClO),从物质分类的角度看,
能被水吸收制备次氯酸(HClO),从物质分类的角度看, 属于
属于___________ (填“酸性氧化物”、“碱性氧化物”或“不成盐氧化物”)
Ⅱ.海水中的有丰富的卤素资源。地球是一颗蓝色星球,浩瀚的海洋覆盖了70%以上的地球表面,是蕴藏着极为丰富化学资源的“聚宝盆”,其中氯化物含量很高,氯和同族的氟、溴、碘、砹总称为卤素。
(5)将氯气分别通入含下列离子的溶液中,离子浓度减小的是___________。
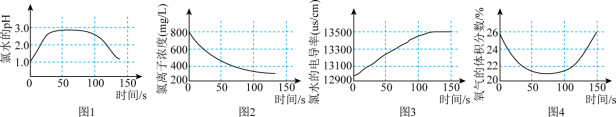
(6)氯气的水溶液即氯水,某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最有可能是其检测结果的是___________。
(7)将氯气通入热的NaOH溶液中,反应得到NaCl, 和
和 的混合溶液,经测定
的混合溶液,经测定 与
与 的个数之比为4∶1,写出该反应总的离子方程式:
的个数之比为4∶1,写出该反应总的离子方程式:___________ 。
 、MgSO4等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和食盐水用以生产NaOH、
、MgSO4等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和食盐水用以生产NaOH、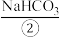 、
、 、
、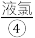 、
、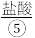 等,苦卤经过氯气氧化,热空气吹出
等,苦卤经过氯气氧化,热空气吹出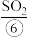 吸收等一系列操作可获得Br2.电解熔融氯化钠可冶炼
吸收等一系列操作可获得Br2.电解熔融氯化钠可冶炼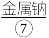 ;海底埋藏大量可燃冰
;海底埋藏大量可燃冰 是一种清洁能源。
是一种清洁能源。(1)上述标有序号的物质中属于电解质的是
(2)写出③溶于水的电离方程式:
(3)在下图所示的装置里,若灯泡亮,广口瓶内的物质A可以是

(4)
 能被水吸收制备次氯酸(HClO),从物质分类的角度看,
能被水吸收制备次氯酸(HClO),从物质分类的角度看, 属于
属于Ⅱ.海水中的有丰富的卤素资源。地球是一颗蓝色星球,浩瀚的海洋覆盖了70%以上的地球表面,是蕴藏着极为丰富化学资源的“聚宝盆”,其中氯化物含量很高,氯和同族的氟、溴、碘、砹总称为卤素。
(5)将氯气分别通入含下列离子的溶液中,离子浓度减小的是___________。
A. | B. | C.Mg2+ | D. |
(6)氯气的水溶液即氯水,某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最有可能是其检测结果的是___________。

| A.图1表示氯水pH随时间的变化 |
| B.图2表示溶液中氯离子浓度随时间的变化 |
| C.图3表示氯水的电导率随时间的变化 |
| D.图4表示液面上方氧气体积分数随时间的变化 |
(7)将氯气通入热的NaOH溶液中,反应得到NaCl,
 和
和 的混合溶液,经测定
的混合溶液,经测定 与
与 的个数之比为4∶1,写出该反应总的离子方程式:
的个数之比为4∶1,写出该反应总的离子方程式:
您最近半年使用:0次
2 . 下列说法正确的是
| A.实验室中金属钠通常保存在煤油里,实验中当有金属钠剩余时不可放回原试剂瓶 |
| B.新制氯水应保存在带玻璃塞的棕色试剂瓶中,并置于阴凉处 |
| C.酒精、钠等着火,可以用二氧化碳灭火器扑灭 |
| D.如果发生氯气泄漏,可用沾NaOH溶液的湿毛巾捂住口鼻,向上风口或地势高的地方躲避 |
您最近半年使用:0次
2023-10-15更新
|
577次组卷
|
4卷引用:四川省遂宁中学校2023-2024学年高一上学期期中(半期)考试化学试题
3 . “绿色化学”走进课堂,某学习小组在老师的指导下,设计了“氯气与金属钠反应”的实验。实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大小的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔化成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
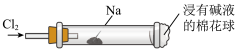

| A.浸有NaOH溶液的棉球主要用于防止空气中二氧化碳进来与钠反应 |
| B.反应生成的大量白烟是氯化钠晶体 |
| C.从实验现象上判断钠的熔点较低 |
| D.钠性质非常活泼,本质原因是钠原子的最外层只有1个电子,该电子很容易失去 |
您最近半年使用:0次
2023-03-22更新
|
190次组卷
|
2卷引用:四川省遂宁中学校2023-2024学年高一上学期期中(半期)考试化学试题
名校
解题方法
4 . 疫情期间保持室内消毒尤为重要。下图是某宝上销售的家用消毒液发生器,可产生消毒液来清除冰箱异味、对厨具消毒等。操作时只需往瓶内加入少许氯化钠和水,按下开关即可。下列有关说法错误的是
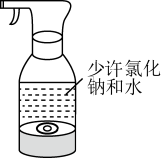

| A.该装置可实现随制随用,且理论上不会有氯气逸出 |
B.通电时, 发生还原反应 发生还原反应 |
| C.通电时,瓶内会产生氢气,使用时应避开火源 |
D.瓶内可能发生反应: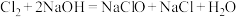 |
您最近半年使用:0次
2022-12-28更新
|
392次组卷
|
4卷引用:四川省遂宁中学校2022-2023学年高二上学期期末考试化学试题
四川省遂宁中学校2022-2023学年高二上学期期末考试化学试题广东省汕头市普通高中2022-2023学年高三上学期教学质量检测化学试题(已下线)专题08 元素及其化合物(练)-2023年高考化学二轮复习讲练测(新高考专用)广东省汕头市2022-2023学年度普通高中毕业班上学期教学质量监测化学试题
名校
5 . X、Y、Z、W为四种短周期元素,其中Y元素最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:请回答下列问题:
(1)W位于周期表中第____ 周期第____ 族,画出该元素阴离子的结构示意图____ 。
(2)X可形成双原子分子,其分子式是____ (填化学式,下同);X和Y形成的简单氢化物中,稳定性较弱的是____ ;Z和W的最高价氧化物的水化物中,酸性较强的是____ 。
(3)工业上将W的单质通入石灰浆中可制得漂白粉,该反应的化学方程式是:____ 。
| X | Y | |
| Z | W |
(2)X可形成双原子分子,其分子式是
(3)工业上将W的单质通入石灰浆中可制得漂白粉,该反应的化学方程式是:
您最近半年使用:0次
名校
解题方法
6 . 下列解释实验事实的离子方程式正确的是
| A.向FeCl3溶液中加入Fe粉,溶液变为浅绿色:Fe3++Fe=2Fe2+ |
| B.实验室制取Cl2时,用NaOH溶液吸收尾气:Cl2+2OH-=ClO-+Cl-+H2O |
C.铜片放入浓HNO3中生成气体:3Cu+8H++2NO =3Cu2++2NO↑+4H2O =3Cu2++2NO↑+4H2O |
D.Ba(OH)2溶液与稀H2SO4反应生成白色沉淀:Ba2++SO +H++OH-=BaSO4↓+H2O +H++OH-=BaSO4↓+H2O |
您最近半年使用:0次
2021-10-22更新
|
260次组卷
|
4卷引用:四川省遂宁市射洪中学2021—2022学年高二上学期期中考试化学试题
7 . 在实验室里可用如图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
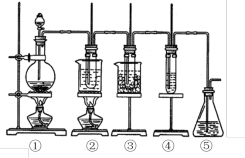
图中①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里盛有15mL 8%NaOH溶液,并置于冰水浴中;④的试管里加有几滴紫色石蕊试液;⑤为尾气吸收装置。
(1)制取氯气时,在______ (填仪器名称)里加入一定量的二氧化锰,通过分液漏斗向其中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________ 的洗气瓶。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,两者的差别是_____ 。
(3)①中制取氯气的化学方程式为________ ;③中制取次氯酸钠的离子方程式为_____ 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
(5)⑤为尾气处理装置,可选用的试剂_____________ 。
A.饱和食盐水 B. Na2S C.高锰酸钾 D. Ca(OH)2

图中①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里盛有15mL 8%NaOH溶液,并置于冰水浴中;④的试管里加有几滴紫色石蕊试液;⑤为尾气吸收装置。
(1)制取氯气时,在
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,两者的差别是
(3)①中制取氯气的化学方程式为
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变为 |
A.饱和食盐水 B. Na2S C.高锰酸钾 D. Ca(OH)2
您最近半年使用:0次
2021-02-01更新
|
142次组卷
|
2卷引用:四川省遂宁市射洪中学2021-2022学年高一上学期第三次(12月)月考(强基班)化学试题
8 . 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
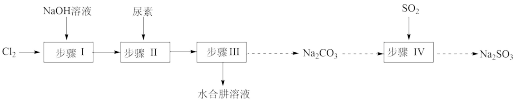
已知:①Cl2+2OH− ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________ ;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________ 。
(2)步骤Ⅱ合成N2H4·H2O的装置如图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________ ;使用冷凝管的目的是_________________________________ 。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、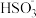 、
、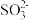 随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
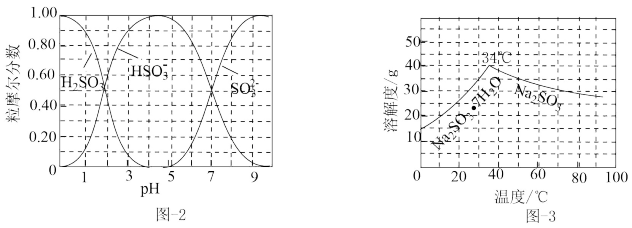
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________ 。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_______________________ ,用少量无水乙醇洗涤,干燥,密封包装。

已知:①Cl2+2OH−
 ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
(2)步骤Ⅱ合成N2H4·H2O的装置如图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、
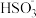 、
、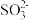 随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:
您最近半年使用:0次
2018-06-10更新
|
6288次组卷
|
17卷引用:四川省射洪县射洪中学2018-2019学年高二上学期开学考试化学试题
四川省射洪县射洪中学2018-2019学年高二上学期开学考试化学试题2018年全国普通高等学校招生统一考试化学(江苏卷)【全国百强校】山西省临汾第一中学2017-2018学年高二下学期期末考试化学试题江西省南昌三中2019届高二下期末考试 化学(已下线)2018年高考题及模拟题汇编 专题15 工艺流程题【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题河南省许昌高级中学2020届高三上学期第一次月考化学试题江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)河北省石家庄市行唐县三中2020届高三11月月考化学试题甘肃省武威第六中学2020届高三上学期第五次过关考试化学试题2020届高三化学选修4二轮专题练——酸碱中和滴定的曲线分析【精编25题】专题5.2 化学实验的设计与评价(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题(已下线)【一飞冲天】名家原创卷1天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题天津西青区2022-2023学年高三上学期期末考试化学试题江苏省南通市通州区金沙中学2022-2023学年高一下学期6月质量监测化学试题
名校
9 . 某同学用下列装置制备并进行有关Cl2的实验。
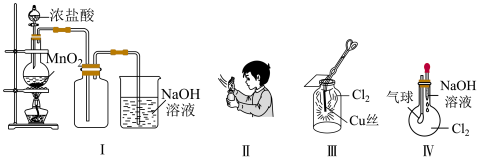
下列说法中正确的是( )

下列说法中正确的是( )
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可被全部消耗 |
| B.Ⅱ图中:闻Cl2的气味 |
| C.Ⅲ图中:生成蓝色的烟 |
| D.Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应 |
您最近半年使用:0次
2017-09-17更新
|
882次组卷
|
13卷引用:四川省遂宁市射洪中学校2023-2024学年高一上学期11月期中化学试题
四川省遂宁市射洪中学校2023-2024学年高一上学期11月期中化学试题2017-2018学年高一人教版必修一:22 氯气的实验室制法氯离子的检验课时训练化学试题广东省汕头市金山中学2017-2018学年高一上学期期末考试化学试题河北省冀州市中学2017-2018学年高一3月月考化学试题2.2.2 氯气的实验室制法 氯离子的检验 练习(已下线)【新东方】2019新中心五地005高中化学(已下线)2.2.2 氯气的实验室制法 氯离子的检验 练习(1)——《高中新教材同步备课》(人教版 必修第一册)江苏省南京市第十二中学2020-2021学年高一上学期期中考试化学试题云南省玉溪市峨山县第一中学2020-2021学年高一下学期期中考试化学试题广东省广州市三校2021-2022学年高一上学期期中联考化学试题广东省深圳市观澜中学2021-2022学年高一上学期12月月考质量检测化学试题 山东省济宁市兖州区2022-2023学年高一上学期期中考试化学试题新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二8月分班考试化学试题
10 . 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:
在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,KMnO4晶体迅速溶解,然后产生气体,立即将表面皿盖好。
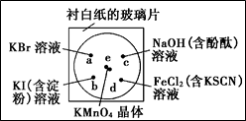
已知:2KMnO4 + 16HCl(浓) == 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O ]。
(1) e处反应的离子方程式为____________ 。
该反应中氧化剂和还原剂的物质的量之比为____________ 。
(2) b处的实验现象为____________ ,d处的实验现象为____________ 。
(3) c处反应的化学方程式为____________ 。标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的个数约为____________ 。
(4) 通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
____________ (填“能”或“不能”),若能,其氧化性由强到弱的顺序是____________ 。
在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,KMnO4晶体迅速溶解,然后产生气体,立即将表面皿盖好。

已知:2KMnO4 + 16HCl(浓) == 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O ]。
(1) e处反应的离子方程式为
该反应中氧化剂和还原剂的物质的量之比为
(2) b处的实验现象为
(3) c处反应的化学方程式为
(4) 通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
您最近半年使用:0次



