名校
解题方法
1 . 次氯酸盐具有强氧化性。在碱性条件下,利用KClO氧化Fe(NO3)3生成高铁酸钾K2FeO4的工艺流程如下:
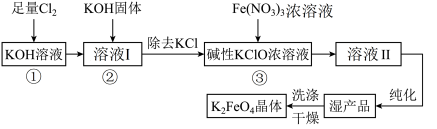
已知:6KOH+3Cl2=5KCl+KClO3+3H2O
回答下列问题:
(1)反应①应在___________ (填“温度较高”或“温度较低”)的情况下进行,该反应的离子方程式为___________ 。
(2)在溶液I中加入KOH固体的目的是___________ 。
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为___________ 。
(4)K2FeO4可作饮用水处理剂,该反应的离子方程式:4FeO +10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是
+10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是___________ ;K2FeO4可用于杀菌消毒的原因是___________ 。
(5)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2物质的量为___________ mol。

已知:6KOH+3Cl2=5KCl+KClO3+3H2O
回答下列问题:
(1)反应①应在
(2)在溶液I中加入KOH固体的目的是
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为
(4)K2FeO4可作饮用水处理剂,该反应的离子方程式:4FeO
 +10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是
+10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是(5)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2物质的量为
您最近半年使用:0次
2024-01-19更新
|
250次组卷
|
3卷引用:四川省宜宾市第四中学校2023-2024学年高一上学期1月期末化学试题
名校
解题方法
2 . 实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。氯气和氢氧化钙在温度较高时会生成副产物氯酸钙,甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
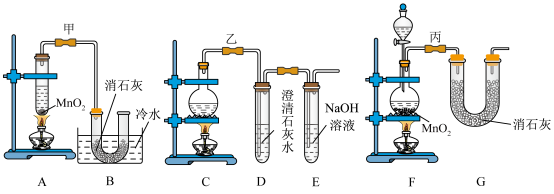
(1)请写出实验室使用浓盐酸、二氧化锰共热制氯气的离子方程式:___________ 。
(2)哪位同学的装置能够有效地防止副反应的发生?___________ 。
(3)请写出氯气和氢氧化钙制备漂白粉的化学方程式:___________ 。
(4)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)___________ 。
(5)实验中若用12mol·L-1的浓盐酸200mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3mol,其可能的主要原因是___________ (假定各步反应均无反应损耗且无副反应发生)。

(1)请写出实验室使用浓盐酸、二氧化锰共热制氯气的离子方程式:
(2)哪位同学的装置能够有效地防止副反应的发生?
(3)请写出氯气和氢氧化钙制备漂白粉的化学方程式:
(4)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)
(5)实验中若用12mol·L-1的浓盐酸200mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3mol,其可能的主要原因是
您最近半年使用:0次
2024-01-02更新
|
23次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高一上学期1月期末化学试题
名校
解题方法
3 . 用图1所示装置向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加NaOH溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法不正确的是
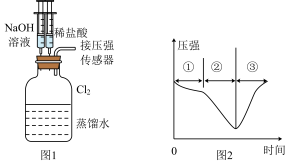

| A.阶段①说明氯气可溶于水,溶于水的氯气全部与水反应 |
| B.阶段②的压强变小,该过程发生了氧化还原反应 |
| C.阶段③发生反应的化学方程式为:2HCl+NaClO=Cl2↑+H2O+NaCl |
| D.若将Cl2换成CO2,所得的压强变化趋势与图2相似 |
您最近半年使用:0次
2023-12-25更新
|
70次组卷
|
2卷引用:四川省宜宾市兴文第二中学校2023-2024学年高一上学期1月期末化学试题
4 . 如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条,F中为红色的铜网,其右端出气管口放有脱脂棉。
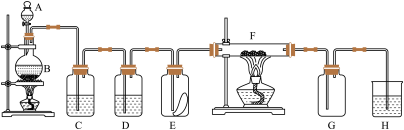
(1)写出实验室制取氯气的化学方程式:___________ 。
(2)装置C中盛装的溶液是___________ ,作用是___________ 。D中盛装的试剂是___________ ,作用是___________ 。
(3)E中红色布条是否褪色?___________ ,F中的反应产物为___________ 。
(4)若H中选用NaOH溶液进行尾气处理,则发生的反应是___________ (用离子方程式表示)。

(1)写出实验室制取氯气的化学方程式:
(2)装置C中盛装的溶液是
(3)E中红色布条是否褪色?
(4)若H中选用NaOH溶液进行尾气处理,则发生的反应是
您最近半年使用:0次
2023-07-16更新
|
63次组卷
|
2卷引用:四川省宜宾市兴文第二中学校2023-2024学年高一上学期12月月考化学试题
名校
解题方法
5 . 已知氯气与强碱溶液反应时,生成的产物受温度的影响。实验室中利用如图1装置(部分装置省略)制备KClO3和NaClO,并探究其氧化还原性质。
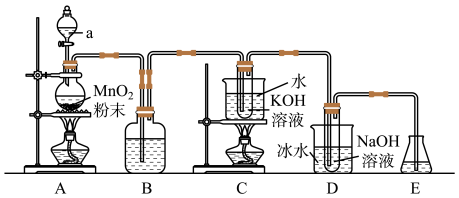
图1
回答下列问题:
(1)仪器a的名称是_______ 。
(2)装置A产生氯气的化学方程式为_______ 。
(3)装置B中的试剂为_______ ,该装置作用为_______ 。
(4)装置C采用的加热方式是_______ ,装置D中发生反应的离子方程式为_______ 。
(5)装置E的作用是_______ ,可选用试剂_______ 。(填标号)
a.NaCl溶液b.NaOH溶液c.稀硫酸
(6)探究KClO3和NaClO的氧化能力(图2)
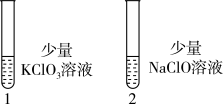
图2
操作:向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力KClO3_______ NaClO。(填“大于”或“小于”)
(7)工业上常用氯碱工业来制备氯气,其原理为电解饱和食盐水,生成氯气的同时还可得到氢气和烧碱,请写出该反应的离子方程式_______ 。

图1
回答下列问题:
(1)仪器a的名称是
(2)装置A产生氯气的化学方程式为
(3)装置B中的试剂为
(4)装置C采用的加热方式是
(5)装置E的作用是
a.NaCl溶液b.NaOH溶液c.稀硫酸
(6)探究KClO3和NaClO的氧化能力(图2)

图2
操作:向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力KClO3
(7)工业上常用氯碱工业来制备氯气,其原理为电解饱和食盐水,生成氯气的同时还可得到氢气和烧碱,请写出该反应的离子方程式
您最近半年使用:0次
2023-03-13更新
|
316次组卷
|
3卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高一上学期10月月考化学试题
四川省宜宾市叙州区第一中学校2023-2024学年高一上学期10月月考化学试题吉林省吉林市普通高中2022-2023学年高一上学期期末考试化学试题(已下线)第08讲 氯气的实验室制法及氯离子的检验-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)
6 . 下表列出了七种短周期元素在周期表中的位置:

(1) 单质的结构式为
单质的结构式为_______ 。
(2)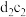 化合物的电子式为
化合物的电子式为_______ ,该化合物与水反应的化学方程式为_______ 。
(3)元素c在周期表中的位置是_______ ,c的两种同素异形体的化学式为_______ 。
(4)元素d、e、f、g形成的简单离子中,离子半径最小的是_______ (填离子符号)。
(5) 单质通入d元素最高价氧化物的水化物中可制备“84消毒液”,该反应的离子方程式为
单质通入d元素最高价氧化物的水化物中可制备“84消毒液”,该反应的离子方程式为_______ 。
(6)下列事实不能说明g的非金属性比f的非金属性强的是_______。

(1)
 单质的结构式为
单质的结构式为(2)
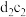 化合物的电子式为
化合物的电子式为(3)元素c在周期表中的位置是
(4)元素d、e、f、g形成的简单离子中,离子半径最小的是
(5)
 单质通入d元素最高价氧化物的水化物中可制备“84消毒液”,该反应的离子方程式为
单质通入d元素最高价氧化物的水化物中可制备“84消毒液”,该反应的离子方程式为(6)下列事实不能说明g的非金属性比f的非金属性强的是_______。
| A.将g的单质通入f的气态氢化物形成的溶液中,有淡黄色沉淀产生 |
B.气态氢化物稳定性: |
C.f单质与 化合时产物中 化合时产物中 为 为 价,g单质与 价,g单质与 化合时产物中 化合时产物中 为 为 价 价 |
D.氧化物对应水化物的酸性: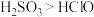 |
您最近半年使用:0次
2023-01-12更新
|
215次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2022-2023学年高一下学期开学考试化学试题
名校
7 . 如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(内置有铁粉)。请回答下列问题:
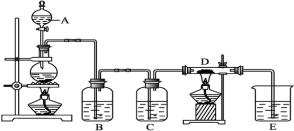
(1)仪器A的名称是_______ ,烧瓶中反应的化学方程式是_______ 。
(2)装置B中盛放的溶液是_______ ,装置C中作用是_______
(3)D中反应的化学方程式是_______ 。
(4)烧杯E中反应的离子方程式是_______ 。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应。为收集D中产物,在D与E之间,除增加收集装置外,还需要增加_______ 装置。

(1)仪器A的名称是
(2)装置B中盛放的溶液是
(3)D中反应的化学方程式是
(4)烧杯E中反应的离子方程式是
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应。为收集D中产物,在D与E之间,除增加收集装置外,还需要增加
您最近半年使用:0次
2023-01-06更新
|
55次组卷
|
2卷引用:四川省宜宾市兴文第二中学校2023-2024学年高一下学期开学化学试题
名校
解题方法
8 . 实验室中常用二氧化锰与浓盐酸共热制取氯气。某化学兴趣小组为制取较为纯净、干燥的氯气,设计了如下实验装置。请按要求回答下列问题:
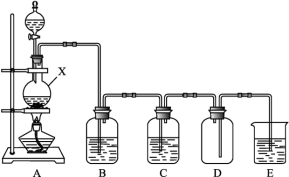
(1)仪器X的名称为_______ ,其中发生反应的化学方程式为_______
(2)欲除去 中的HCl,装置B中应选用的试剂为
中的HCl,装置B中应选用的试剂为_______ 。
(3)进入装置B的 中含有的杂质,除HCl外还有
中含有的杂质,除HCl外还有_______ ,欲除去该杂质,装置C中盛放的试剂名称为_______ 。
(4)装置D中的一处明显错误为_______ 。
(5)装置E中的试剂为_______
(6)假设收集到VL(标准状况下) ,与过量冷的石灰乳完全反应,所得漂白粉中有效成分
,与过量冷的石灰乳完全反应,所得漂白粉中有效成分 的质量为
的质量为_______ g(用含V的代数式表示)。

(1)仪器X的名称为
(2)欲除去
 中的HCl,装置B中应选用的试剂为
中的HCl,装置B中应选用的试剂为(3)进入装置B的
 中含有的杂质,除HCl外还有
中含有的杂质,除HCl外还有(4)装置D中的一处明显错误为
(5)装置E中的试剂为
(6)假设收集到VL(标准状况下)
 ,与过量冷的石灰乳完全反应,所得漂白粉中有效成分
,与过量冷的石灰乳完全反应,所得漂白粉中有效成分 的质量为
的质量为
您最近半年使用:0次
2022-12-04更新
|
34次组卷
|
3卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高一上学期12月月考化学试题
名校
9 . 下列实验操作能达到实验目的的是
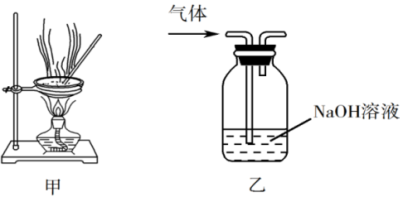

| A.用湿润的pH试纸测量溶液的pH |
| B.用装置甲蒸干NaCl溶液制备无水NaCl固体 |
| C.用装置乙除去实验室所制氯气中的少量HCl |
| D.将4.0gNaOH固体置于100mL容量瓶中,加水至刻度,配制1.0mol·L−1NaOH溶液 |
您最近半年使用:0次
2022-11-28更新
|
80次组卷
|
2卷引用:四川省兴文第二中学校2023-2024学年高一上学期11月期中考试化学试题
10 . 实验室里除了用二氧化锰和浓盐酸加热制取氯气,也可以在常温下利用反应:
制取并收集纯净、干燥的氯气,装置如图所示:

(1)装置A中盛放浓盐酸的仪器名称是_______ ,该装置相比普通分液漏斗的优点是_______ 。
(2)装置B的作用是_______ ,装置C中盛装的药品是_______ 。
(3)D装置收集氯气采用了方法_______。(填序号)
(4)装置E中发生反应的化学方程式是_______ 。
(5)工业上制备氯气通常利用反应_______ (填化学方程式),阴极的产物是_______ 。

制取并收集纯净、干燥的氯气,装置如图所示:

(1)装置A中盛放浓盐酸的仪器名称是
(2)装置B的作用是
(3)D装置收集氯气采用了方法_______。(填序号)
| A.向下排空气法 | B.向上排空气法 | C.排水法 | D.排饱和食盐水 |
(5)工业上制备氯气通常利用反应
您最近半年使用:0次
2022-11-28更新
|
142次组卷
|
2卷引用:四川省宜宾市第四中学校2022-2023学年高一下学期开学考试化学试题



