解题方法
1 . 实验室模拟工业漂白液脱除废水中氨氮 的流程如下:
的流程如下:
粗盐水 精制盐水
精制盐水 Cl2
Cl2 漂白液
漂白液 NaCl
NaCl
下列分析正确的是
 的流程如下:
的流程如下:粗盐水
 精制盐水
精制盐水 Cl2
Cl2 漂白液
漂白液 NaCl
NaCl下列分析正确的是
A.漂白液的有效成分是 |
| B.①中蒸发浓缩粗盐水,不用加入其它试剂,即可得到纯氯化钠 |
C.③中制备漂白液的反应: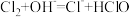 |
| D.②、③、④中均发生了氧化还原反应 |
您最近半年使用:0次
名校
2 . 下列有关物质性质、用途的描述错误的是
A. 易液化,可用于制取漂白液 易液化,可用于制取漂白液 |
B. 有还原性,在葡萄酒中添加适量的 有还原性,在葡萄酒中添加适量的 能防止葡萄酒的氧化变质 能防止葡萄酒的氧化变质 |
C. 分解生成 分解生成 和 和 是吸热反应,故 是吸热反应,故 可用作阻燃剂 可用作阻燃剂 |
D.铁粉具有还原性,能够除去污水中的 、 、 |
您最近半年使用:0次
2024-04-17更新
|
409次组卷
|
5卷引用:湖北省九师联盟2024届高三下学期3月质量检测(W-G)化学试卷
湖北省九师联盟2024届高三下学期3月质量检测(W-G)化学试卷广西壮族自治区部分学校2023-2024学年高三下学期教学质量监测联考(二模)化学试题江西省部分地区2023-2024学年高三下学期3月月考化学试题甘肃省酒泉市九师联盟2023-2024学年高三下学期3月月考化学试题(已下线)题型6 元素及其化合物 化学实验基础(25题)-2024年高考化学常考点必杀300题(新高考通用)
解题方法
3 . 某学习小组利用二氧化锰与浓盐酸反应制取纯净、干燥的氯气,装置如下图所示。请回答下列问题:
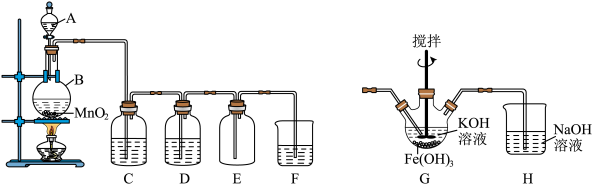
(1)仪器A的名称是___________ ,该反应原理用离子反应方程表示为___________ 。
(2)装置C内盛放的试剂是___________ 。
(3)D中溶液的作用是___________ 。
(4)F装置吸收氯气,可得漂白液的有效成分:___________ (填化学式);漂白粉长时间暴露在空气中会变质,请结合化学方程式解释其原因:___________ 。
(5)反应结束后,能证明仪器B内的溶液中含有Cl-的试剂是___________ (填化学式)。
(6)高铁酸钾(K2FeO4)是一种高效低污染的水处理剂,其制备原理是将B中产生的Cl2通入G装置,产物有K2FeO4、KCl和H2O。若消耗3个Cl2分子,共转移___________ 个电子。则G装置中的反应化学方程式为___________ 。

(1)仪器A的名称是
(2)装置C内盛放的试剂是
(3)D中溶液的作用是
(4)F装置吸收氯气,可得漂白液的有效成分:
(5)反应结束后,能证明仪器B内的溶液中含有Cl-的试剂是
(6)高铁酸钾(K2FeO4)是一种高效低污染的水处理剂,其制备原理是将B中产生的Cl2通入G装置,产物有K2FeO4、KCl和H2O。若消耗3个Cl2分子,共转移
您最近半年使用:0次
4 . 实验室利用以下反应可以快速制取少量氯气: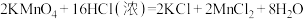
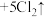 ,关于该反应的说法正确的是
,关于该反应的说法正确的是
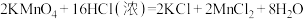
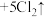 ,关于该反应的说法正确的是
,关于该反应的说法正确的是| A.由该反应判断氧化性:KMnO4>Cl2 |
| B.氧化剂与还原剂的物质的量之比为1:8 |
| C.可以用饱和NaHCO3溶液除去Cl2中混有的HCl |
| D.1 mol Cl2与足量的NaOH溶液充分反应制备“84”消毒液,转移电子的物质的量为2 mol |
您最近半年使用:0次
5 . 用图1所示装置向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器加NaOH溶液,再利用注射器加稀硫酸,测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法正确的是
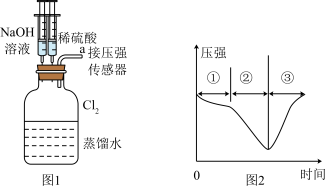

A.阶段①发生反应的离子方程式为: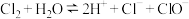 |
| B.阶段②的压强变小,可利用该过程发生的反应制备漂白粉 |
C.若将集气瓶中的物质换为铁粉,将a导管伸入盛有水的烧杯中,注射器重复相同操作可制备 |
D.若将 换为 换为 ,所得压强变化趋势与图2相似 ,所得压强变化趋势与图2相似 |
您最近半年使用:0次
6 . 1774年,瑞典化学家舍勒用盐酸和锰矿反应产生氯气,某小组受此启发,设计下列实验,其中能实现的是
 |  |  |  |
| A.制备氯气 | B.干燥氯气 | C.纯化氯气 | D.制备漂粉精 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
7 . 已知: (红)、
(红)、 (棕)、
(棕)、 (无色);
(无色); 。某小组设计如图实验:
。某小组设计如图实验:

实验观察到乙中现象:无色→蓝色→棕黄→无色。下列叙述错误的是
 (红)、
(红)、 (棕)、
(棕)、 (无色);
(无色); 。某小组设计如图实验:
。某小组设计如图实验:
实验观察到乙中现象:无色→蓝色→棕黄→无色。下列叙述错误的是
| A.丙的作用是吸收尾气,避免氯气排入空气中污染环境 |
| B.甲中现象是先变红色后褪色,微热甲又变红色 |
C.乙中变“棕黄”是因为 被氧化成 被氧化成 和 和 的混合物 的混合物 |
D.用 淀粉试纸和醋酸可检验乙中刚好反应成无色溶液后是否含 淀粉试纸和醋酸可检验乙中刚好反应成无色溶液后是否含 |
您最近半年使用:0次
8 . 1984年,北京地坛医院研制出能迅速杀灭各种肝炎病毒的“84”消毒液。
回答下列问题:
(1)常温下,将氯气通入NaOH溶液中可制得“84”消毒液,该反应的化学方程式为___________ 。
(2)已知某“84”消毒液瓶体部分标签如图所示。
①“84”消毒液使用时需要稀释,某小组用上述“84”消毒液配制500mL0.2mol/L的稀溶液,需要用量筒量取该“84”消毒液体积为___________ mL。
②配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是___________ 。
A.容量瓶使用时未干燥
B.用量筒量取溶液时俯视刻度线
C.玻璃棒和烧杯没有洗涤
D.定容时仰视刻度线
(3)为研究“84”消毒液的性质与使用条件,向三支试管中分别加入2mL“84”消毒液和5滴石蕊试液,溶液呈蓝色,迅速进行如下实验:
①已知酸性 ,“实验1”中NaClO溶液与空气中
,“实验1”中NaClO溶液与空气中 反应的离子方程式为
反应的离子方程式为___________ 。
②“实验3”中可能出现的现象为___________ 。
③综合以上实验,为提高单位时间内“84”消毒液的漂白效果或安全性,你的建议是___________ 。
回答下列问题:
(1)常温下,将氯气通入NaOH溶液中可制得“84”消毒液,该反应的化学方程式为
(2)已知某“84”消毒液瓶体部分标签如图所示。
| “84”消毒液 有效成分:NaClO 规格:1000mL 质量分数:25% 密度:1.192g/cm3 |
②配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是
A.容量瓶使用时未干燥
B.用量筒量取溶液时俯视刻度线
C.玻璃棒和烧杯没有洗涤
D.定容时仰视刻度线
(3)为研究“84”消毒液的性质与使用条件,向三支试管中分别加入2mL“84”消毒液和5滴石蕊试液,溶液呈蓝色,迅速进行如下实验:
| 实验 | 操作 | 现象 |
| 实验1 | 加入2mL蒸馏水 | 短时间内未褪色,一段时间后蓝色褪去 |
| 实验2 | 加入2mL0.0002mol/L的 溶液 溶液 | 蓝色迅速褪去,无气体产生 |
| 实验3 | 加入2mL2mol/L的 溶液 溶液 | …… |
 ,“实验1”中NaClO溶液与空气中
,“实验1”中NaClO溶液与空气中 反应的离子方程式为
反应的离子方程式为②“实验3”中可能出现的现象为
③综合以上实验,为提高单位时间内“84”消毒液的漂白效果或安全性,你的建议是
您最近半年使用:0次
名校
9 . 将 通入含
通入含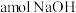 的溶液中,反应会放热,温度升高后发生反应:
的溶液中,反应会放热,温度升高后发生反应: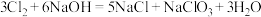 .当
.当 完全反应时,下列说法正确的是
完全反应时,下列说法正确的是
 通入含
通入含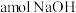 的溶液中,反应会放热,温度升高后发生反应:
的溶液中,反应会放热,温度升高后发生反应: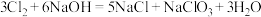 .当
.当 完全反应时,下列说法正确的是
完全反应时,下列说法正确的是A.反应中作氧化剂的 有 有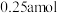 |
B.若反应后溶液中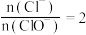 ,则 ,则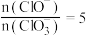 |
C. 与 与 的物质的量之和可能为 的物质的量之和可能为 |
D.反应中转移电子的物质的量可能为 |
您最近半年使用:0次
名校
解题方法
10 . 次氯酸盐具有强氧化性。在碱性条件下,利用KClO氧化Fe(NO3)3生成高铁酸钾K2FeO4的工艺流程如下:
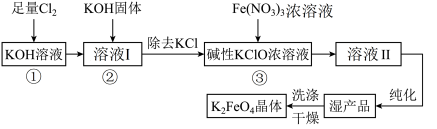
已知:6KOH+3Cl2=5KCl+KClO3+3H2O
回答下列问题:
(1)反应①应在___________ (填“温度较高”或“温度较低”)的情况下进行,该反应的离子方程式为___________ 。
(2)在溶液I中加入KOH固体的目的是___________ 。
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为___________ 。
(4)K2FeO4可作饮用水处理剂,该反应的离子方程式:4FeO +10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是
+10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是___________ ;K2FeO4可用于杀菌消毒的原因是___________ 。
(5)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2物质的量为___________ mol。

已知:6KOH+3Cl2=5KCl+KClO3+3H2O
回答下列问题:
(1)反应①应在
(2)在溶液I中加入KOH固体的目的是
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为
(4)K2FeO4可作饮用水处理剂,该反应的离子方程式:4FeO
 +10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是
+10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是(5)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2物质的量为
您最近半年使用:0次
2024-01-19更新
|
247次组卷
|
3卷引用:湖北省沙市中学2023-2024学年高一上学期11月月考化学试题



