名校
解题方法
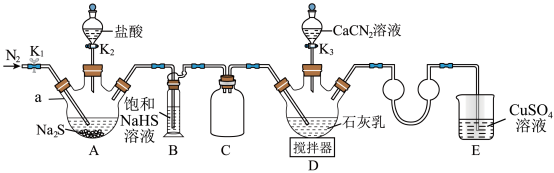
1 . 硫脲[CS(NH2)2]在药物制备、金属矿物浮选等方面有广泛应用。实验室可通过先制备Ca(HS)2,然后Ca(HS)2再与CaCN2合成CS(NH2)2实验装置(夹持及加热装置略)如图所示。回答下列问题:
(1)仪器a的名称是___________ ,装置B中饱和NaHS溶液的作用是___________ 。装置C的作用为___________ 。
(2)检查装置气密性后加入药品,打开K1,通入一段时间N2,目的是___________ ;然后关闭K1,打开K2,待A中反应结束后关闭K2。
(3)撤走搅拌器,水浴加热装置D,打开K3,在80℃条件下合成硫脲,控制温度在80°C的原因是___________ 。待D中反应结束后,关闭K3,打开K1,通入一段时间N2,目的是___________ 。
(4)设计实验证明反应过程中硫脲发生异构化生成了NH4SCN;取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴___________ 溶液(填化学式),溶液变为红色,则可证明。
(5)装置E中CuSO4溶液的作用是___________ (用离子方程式表示)。
(6)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取m g产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用c mol/L酸性KMnO4标准溶液滴定,滴定至终点时消耗标准溶液V mL(已知滴定时,硫脲转化为CO2、N2和 ,假设杂质不参与反应)。则样品中硫脲的质量分数为
,假设杂质不参与反应)。则样品中硫脲的质量分数为___________ (用含m、c、V的代数式表示)。
(1)仪器a的名称是
(2)检查装置气密性后加入药品,打开K1,通入一段时间N2,目的是
(3)撤走搅拌器,水浴加热装置D,打开K3,在80℃条件下合成硫脲,控制温度在80°C的原因是
(4)设计实验证明反应过程中硫脲发生异构化生成了NH4SCN;取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴
(5)装置E中CuSO4溶液的作用是
(6)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取m g产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用c mol/L酸性KMnO4标准溶液滴定,滴定至终点时消耗标准溶液V mL(已知滴定时,硫脲转化为CO2、N2和
 ,假设杂质不参与反应)。则样品中硫脲的质量分数为
,假设杂质不参与反应)。则样品中硫脲的质量分数为
您最近一年使用:0次
2024-05-12更新
|
212次组卷
|
3卷引用:河南省漯河市高级中学2023-2024学年高三下学期5月月考化学试题
名校
解题方法
2 . SO2是硫元素中一种重要物质。在生产生活中有着重要用途。
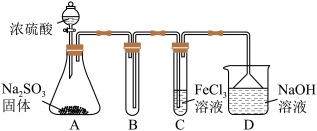
(1)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。_____ 。根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
a.请设计实验方案检验溶液中是否还有Fe3+:_____ 。
b.该小组同学向C试管反应后的溶液中先加入稀硝酸,后加入BaCl2溶液,发现出现白色沉淀,即可证明反应生成了SO 。该做法
。该做法_____ (填“合理”或“不合理”),理由是_____ 。
②为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有_____ (填字母)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
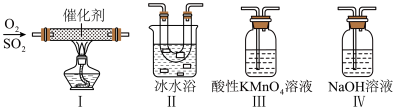
(2)某同学利用如图所示的装置研究SO2的性质:(已知熔点:SO2:-76.1℃,SO3:16.8℃,沸点:SO2:-10℃,SO3:45℃)_____ 。
②乙同学按Ⅰ、Ⅱ、III顺序连接装置,发现装置III溶液褪色,出现该现象的原因是_____ (用离子方程式表示)。
③乙同学按Ⅰ、Ⅱ、Ⅳ顺序连接装置,若装置Ⅳ中有50mL2.5mol·L-1NaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是_____ 。
(1)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
a.请设计实验方案检验溶液中是否还有Fe3+:
b.该小组同学向C试管反应后的溶液中先加入稀硝酸,后加入BaCl2溶液,发现出现白色沉淀,即可证明反应生成了SO
 。该做法
。该做法②为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究SO2的性质:(已知熔点:SO2:-76.1℃,SO3:16.8℃,沸点:SO2:-10℃,SO3:45℃)
②乙同学按Ⅰ、Ⅱ、III顺序连接装置,发现装置III溶液褪色,出现该现象的原因是
③乙同学按Ⅰ、Ⅱ、Ⅳ顺序连接装置,若装置Ⅳ中有50mL2.5mol·L-1NaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是
您最近一年使用:0次
2024-04-03更新
|
267次组卷
|
2卷引用:河南省漯河市高级中学2023-2024学年高一下学期3月月考化学试题
解题方法
3 . 下列实验操作、现象和结论都正确且有相关性的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向Na2SiO3溶液中加入醋酸 | 产生白色沉淀 | 非金属性:C>Si |
| B | 在溴水中滴加适量植物油(无色) | 橙色溶液变无色,液体分层 | 植物油含有不饱和碳碳键 |
| C | 测定饱和的碳酸和亚硫酸溶液的pH值 | 亚硫酸溶液的pH较小 | 酸性:H2SO3>H2CO3 |
| D | 检验铁钉表面的铁锈是不是含有Fe3+,先加盐酸溶解,再滴加KSCN溶液 | 溶液未变红色 | 铁锈中不含Fe3+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 下列离子方程式书写不正确 的是
A.向 溶液中通入氯气: 溶液中通入氯气: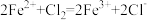 |
B.向 溶液中滴加 溶液中滴加 溶液: 溶液: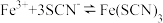 |
C.向 溶液中加入少量氨水: 溶液中加入少量氨水: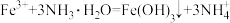 |
D.向 溶液中过量铜粉: 溶液中过量铜粉: |
您最近一年使用:0次
2024-02-02更新
|
139次组卷
|
2卷引用:河南省漯河市高级中学2023-2024学年高一上学期1月月考化学试题
名校
5 . 化学与生产、生活密切相关,下列说法正确的是
| A.纯碱受热易分解,常用作焙制糕点的膨松剂 |
| B.氯气具有漂白性,常用作棉、麻和纸张的漂白剂 |
| C.氧化铁呈红棕色,常用作油漆、涂料的红色颜料 |
D. 溶液具有较强的氧化性,常用于刻蚀印刷电路板铜箔 溶液具有较强的氧化性,常用于刻蚀印刷电路板铜箔 |
您最近一年使用:0次
2023-12-01更新
|
278次组卷
|
4卷引用:河南省漯河市高级中学2023-2024学年高一上学期模拟预测化学试题
名校
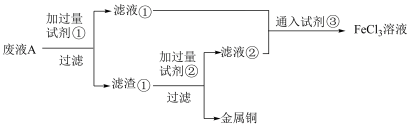
6 . 欲从FeCl3腐蚀铜后所得的废液A中回收铜,并重新获得FeCl3溶液,设计实验方案如图:
下列说法错误的是

下列说法错误的是
| A.试剂①为Fe,若溶解1molFe,则生成Fe2+的物质的量≤3mol |
| B.试剂②、试剂③可能为稀盐酸、Cl2 |
| C.滤渣①的成分为Fe和Cu |
| D.若废液A中含有amolCuCl2和bmolFeCl3,则最终可获得含(a+1.5b)molFeCl3的溶液 |
您最近一年使用:0次
2023-10-04更新
|
189次组卷
|
2卷引用:河南省平顶山市临颍县第一高级中学2022-2023学年高一下学期开学考试化学试题
名校
7 . 下列实验设计能达到实验目的的是
| 选项 | 实验目的 | 实验设计 |
| A | 制备并较长时间保存Fe(OH)2 | 向盛有FeSO4溶液的敞口容器中加入NaOH溶液 |
| B | 检验Fe2+ | 取适量待测液,先加入适量氯水,再滴入几滴KSCN溶液,观察溶液是否变红 |
| C | 除去二氧化碳中的HCl气体 | 先将混合气体通过饱和碳酸氢钠溶液,再通过浓硫酸 |
| D | 检验未知溶液中是否含有CO | 取适量待测液,加入稀盐酸,观察是否有能使澄清石灰水变浑浊的气体产生 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 下列物质的鉴别方法不正确 的是
| A.用灼烧法鉴别纯羊毛和合成纤维 |
| B.用KSCN溶液鉴别FeCl2溶液和FeCl3溶液 |
| C.用焰色反应鉴别NaCl溶液和Na2SO4溶液 |
| D.用加热的方法鉴别Na2CO3固体和NaHCO3固体 |
您最近一年使用:0次
名校
解题方法
9 . 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,其制备流程如图所示,下列叙述正确的是
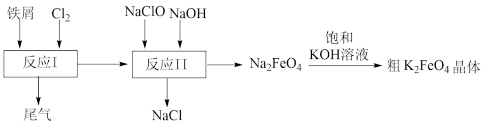
| A.K2FeO4能杀菌消毒,利用了其强还原性 |
| B.K2FeO4在杀菌消毒过程中被还原成Fe3+,Fe3+进一步与水反应生成胶体,具有沉降水中泥沙的作用 |
| C.流程中的三步反应都是氧化还原反应 |
D.向Na2FeO4溶液中加入饱和KOH溶液能析出K2FeO4晶体,说明该条件下的溶解度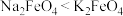 |
您最近一年使用:0次
2022-11-30更新
|
242次组卷
|
4卷引用:河南省漯河市高级中学2023-2024学年高一上学期模拟预测化学试题
名校
10 . 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 将铜粉加入到1.0 Fe2(SO4)3溶液中 Fe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | SO2通入到紫色石蕊中 | 溶液先变红,后褪色 | 二氧化硫具有酸性和漂白性 |
| D | 向久置的Na2SO3溶液中加入过量盐酸,再加入少量BaCl2溶液 | 出现白色浑浊 | 该溶液已氧化变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-12-14更新
|
512次组卷
|
3卷引用:河南省漯河市高级中学2021-2022学年高三上学期第四次模拟考试化学试题
河南省漯河市高级中学2021-2022学年高三上学期第四次模拟考试化学试题广东省广州市华南师范大学附属中学2021-2022学年高三上学期第三次月考(11月)化学试题(已下线)第19周 晚练题-备战2022年高考化学周测与晚练(新高考专用)



