解题方法
1 . 下列离子方程式正确的是
A.化工生产中漂白粉的制备: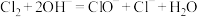 |
B.过氧化钠溶于水: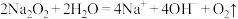 |
C.铁与氯化铁溶液的反应: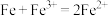 |
D.用小苏打治疗胃酸过多: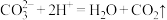 |
您最近半年使用:0次
2 . 铁及其化合物在日常生产生活中有着广泛应用。
I.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。现设计如下装置完成高温下“Fe与水蒸气反应”的实验,并检验其产物(已知:Fe3O4中Fe的化合价为+2价、+3价)。
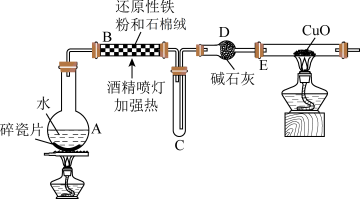
(1)装置B中发生反应的化学方程式为___________ 。
(2)装置C中导管“短进长出”的原因___________ 。
(3)取反应后得到的黑色粉末放入一试管中,加入稀硫酸将固体溶解,再滴加几滴KSCN溶液,振荡,溶液没有出现红色,原因是___________ (用离子方程式表示)。
II.某学生设计了如图装置制备白色Fe(OH)2固体。
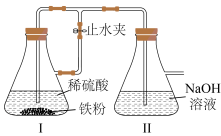
(4)开始实验时,先打开止水夹,待装置中空气已排尽,再关闭止水夹。
①关闭止水夹前,如何证明装置中空气已排尽:___________ 。
②装置II中发生反应的主要化学方程式为___________ 。
③若未排净装置中的空气,则装置II中观察到的实验现象为___________ 。
I.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。现设计如下装置完成高温下“Fe与水蒸气反应”的实验,并检验其产物(已知:Fe3O4中Fe的化合价为+2价、+3价)。

(1)装置B中发生反应的化学方程式为
(2)装置C中导管“短进长出”的原因
(3)取反应后得到的黑色粉末放入一试管中,加入稀硫酸将固体溶解,再滴加几滴KSCN溶液,振荡,溶液没有出现红色,原因是
II.某学生设计了如图装置制备白色Fe(OH)2固体。

(4)开始实验时,先打开止水夹,待装置中空气已排尽,再关闭止水夹。
①关闭止水夹前,如何证明装置中空气已排尽:
②装置II中发生反应的主要化学方程式为
③若未排净装置中的空气,则装置II中观察到的实验现象为
您最近半年使用:0次
名校
解题方法
3 . 如图为铁元素的“价—类”二维图,请回答下列问题。

(1)图中“ ”代表的物质类别为
”代表的物质类别为_______ 。图中物质只具有还原性的是_______ (填化学式)。
(2)在烧制砖瓦时,用黏土做成的坯经过烘烧后,铁的化合物转化成___________ (填字母,下同)而制得红色砖瓦;若烘烧后期从窑顶向下慢慢浇水,窑内会产生大量 、
、 气体,它们把该红色物质还原成黑色的
气体,它们把该红色物质还原成黑色的___________ ,同时还有未燃烧的碳的颗粒,而制得了青色砖瓦。
A. B.
B. C.
C. D.
D.
(3)根据上述“价—类”二维图判断 中
中 元素的价态,写出
元素的价态,写出 与稀盐酸反应的离子方程式
与稀盐酸反应的离子方程式___________ 。
(4)用坩埚钳夹住一束铁丝,灼烧后立即放入充满氯气的集气瓶中,观察到的现象是铁丝剧烈燃烧,___________ 。
(5)以绿矾(主要成分 ,部分
,部分 已被氧化为
已被氧化为 )为原料,生产铁红
)为原料,生产铁红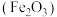 的工艺流程如图:
的工艺流程如图:
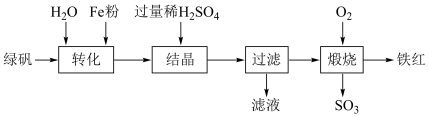
①“转化”过程中,加入过量 粉时发生反应的离子方程式为
粉时发生反应的离子方程式为___________ 。
②“结晶”时,加入过量稀硫酸的目的是___________ 。
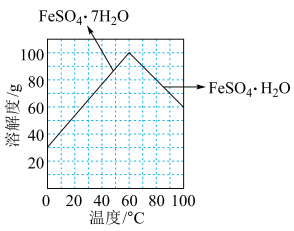
③“结晶”时,控制温度在75℃左右进行(相关物质的溶解度见图),从溶液中析出的晶体是___________ (填化学式)。
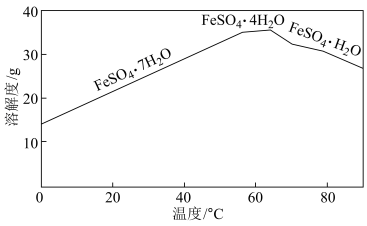
④“煅烧”时生成铁红的化学方程式为___________ 。

(1)图中“
 ”代表的物质类别为
”代表的物质类别为(2)在烧制砖瓦时,用黏土做成的坯经过烘烧后,铁的化合物转化成
 、
、 气体,它们把该红色物质还原成黑色的
气体,它们把该红色物质还原成黑色的A.
 B.
B. C.
C. D.
D.
(3)根据上述“价—类”二维图判断
 中
中 元素的价态,写出
元素的价态,写出 与稀盐酸反应的离子方程式
与稀盐酸反应的离子方程式(4)用坩埚钳夹住一束铁丝,灼烧后立即放入充满氯气的集气瓶中,观察到的现象是铁丝剧烈燃烧,
(5)以绿矾(主要成分
 ,部分
,部分 已被氧化为
已被氧化为 )为原料,生产铁红
)为原料,生产铁红 的工艺流程如图:
的工艺流程如图:
①“转化”过程中,加入过量
 粉时发生反应的离子方程式为
粉时发生反应的离子方程式为②“结晶”时,加入过量稀硫酸的目的是
③“结晶”时,控制温度在75℃左右进行(相关物质的溶解度见图),从溶液中析出的晶体是

④“煅烧”时生成铁红的化学方程式为
您最近半年使用:0次
4 . 铁、铜等金属及其化合物在日常生产生活中有非常广泛的用途。
I.化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子: 、
、 ,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。
,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。

(1)操作①的名称是___________ 。加入铁屑先发生的离子反应为:___________ 。
(2)沉淀A中含有的金属单质有___________ 。
(3)操作②中观察到的实验现象是___________ 。
(4)操作③中发生反应的离子方程式为___________ 。
II.某化学实验小组通过实验来探究一包黑色粉是否含有 、CuO,探究过程如下:
、CuO,探究过程如下:
提出假设:
假设1.黑色粉末是CuO;
假设2.黑色粉末是 ;
;
假设3.黑色粉末是CuO和 的混合物。
的混合物。
设计探究实验:取少量粉末放入足量稀硫酸中,得溶液X,取一定量X于试管中,向其中滴加KSCN溶液。
(5)若假设1成立,则实验现象是___________ 。
(6)若假设2成立,则实验现象是___________ 。如何检验溶液X中含 离子?
离子?___________ 。
(7)若假设3成立,需继续向X溶液加入足量铁粉,则实验现象是___________ 。
I.化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:
 、
、 ,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。
,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。
(1)操作①的名称是
(2)沉淀A中含有的金属单质有
(3)操作②中观察到的实验现象是
(4)操作③中发生反应的离子方程式为
II.某化学实验小组通过实验来探究一包黑色粉是否含有
 、CuO,探究过程如下:
、CuO,探究过程如下:提出假设:
假设1.黑色粉末是CuO;
假设2.黑色粉末是
 ;
;假设3.黑色粉末是CuO和
 的混合物。
的混合物。设计探究实验:取少量粉末放入足量稀硫酸中,得溶液X,取一定量X于试管中,向其中滴加KSCN溶液。
(5)若假设1成立,则实验现象是
(6)若假设2成立,则实验现象是
 离子?
离子?(7)若假设3成立,需继续向X溶液加入足量铁粉,则实验现象是
您最近半年使用:0次
名校
解题方法
5 . 向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉。假设反应分为两个阶段。第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段反应的离子方程式___________ 、___________ 。
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式_________ 。
(3)在图中画出溶液中Fe2+、 离子的物质的量随加入铁粉的物质的量变化的关系图像
离子的物质的量随加入铁粉的物质的量变化的关系图像___________ (纵坐标是溶液中离子的物质的量)。

(1)写出这两个阶段反应的离子方程式
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式
(3)在图中画出溶液中Fe2+、
 离子的物质的量随加入铁粉的物质的量变化的关系图像
离子的物质的量随加入铁粉的物质的量变化的关系图像
您最近半年使用:0次
名校
6 . 下列实验操作及现象、结论均正确的是
实验操作及现象 | 结论 | |
A | 加热坩埚,迅速投入绿豆大小的金属钠,眼睛近距离俯视观察到钠先熔化后出现黄色火焰,生成淡黄色固体 | Na在空气燃烧生成Na2O2 |
B | 向硅酸钠水溶液中滴加盐酸,出现白色沉淀硅酸 | 非金属性:Cl>Si |
C | 将点燃的H2伸入盛满Cl2的集气瓶中,发生剧烈爆炸 | H2和Cl2剧烈反应 |
D | FeCl3溶液中加入足量铁粉,铁粉溶解,溶液由棕黄色变为浅绿色 | Fe3+具有氧化性,Fe具有还原性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024-02-17更新
|
82次组卷
|
3卷引用:安徽省阜阳市红旗中学2023-2024学年高一上学期期末考试 化学试题
名校
7 . 把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是
| A.硫酸铁溶液 | B.硫酸铜溶液 | C.稀硫酸 | D.硝酸银溶液 |
您最近半年使用:0次
8 . 实验室配制的FeSO4溶液很容易因氧化变质,欲防止它变质,应在溶液中加入
A. | B. | C. | D. |
您最近半年使用:0次
9 . 绿矾(FeSO4·7H2O)具有补血消积、燥湿杀虫功效。工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等杂质)制备绿矾的工业流程如图所示:
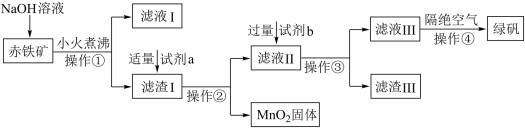
已知:Al2O3可溶于强碱溶液
(1)操作①的名称是___________ ,该操作要用到玻璃棒,其作用为___________ 。
(2)试剂a为稀硫酸,试剂b为铁粉,加入过量试剂b后金属元素之间发生反应的离子方程式为___________ 、___________ 。
(3)滤渣Ⅲ含有___________ ,将其快速分离的方法是___________ 。
(4)操作④隔绝空气的目的是___________ 。

已知:Al2O3可溶于强碱溶液
(1)操作①的名称是
(2)试剂a为稀硫酸,试剂b为铁粉,加入过量试剂b后金属元素之间发生反应的离子方程式为
(3)滤渣Ⅲ含有
(4)操作④隔绝空气的目的是
您最近半年使用:0次
10 . 实验室由硫铁矿烧渣(主要成分为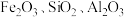 )制备软磁性材料
)制备软磁性材料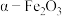 ,主要转化流程如下。
,主要转化流程如下。
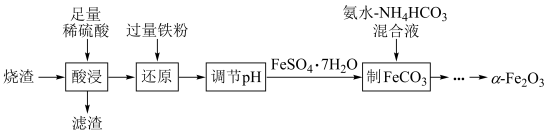
已知: 为酸性氧化物。
为酸性氧化物。
回答下列问题:
(1)“酸浸”时, 与稀硫酸反应的化学方程式为
与稀硫酸反应的化学方程式为______________ ;“滤渣”中主要成分的化学式为______________ 。
(2)“还原”时,加入过量铁粉的主要目的是______________ ;该过程除生成 外,还会生成
外,还会生成_______ (填化学式)。
(3)根据表格信息,“调节 ”时的
”时的 范围为
范围为_______ 。
(4)“调节 ”后获得
”后获得 晶体,根据如图所示的绿矾溶解度曲线,补充完整“调节
晶体,根据如图所示的绿矾溶解度曲线,补充完整“调节 ”后获得
”后获得 晶体的实验操作:向
晶体的实验操作:向 溶液中先加入稀硫酸酸化,在
溶液中先加入稀硫酸酸化,在 氛围中,
氛围中,_______ ,过滤,少量冰水洗涤,低温干燥,得到 晶体。
晶体。
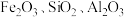 )制备软磁性材料
)制备软磁性材料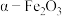 ,主要转化流程如下。
,主要转化流程如下。
离子 | 开始沉淀 | 完全沉淀 |
| 5.8 | 8.8 |
| 1.6 | 2.8 |
| 3.2 | 5.0 |
 为酸性氧化物。
为酸性氧化物。回答下列问题:
(1)“酸浸”时,
 与稀硫酸反应的化学方程式为
与稀硫酸反应的化学方程式为(2)“还原”时,加入过量铁粉的主要目的是
 外,还会生成
外,还会生成(3)根据表格信息,“调节
 ”时的
”时的 范围为
范围为(4)“调节
 ”后获得
”后获得 晶体,根据如图所示的绿矾溶解度曲线,补充完整“调节
晶体,根据如图所示的绿矾溶解度曲线,补充完整“调节 ”后获得
”后获得 晶体的实验操作:向
晶体的实验操作:向 溶液中先加入稀硫酸酸化,在
溶液中先加入稀硫酸酸化,在 氛围中,
氛围中, 晶体。
晶体。
您最近半年使用:0次




