名校
1 . 将含有氧化铁的铁片投入足量稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且溶液中的Fe2+与生成的H2的物质的量之比为5∶2,则原混合物中氧化铁与铁的物质的量之比为
| A.1∶1 | B.1∶2 | C.1∶3 | D.2∶5 |
您最近半年使用:0次
2 . 铁片投入下列溶液,溶液质量增加,但无气体产生的是
| A.盐酸 | B.FeCl3溶液 | C.稀硫酸 | D.Cu(NO3)2溶液 |
您最近半年使用:0次
3 . 金属铜能被氯化铁浓溶液腐蚀,其化学反应是:Cu+2FeCl3=CuCl2+2FeCl2。现将有铜的印刷线路板浸入120mL氯化铁浓溶液中,有9.6g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶解的物质。(设溶液体积不变,且不考虑金属离子水解)。请回答下列问题:
(1)向溶液中加入铁粉后,发生反应的离子反应方程式为______________ ,______________ 。
(2)充分反应后,溶液中存在4.8g不溶物的成分为______________________ 。
(3)充分反应后溶液中一定不存在的金属离子为_________________________ 。
(4)比较Fe2+、Fe3+、Cu2+的氧化性大小:_______________________________ 。
(5)试计算最后溶液中Fe2+离子的物质的量浓度______________ mol/L
(1)向溶液中加入铁粉后,发生反应的离子反应方程式为
(2)充分反应后,溶液中存在4.8g不溶物的成分为
(3)充分反应后溶液中一定不存在的金属离子为
(4)比较Fe2+、Fe3+、Cu2+的氧化性大小:
(5)试计算最后溶液中Fe2+离子的物质的量浓度
您最近半年使用:0次
2016-12-09更新
|
288次组卷
|
3卷引用:2015-2016学年辽宁省大连二十中高一上学期期末考试化学试卷
4 . 有硫酸、硫酸亚铁、硫酸铁的混合液200mL、已知溶液中各阳离子的物质的量浓度相等,硫酸根离子的浓度为3.0 mol·L-1,则该溶液理论上可溶解铁粉的质量为
| A.5.6g | B.11.2g | C.14.Og | D.16.8g |
您最近半年使用:0次
5 . 下列关于各图的叙述正确的是
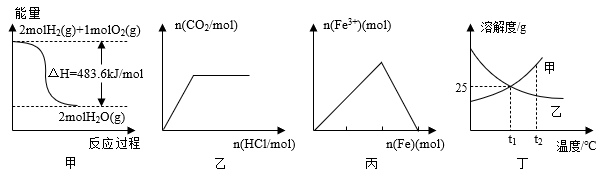

| A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 |
| B.乙表示向碳酸钠溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸的物质的量的关系 |
| C.丙表示在稀硝酸溶液中加入铁粉,溶液中Fe3+的变化曲线 |
| D.丁表示t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 |
您最近半年使用:0次
2016-12-09更新
|
191次组卷
|
3卷引用:2016届江苏省泰州中学高三上学期期中测试化学试卷
6 . CuO、Fe粉、Fe3O4的混合物中,加一定量稀硫酸,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,片刻后.取出铁钉,观察现象。以下结论中正确的是
| A.若铁钉部分溶解,则滤液中一定含Fe2(SO4)3 |
| B.若铁钉完全溶解,则滤液中一定含CuSO4 |
| C.若铁钉表面有红色物质生成,则不溶物中一定不含Fe |
| D.若铁钉无变化,则不溶物中一定含Fe |
您最近半年使用:0次
解题方法
7 . 在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3各0.01mol的混和溶液中,加入0.01mol的铁粉,经充分搅拌后,产生的变化是
| A.铁溶解,析出0.01molZn |
| B.铁溶解,析出铜,且溶液中不含有Fe3+ |
| C.铁溶解,析出0.01molCu |
| D.铁溶解,溶液中金属阳离子只剩Fe2+和Zn2+ |
您最近半年使用:0次
名校
8 . 将一定量的铁粉加入到一定量的硝酸银和硝酸镁的混合液中,充分反应后过滤,向滤渣中加入稀硫酸,有气泡产生,则在滤渣中
| A.一定有银、铁和镁 | B.仅有银和铁 |
| C.可能含镁 | D.只有银 |
您最近半年使用:0次
2016-12-09更新
|
244次组卷
|
2卷引用:2015-2016学年山西省忻州市第一中学高一上入学化学试卷
解题方法
9 . 把含有氧化铁的铁投入到足量的稀硫酸中,直到固体全部溶解,经分析,溶液中无Fe3+,且生成的Fe2+与反应产生的氢气的物质的量之比为10:7,则原混合物中单质铁的质量分数为
| A.26.3% | B.73.7% |
| C.88.2% | D.95.1% |
您最近半年使用:0次
2016-12-09更新
|
490次组卷
|
2卷引用:2014-2015学年四川省成都市树德中学高一下学期期末考试化学试卷
10 . 某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是__________________________________ 。
(2)已知:20℃时溶解度/g
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________________ 。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有_______________________________________ 。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因________ 。
(4)步骤Ⅲ中,加入Na2SO3的目的是_______________________ 。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:______

②下面检测钝化效果的方法合理的是______ 。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是
(2)已知:20℃时溶解度/g
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| 1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因
(4)步骤Ⅲ中,加入Na2SO3的目的是
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:

②下面检测钝化效果的方法合理的是
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
您最近半年使用:0次
2016-12-09更新
|
967次组卷
|
3卷引用:2015届北京市清华大学附属中学高三3月综合测(二)化学试卷



