解题方法
1 . 超细铜粉有重要用途,工业上可以通过铝黄铜合金(含Cu、Al、Zn)制超细铜粉。某小组在实验室模拟制备超细铜粉的方法如下:
步骤Ⅰ:取铝黄铜合金加入热浓硫酸溶解,再加入过量NaOH溶液只生成Cu(OH)2沉淀,过滤,洗涤。
步骤Ⅱ:向Cu(OH)2沉淀中加硫酸溶解,再加氨水,形成 [Cu(NH3)4]SO4溶液。
步骤Ⅲ:向[Cu(NH3)4]SO4溶液中通入SO2气体至溶液呈微酸性,生成NH4CuSO3。再与足量的1.000mol·L-1的稀硫酸混合并微热,得到超细铜粉。
(1)步骤Ⅰ中完全溶解铝黄铜合金可以加入稀硫酸和____ 。
A.FeCl3 B.盐酸 C.热空气
(2)配制500 mL 1.000 mol·L-1的稀硫酸,需要用98%的浓硫酸(密度为1.84 g·mL-1)____ mL。
(3)在步骤Ⅲ中生成NH4CuSO3的化学反应方程式为____ 。
(4)准确称取1.000 g铝黄铜合金与足量的1.000 mol·L-1稀硫酸完全反应,生成标准状况下气体体积为134.4 mL。将相同质量的合金完全溶于热的足量的浓硫酸,产生标准状况下气体体积为380.8mL。计算此合金中铜的质量分数________ 。
步骤Ⅰ:取铝黄铜合金加入热浓硫酸溶解,再加入过量NaOH溶液只生成Cu(OH)2沉淀,过滤,洗涤。
步骤Ⅱ:向Cu(OH)2沉淀中加硫酸溶解,再加氨水,形成 [Cu(NH3)4]SO4溶液。
步骤Ⅲ:向[Cu(NH3)4]SO4溶液中通入SO2气体至溶液呈微酸性,生成NH4CuSO3。再与足量的1.000mol·L-1的稀硫酸混合并微热,得到超细铜粉。
(1)步骤Ⅰ中完全溶解铝黄铜合金可以加入稀硫酸和
A.FeCl3 B.盐酸 C.热空气
(2)配制500 mL 1.000 mol·L-1的稀硫酸,需要用98%的浓硫酸(密度为1.84 g·mL-1)
(3)在步骤Ⅲ中生成NH4CuSO3的化学反应方程式为
(4)准确称取1.000 g铝黄铜合金与足量的1.000 mol·L-1稀硫酸完全反应,生成标准状况下气体体积为134.4 mL。将相同质量的合金完全溶于热的足量的浓硫酸,产生标准状况下气体体积为380.8mL。计算此合金中铜的质量分数
您最近一年使用:0次
名校
解题方法
2 . 为探究黑色固体 X(仅含两种元素)的组成和性质,设计并完成如下实验:
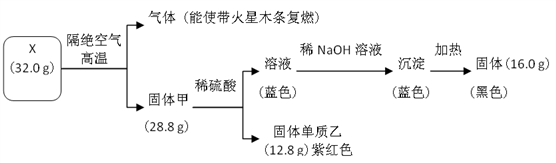
请回答:
(1)X 的化学式是______________ 。
(2)写出蓝色溶液转化为蓝色沉淀的离子方程式是______________ 。
(3)写出固体甲与稀硫酸反应的化学方程式______________ 。

请回答:
(1)X 的化学式是
(2)写出蓝色溶液转化为蓝色沉淀的离子方程式是
(3)写出固体甲与稀硫酸反应的化学方程式
您最近一年使用:0次
2018-03-14更新
|
471次组卷
|
3卷引用:浙江省舟山中学2017-2018学年高一下学期开学考试化学试题
3 . 在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.MnO2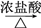 Cl2 Cl2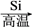 SiCl4 SiCl4 | B.Fe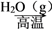 Fe2O3 Fe2O3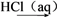 FeCl3 FeCl3 |
C.S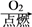 SO2 SO2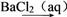 BaSO3 BaSO3 | D.CuSO4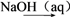 Cu(OH)2 Cu(OH)2 Cu Cu |
您最近一年使用:0次
名校
4 . CuSO4是一种重要的化工原料,有关制备途径及性质如图所示。下列说法错误的是
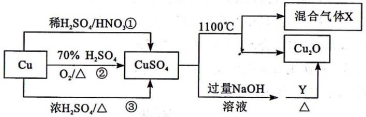
| A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 |
| B.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量: ①=②<③ |
C.硫酸铜在1100℃分解的方程式为:2CuSO4 Cu2O+SO2↑+SO3↑+O2↑ Cu2O+SO2↑+SO3↑+O2↑ |
| D.当Y为葡萄糖时,葡萄糖发生还原反应 |
您最近一年使用:0次
2018-01-25更新
|
976次组卷
|
8卷引用:陕西省榆林市2018届高考模拟第一次测试化学试题
陕西省榆林市2018届高考模拟第一次测试化学试题福建2020届高三化学总复习专题训练——无极工艺流程选择填空题02 2024年苏州西交大附中高一3月月考(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练广东省惠州市惠城区2021--2022学年高三上学期8月开学摸底化学试题(已下线)第8周 晚练题-备战2022年高考化学周测与晚练(新高考专用)辽宁省名校联盟2022-2023学年高三上学期10月联合考试化学试题广东省湛江市第二中学2023届高三上学期第一次月考化学试题
名校
5 . 下列化合物的俗称与化学式不对应的是
| A.熟石灰:CaO | B.纯碱:Na2CO3 |
| C.醋酸:CH3COOH | D.胆矾:CuSO4·5H2O |
您最近一年使用:0次
名校
6 . 随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,可用适当方法在包装袋中装入
| A.无水硫酸铜、蔗糖 | B.生石灰、硫酸亚铁 |
| C.食盐、硫酸亚铁 | D.生石灰、食盐 |
您最近一年使用:0次
2018-01-02更新
|
544次组卷
|
22卷引用:2015-2016学年江苏省泰州中学高一上第二次月考化学试卷
2015-2016学年江苏省泰州中学高一上第二次月考化学试卷江苏省姜堰第二中学2018-2019学年高二上学期期末考试化学试题(已下线)2011-2012学年吉林省长春市十一高中高一上学期期末考试化学试卷(已下线)2012-2013学年福建省福清东张中学高一上学期期末考试化学试卷(已下线)2014秋吉林省长春市第十一高中高一上学期期中化学试卷2014-2015湖南省浏阳一中等三校高一12月联考化学试卷2014-2015江西省赣州市赣县中学北校区高一12月月考化学试卷2014-2015湖北省孝感高级中学高一3月月考化学试卷2015-2016学年天津静海一中高一上12月学业调研化学卷陕西省咸阳市西藏民族学院附属中学2015-2016学年高一上期末化学卷2016届江西省于都实验中学高三上学期第三次大考化学试卷2015-2016学年辽宁省抚顺市六校协作体高一上学期期末考试化学试卷2015-2016学年安徽省阜阳市太和八中高一上学期期末文化学试卷甘肃省临夏中学2018届高三上学期期中考试化学试题湖北省荆州中学2017-2018学年高一12月月考化学试题湖南省醴陵市第一中学2017-2018学年高一上学期第二次月考(12月)化学试题河南省洛阳市2018-2019学年高一上学期期末考试化学试题甘肃省静宁县第一中学2019-2020学年高一上学期期末考试化学试题湖南省长沙市南雅中学2019-2020学年高一下学期入学考试化学试题河北省沧州市黄骅中学2019-2020学年高一上学期第二次月考化学试题新疆哈密市第八中学2021-2022学年高一上学期期末考试化学试题广东省汕头市潮阳区2022-2023学年高一上学期教学质量检测化学试题
7 . 某兴趣小组用碱式碳酸铜[CuCO3·Cu(OH)2]制取铜粉并测定铜粉纯度的实验如下:
步骤1:将一定量的碱式碳酸铜置于烧杯中,向烧杯中加入N2H4的水溶液,边搅拌边加热,有大量的气体生成和红色铜析出,将沉淀过滤、低温干燥得红色粉末。
步骤2:称取1.9600 g红色粉末于烧杯中,缓慢加入足量稀硫酸,边加热边通入氧气使粉末完全溶解。冷却,将溶液移入100 mL 容量瓶中,用水稀释至刻度。
书骤3:准确量取20.00mL的溶液,调节溶液呈弱酸性,向其中加入过量的KI.,充分反应后,以淀粉溶液作指示剂,用0.2000mol/LNa2S2O3标准溶液滴定,滴定终点时共消耗Na2S2O3标准溶液30.00 mL.过程中所发生的反应如下:Cu2++I- CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
(1)步骤1中所发生反应的化学方程式为_________________ 。
(2)步骤2 中所发生反应的离子方程式为_________________ 。
(3)步骤3 中加入过量KI的作用是_________________ 。
(4)若铜粉中杂质不参与步骤3 的反应,通过计算确定红色粉末中含铜质量分数(写出计算过程)________ 。
步骤1:将一定量的碱式碳酸铜置于烧杯中,向烧杯中加入N2H4的水溶液,边搅拌边加热,有大量的气体生成和红色铜析出,将沉淀过滤、低温干燥得红色粉末。
步骤2:称取1.9600 g红色粉末于烧杯中,缓慢加入足量稀硫酸,边加热边通入氧气使粉末完全溶解。冷却,将溶液移入100 mL 容量瓶中,用水稀释至刻度。
书骤3:准确量取20.00mL的溶液,调节溶液呈弱酸性,向其中加入过量的KI.,充分反应后,以淀粉溶液作指示剂,用0.2000mol/LNa2S2O3标准溶液滴定,滴定终点时共消耗Na2S2O3标准溶液30.00 mL.过程中所发生的反应如下:Cu2++I-
 CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。(1)步骤1中所发生反应的化学方程式为
(2)步骤2 中所发生反应的离子方程式为
(3)步骤3 中加入过量KI的作用是
(4)若铜粉中杂质不参与步骤3 的反应,通过计算确定红色粉末中含铜质量分数(写出计算过程)
您最近一年使用:0次
2017-12-17更新
|
172次组卷
|
2卷引用:江苏省百校2018届高三12月大联考化学试题
解题方法
8 . 淡黄色粉末物质A有以下转化关系:
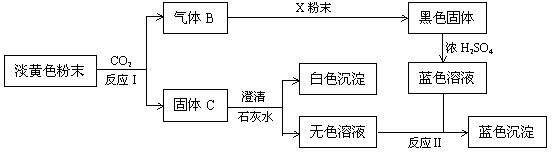
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是___________ , X粉末是___________ 。
(2)写出反应Ⅰ的化学方程式____________________________________________ 。
(3)写出反应Ⅱ的离子方程式____________________________________________ 。

根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是
(2)写出反应Ⅰ的化学方程式
(3)写出反应Ⅱ的离子方程式
您最近一年使用:0次
名校
9 . 溴化亚铜可用作工业催化剂,是一种白色粉末,微溶于冷水,不溶于乙醇等有机溶剂,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末。制备CuBr的实验步骤如下:

步骤1.在如上图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时。
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去水中的________________ (写化学式)。
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为__________________ ;
②控制反应在60℃进行,实验中可采取的措施是____________________ ;
③说明反应已完成的现象是_____________________ 。
(3)步骤2过滤需要避光的原因是_____________________ 。
(4)步骤3中洗涤剂需“溶有SO2”的原因是____________________ 。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。
请补充实验步骤[须用到SO2(贮存在钢瓶中)、20%NaOH溶液]:
①_________________ 。
②___________________ 。
③加入少量维生素C溶液(抗氧剂),蒸发浓缩,冷却结晶。
④过滤,用乙醇洗涤2~3次。⑤放真空干燥箱中干燥。

步骤1.在如上图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时。
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去水中的
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为
②控制反应在60℃进行,实验中可采取的措施是
③说明反应已完成的现象是
(3)步骤2过滤需要避光的原因是
(4)步骤3中洗涤剂需“溶有SO2”的原因是
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。
请补充实验步骤[须用到SO2(贮存在钢瓶中)、20%NaOH溶液]:
①
②
③加入少量维生素C溶液(抗氧剂),蒸发浓缩,冷却结晶。
④过滤,用乙醇洗涤2~3次。⑤放真空干燥箱中干燥。
您最近一年使用:0次
2017-11-27更新
|
561次组卷
|
3卷引用:江苏省泰州中学2018届高三上学期期中考试化学试题
10 . 下列物质间的转化不能一步实现的是( )
| A.Na2CO3 → NaOH | B.Ca(OH)2 → CaCO3 |
| C.NaNO3 → NaCl | D.CuSO4 → FeSO4 |
您最近一年使用:0次
2017-11-24更新
|
209次组卷
|
3卷引用:福建省福州市八县(市)协作校2017-2018学年高一上学期期中联考化学试题



