2020·江苏·模拟预测
解题方法
1 . 实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图所示。
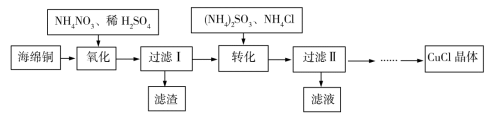
已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60~70℃,原因是____________________ 。
(2)写出“转化”过程中的离子方程式____________________ 。
(3)“过滤Ⅱ”所得滤液经__________ 、__________ 、过滤等操作获得(NH4)2SO4晶体,可用作化学肥料。“过滤Ⅱ”所得滤渣主要成分为CuCl,用乙醇洗涤的优点是________________ 。
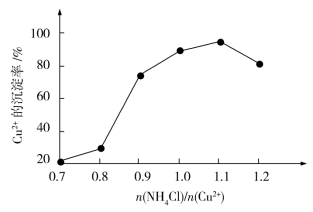
(4)氯化铵用量[ ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是__________ 。
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:__________ 。(实验中可选试剂:0.1 mol·L−1盐酸、10 mol·L−1盐酸、蒸馏水、无水乙醇)

已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60~70℃,原因是
(2)写出“转化”过程中的离子方程式
(3)“过滤Ⅱ”所得滤液经
(4)氯化铵用量[
 ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:
您最近一年使用:0次
2020·江苏·模拟预测
解题方法
2 . 下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将SO2气体通入酸性KMnO4溶液 | 溶液褪色 | SO2具有漂白性 |
| B | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀产生,苯层呈紫红色 | Cu2+有氧化性,白色沉淀可能为CuI |
| C | 向蛋白质溶液中分别加入甲醛、(NH4)2SO4饱和溶液 | 均有白色沉淀生成 | 蛋白质均发生了变性 |
| D | 向5 mL 0.1 mol·L−1 KI溶液中加入1 mL 0.1 mol·L−1 FeCl3溶液,振荡,用苯萃取2~3次后,取下层溶液滴加5滴KSCN溶液 | 出现血红色 | 反应2Fe3++2I− 2Fe2++I2是有一定限度的 2Fe2++I2是有一定限度的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 已知酸性条件下有如下反应:2Cu+=Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。某同学对氢气还原氧化铜实验所得的红色固体产物进行验证,每一次实验操作和实验现象记录如下,由此推出氢气还原氧化铜实验的产物是( ).
| 加入试剂 | 稀硫酸 | 浓硫酸 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 产生红色固体,溶液呈蓝色 | 加热,产生无色气体 | 产生无色气体,溶液呈蓝色 | 产生红棕色气体,溶液呈绿色 |
| A.只有Cu |
| B.只有Cu2O |
| C.一定有Cu,可能有Cu2O |
| D.一定有Cu2O,可能有Cu |
您最近一年使用:0次
2020-03-06更新
|
281次组卷
|
8卷引用:江苏省启东中学2020年人教版高中化学必修1期末复习第二章 化学物质及其变化(三)
江苏省启东中学2020年人教版高中化学必修1期末复习第二章 化学物质及其变化(三)2017届新疆生产建设兵团二中高三上第一次月考化学试卷2018届高三一轮复习化学:考点21-铜及其化合物性质探究福建省厦门双十中学2016-2017学年高一下学期第一次月考化学试题(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第4讲 金属材料与矿物 铜及其化合物 (题型专练)(已下线)2019年1月17日 《每日一题》高考二轮复习-铜及其化合物(已下线)第三单元 物质的性质与转化(基础过关)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练
解题方法
4 . 实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图:
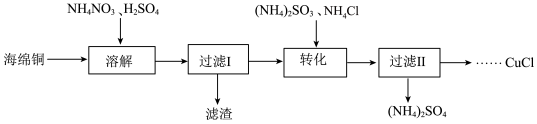
已知:①CuCl为白色固体,难溶于水和乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl有水存在时在空气中易被氧化,在酸性条件下较稳定。
(1)“溶解”时选用约为0.5mol•L-1的硫酸,过程中无气体产生。若硫酸浓度过大,反应会产生NO、NO2等有害气体,NH4NO3的用量会___ (填“增大”或“减小”或“不变”)。
(2)“转化”步骤中发生反应的离子方程式为___ 。加入的(NH4)2SO3需要适当过量的原因是__ 。
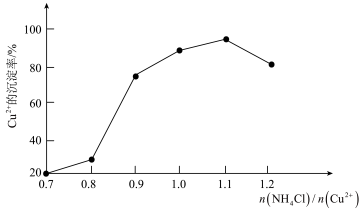
(3)氯化铵用量[ ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是___ 。
(4)检验CuCl沉淀是否洗涤完全的方法是___ 。
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:__ 。(实验中可选试剂:0.1mol•L-1盐酸、10mol•L-1盐酸、蒸馏水、无水乙醇)

已知:①CuCl为白色固体,难溶于水和乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl有水存在时在空气中易被氧化,在酸性条件下较稳定。
(1)“溶解”时选用约为0.5mol•L-1的硫酸,过程中无气体产生。若硫酸浓度过大,反应会产生NO、NO2等有害气体,NH4NO3的用量会
(2)“转化”步骤中发生反应的离子方程式为
(3)氯化铵用量[
 ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是
(4)检验CuCl沉淀是否洗涤完全的方法是
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:
您最近一年使用:0次
2020-02-27更新
|
146次组卷
|
2卷引用:江苏省苏州市2020届高三上学期期末学业质量阳光指标调研卷化学试题
5 . 下列实验能实现的是( )
A.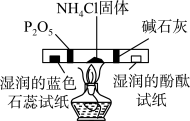 图1装置左侧用于检验氯化铵受热分解出的氨气 图1装置左侧用于检验氯化铵受热分解出的氨气 |
B.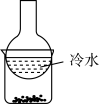 图2装置用于分离碘单质和高锰酸钾固体混合物 图2装置用于分离碘单质和高锰酸钾固体混合物 |
C.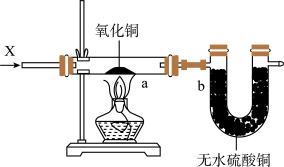 图3装置中若a处有红色物质生成,b处变蓝,证明X一定是H2 图3装置中若a处有红色物质生成,b处变蓝,证明X一定是H2 |
D. 图4装置可以制取少量CO2,安全漏斗可以防止气体逸出 图4装置可以制取少量CO2,安全漏斗可以防止气体逸出 |
您最近一年使用:0次
2020-02-09更新
|
457次组卷
|
4卷引用:山西省大同市2020届高三第一次联合考试(市直)化学试题
山西省大同市2020届高三第一次联合考试(市直)化学试题【全国百强校】安徽省六安市第一中学2020届高三下学期自测卷(三)线下考试化学试题江苏南京鼓楼区2021-2022学年高三下学期模拟考试化学试题(已下线)江苏省南京市、盐城市2024届高三下学期第二次模拟化学试题
名校
解题方法
6 . 在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.CO2 CaCO3 CaCO3 | B.Fe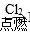 FeCl3 FeCl3 |
C.CuO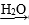 Cu(OH)2 Cu(OH)2 | D.Al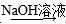 Al(OH)3 Al(OH)3 |
您最近一年使用:0次
7 . 工业上由含铜废料(含有Cu、CuS、CuSO4等)制备硝酸铜晶体的流程如图:
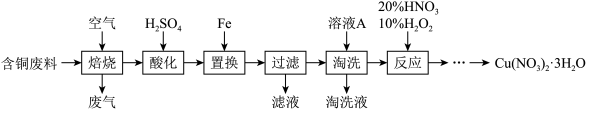
(1)“焙烧”时CuS转化为CuO和SO2,反应的化学方程式为___ 。
(2)“酸化”步骤反应的离子方程式为___ 。
(3)“过滤”所得滤液中溶质的主要成分为___ 。
(4)“淘洗”所用的溶液A应选用___ (填序号)。
a.稀硫酸 b.浓硫酸 c.稀硝酸 d.浓硝酸
(5)“反应”一步的过程中无红棕色气体生成。
①理论上消耗HNO3和H2O2的物质的量之比为___ 。
②若不加10% H2O2,只用浓HNO3,随着反应的进行,容器内持续出现大量红棕色气体,写出该反应的离子方程式____ 。
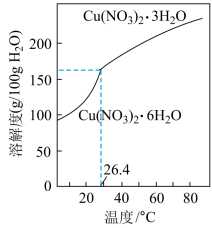
(6)由“反应”所得溶液中尽可能多地析出Cu(NO3)2·3H2O晶体的方法是___ 。(相关物质的溶解度曲线如图所示)

(1)“焙烧”时CuS转化为CuO和SO2,反应的化学方程式为
(2)“酸化”步骤反应的离子方程式为
(3)“过滤”所得滤液中溶质的主要成分为
(4)“淘洗”所用的溶液A应选用
a.稀硫酸 b.浓硫酸 c.稀硝酸 d.浓硝酸
(5)“反应”一步的过程中无红棕色气体生成。
①理论上消耗HNO3和H2O2的物质的量之比为
②若不加10% H2O2,只用浓HNO3,随着反应的进行,容器内持续出现大量红棕色气体,写出该反应的离子方程式
(6)由“反应”所得溶液中尽可能多地析出Cu(NO3)2·3H2O晶体的方法是

您最近一年使用:0次
8 . 氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
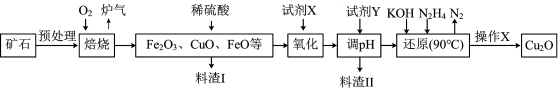
(1) “焙烧”时,提高反应速率的措施有____________ (写一条)。
(2)炉气中的有害气体成分是__________ 。
(3)若试剂X是H2O2溶液,写出相应反应的离子方程式:_________ 。

(1) “焙烧”时,提高反应速率的措施有
(2)炉气中的有害气体成分是
(3)若试剂X是H2O2溶液,写出相应反应的离子方程式:
您最近一年使用:0次
2019-12-25更新
|
116次组卷
|
2卷引用:江苏省太仓市明德高级中学2019-2020学年高二上学期合格性考试模拟化学试题
解题方法
9 . 我国很早就使用青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用以下反应实现了“铜→铜绿→……→铜”的转化。
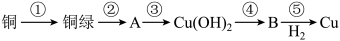
(1)从物质分类标准看,“铜绿”属于___ (填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2)请写出铜绿与盐酸反应的离子方程式:___ 。
(3)上述转化过程中属于氧化还原反应的是___ (填序号)
(4)铜绿在受热时可直接分解生成物质B、CO2和水,其分解的化学方程式为___ 。

(1)从物质分类标准看,“铜绿”属于
A.酸 B.碱 C.盐 D.氧化物
(2)请写出铜绿与盐酸反应的离子方程式:
(3)上述转化过程中属于氧化还原反应的是
(4)铜绿在受热时可直接分解生成物质B、CO2和水,其分解的化学方程式为
您最近一年使用:0次
名校
10 . 将1.60gCuSO4固体在高温下加热,得到0.72g红色固体(纯净物,不含S元素),同时有气体X生成,X可能是SO2、SO3、O2中的两种或三种。下列说法正确的是
| A.所得红色固体是铜 |
| B.将X通入氢氧化钡溶液,若溶液变浑浊,则X中含有SO3 |
| C.X的物质的量最少为0.01mol |
| D.将X缓慢通过足量NaOH溶液,若溶液增重0.72g,则X中含0.005molO2 |
您最近一年使用:0次



