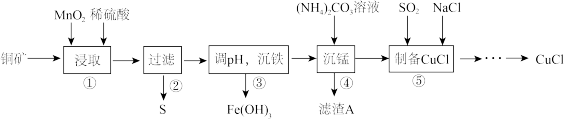
1 . 用某铜矿(含CuS以及少量FeO和Fe2O3)制备CuCl的主要流程如下:
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
(1)浸取时,CuS被浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,该反应的氧化剂是________ (填化学式),Fe2O3被浸取的离子方程式为________________ 。
(2)步骤③调整pH的范围为______ ,滤渣A的成分为________ (填化学式)。
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为________ (填化学式)。
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)______ 。
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 7.1 | 10.1 |
| Cu(OH)2 | 4.7 | 6.7 |
(2)步骤③调整pH的范围为
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)
您最近一年使用:0次
真题
名校
2 . 向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
| A.Cu与Cu2O的物质的量之比为2∶1 | B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L | D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
您最近一年使用:0次
2019-01-30更新
|
2778次组卷
|
33卷引用:江苏省南通市白蒲高级中学2019-2020学年高一下学期期末复习化学试题
江苏省南通市白蒲高级中学2019-2020学年高一下学期期末复习化学试题2012年普通高等学校招生全国统一考试理综化学部分(四川卷)(已下线)2013届江西省赣州市十一县(市)高三上学期期中联考化学试卷(已下线)2013届江西省赣州市十一县(市)高三上学期期中联考化学试卷2015-2016学年吉林省吉林一中高一下期末化学试卷安徽省肥东县高级中学2019届高三上学期12月调研化学试题江西省上饶市横峰中学2018-2019学年高一下学期开学考试化学试题(已下线)2019年7月22日《每日一题》 2020届一轮复习 利用得失电子守恒巧解氧化还原反应计算题湖南省衡阳县第四中学2020届高三366班(实验班)8月月考化学试题宁夏青铜峡市高级中学2020届高三上学期第一次月考化学试题黑龙江省宾县一中2020届高三上学期第一次月考化学试题山西大学附中2020届高三上学期第二次模块诊断化学试题甘肃省兰州市第一中学2020届高三9月月考化学试题2020届高三化学总复习考点强化练习:物质及其变化2020届高三化学无机化学二轮专题复习——铜及其化合物专练【精编精炼】江西省景德镇一中2019-2020学年高一上学期期末考试(2班)化学试题天津市静海区第一中学2020届高三3月统练化学试题(已下线)上海市奉贤区2014届高三1月调研(期末)测试化学试题(已下线)上海市奉贤区2013年高考二模化学试题(已下线)【南昌新东方】2018-2019 莲塘一中 高三9月 013云南省昆明市寻甸县民族中学2019-2020学年高一下学期第一次月考化学试题(已下线)第09讲 氧化还原反应的计算及方程式的配平(精练)——2021年高考化学一轮复习讲练测第29届(2015年)全国高中化学奥林匹克竞赛山东省预赛试题江苏省无锡市江阴市两校联考2023-2024学年高一下学期3月月考化学试题四川省遂宁市射洪中学2020—2021学年高一下学期期中考试化学试题湖南省邵阳邵东市第一中学2022届高三上学期第二次月考化学试题河北深州市长江中学2021-2022学年高二上学期10月月考化学(文)试题云南省宁蒗县第一中学2021-2022学年高三下学期3月考试化学试题河南省洛阳市六校联考2022-2023学年高三上学期月考化学试题湖南省邵阳市第二中学2022-2023学年高一下学期期末考试化学试题湖南省益阳市南县第一中学2023-2024学年高三上学期8月月考化学试题上海市复兴高级中学2022-2023学年高二上学期期中考试化学(等级考)试题福建省福清第一中学2023-2024学年高三上学期10月月考化学试题
3 . 研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是( )
A.密闭容器中CuO和C高温反应的气体产物: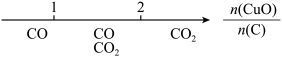 |
B.Fe在Cl2中的燃烧产物: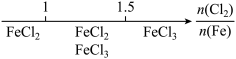 |
C.AlCl3溶液中滴加NaOH后铝的存在形式: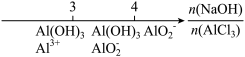 |
D.氨水与SO2反应后溶液中的铵盐: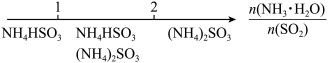 |
您最近一年使用:0次
2019-01-30更新
|
2586次组卷
|
21卷引用:2008年普通高等学校招生统一考试化学试题(江苏卷)
2008年普通高等学校招生统一考试化学试题(江苏卷)(已下线)2010—2011学年辽宁省营口市高一上学期期末考试化学试卷(已下线)2012届山东省莱州一中高三第二次质量检测化学试卷(已下线)2012届山东省冠县武训高中高三第二次质量检测化学试卷(已下线)2012届陕西省西安市第一中学高三上学期期中考试化学试卷(已下线)2011-2012学年江西省白鹭洲中学高一下学期期中考试化学试卷(已下线)2014届天津市七校高三12月联考化学试卷(已下线)2013届福建省厦门双十中学高三上学期期中考试化学试卷2016届辽宁省大连市第二十高级中学高三期初考试化学试卷2017届宁夏石嘴山三中高三上第二次适应性考试化学卷2018-2019学年苏教版高中化学必修一 模块综合测评(A)(已下线)【新东方】高中化学167河北省衡水中学2019届高三上学期第二次调研考试化学试题(已下线)上海市祝桥高级中学2014-2015学年度高三第一次月考化学试题(已下线)上海市卢湾区2010届高三期末考试化学试题黑龙江省海林市朝鲜族中学2019-2020学年高二下学期期末考试化学试题黑龙江省双鸭山市第一中学2021届高三上学期开学考试化学试题湖南省长沙市长郡中学2021届高三月考试卷(二)化学试题上海市2009年高中学生化学竞赛初赛试题湖南省长沙市雅礼教育集团2020-2021学年高二下学期期末联考化学试题天津市耀华中学2023届高三第一次统练化学试题
2010·江苏泰州·一模
4 . 已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平)。NH4CuSO3与足量的10 mol∙L−1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
| A.该反应显示硫酸具有酸性 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.反应中硫酸作氧化剂 |
您最近一年使用:0次
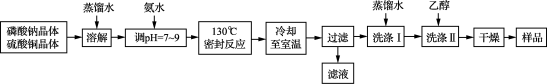
5 . 锂/磷酸氧铜电池是一种以磷酸氧铜作为正极材料的锂离子电池,其正极的活性物质是Cu4O(PO4)2,制备流程如下:
主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1) 实验室进行“过滤”操作使用的玻璃仪器主要有____________________ 。
(2) 流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是__________________ 。
(3) 准确称取上述流程所得的样品38.56 g [假定样品中只含Cu4O(PO4)2和CuO两种物质],使其完全溶于一定量的硝酸中,再加入氢氧化钠溶液,使铜完全沉淀,将沉淀灼烧使其转变为黑色氧化铜,最终称得残留固体质量为27.20 g。计算所得样品中磷酸氧铜的质量分数_______ 。(写出计算过程)
主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1) 实验室进行“过滤”操作使用的玻璃仪器主要有
(2) 流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是
(3) 准确称取上述流程所得的样品38.56 g [假定样品中只含Cu4O(PO4)2和CuO两种物质],使其完全溶于一定量的硝酸中,再加入氢氧化钠溶液,使铜完全沉淀,将沉淀灼烧使其转变为黑色氧化铜,最终称得残留固体质量为27.20 g。计算所得样品中磷酸氧铜的质量分数
您最近一年使用:0次
名校
6 . 给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.NaCl(aq)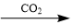 NaHCO3(s) NaHCO3(s)  Na2CO3(s) Na2CO3(s) |
B.CuCl2 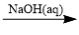 Cu(OH)2 Cu(OH)2  Cu Cu |
C.Al 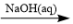 NaAlO2(aq) NaAlO2(aq)  NaAlO2(s) NaAlO2(s) |
D.MgO(s) Mg(NO3)2(aq) Mg(NO3)2(aq)  Mg(s) Mg(s) |
您最近一年使用:0次
2018-12-26更新
|
267次组卷
|
2卷引用:江苏省兴化一中2019届高三上学期12月月考化学试题
7 . 将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的稀硝酸中,固体完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论错误的是
| A.纯净无色气体Y与0.75VmL(标准状况)O2混合后通入水中,气体可被完全吸收 |
| B.若固体与硝酸恰好完全反应,当V=1680时,Cu2O与Cu的物质的量之比为8∶1 |
| C.原混合粉末的总质量可能为9.8 g |
| D.向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,消耗NaOH的物质的量为(0.325-V/22400)mol |
您最近一年使用:0次
8 . 碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如下:
(1)试剂1最好选用_________ 。
a.Fe2O3 b.CaCO3 c.CuO
(2)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,写出该反应的化学方程式________________ 。
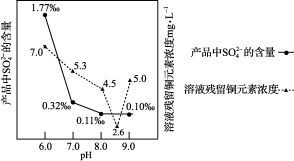
(3)加入Na2CO3沉淀时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在________ 。
(4)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O,要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称取12.0克的样品;②高温分解;③测出生成CO2的质量为2.2克;④测出生成水蒸气的质量为1.8克⑤称量生成CuO的质量为8.0g。计算出碱式碳酸铜的组成,写出计算过程。____________________________ 。
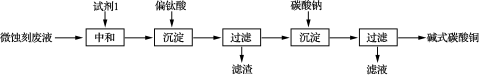
(1)试剂1最好选用
a.Fe2O3 b.CaCO3 c.CuO
(2)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,写出该反应的化学方程式
(3)加入Na2CO3沉淀时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在
(4)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O,要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称取12.0克的样品;②高温分解;③测出生成CO2的质量为2.2克;④测出生成水蒸气的质量为1.8克⑤称量生成CuO的质量为8.0g。计算出碱式碳酸铜的组成,写出计算过程。
您最近一年使用:0次
名校
解题方法
9 . 以电镀污泥[主要成分为Cu(OH)2、Cu2(OH)2CO3、Fe(OH)3和SiO2等]为原料制备纳米铜等的工艺流程如下:
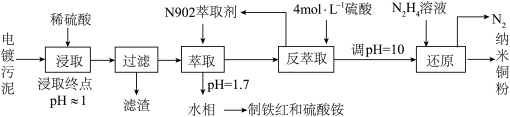
(1)“浸取”时,工业上采用3 mol·L-1H2SO4溶液在室温下浸取1 h。
①Cu2(OH)2CO3被浸取的化学方程式为______________________________________ ;
②下列措施可提高铜和铁的浸取率的是________ (填字母)。
a.将电镀污泥浆化处理 b.适当增大液、固质量比
c.浸取时间缩短一半 d.控制浸取终点pH>3
(2)“萃取”时,两种金属离子萃取率与pH的关系如图甲所示。当pH>1.7时,pH越大金属离子萃取率越低,其中Fe3+萃取率降低的原因是______________________ 。
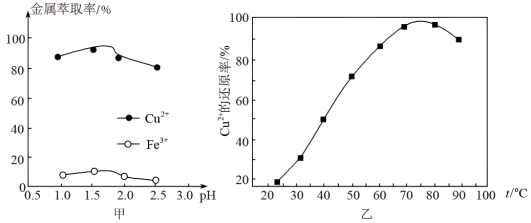
(3)“反萃取”得到CuSO4溶液制备纳米铜粉时,Cu2+的还原率随温度的变化如图乙所示。
①该反应的离子方程式为____________________________________________ ;
②在20~75 ℃区间内,温度越高Cu2+的还原率也越高,其原因是____________________ 。
(4)在萃取后的“水相”中加入适量氨水,静置,再经_____________ 等操作可得到Fe2O3产品。

(1)“浸取”时,工业上采用3 mol·L-1H2SO4溶液在室温下浸取1 h。
①Cu2(OH)2CO3被浸取的化学方程式为
②下列措施可提高铜和铁的浸取率的是
a.将电镀污泥浆化处理 b.适当增大液、固质量比
c.浸取时间缩短一半 d.控制浸取终点pH>3
(2)“萃取”时,两种金属离子萃取率与pH的关系如图甲所示。当pH>1.7时,pH越大金属离子萃取率越低,其中Fe3+萃取率降低的原因是

(3)“反萃取”得到CuSO4溶液制备纳米铜粉时,Cu2+的还原率随温度的变化如图乙所示。
①该反应的离子方程式为
②在20~75 ℃区间内,温度越高Cu2+的还原率也越高,其原因是
(4)在萃取后的“水相”中加入适量氨水,静置,再经
您最近一年使用:0次
名校
10 . 硅酸铜钡是利用最新科学技术才合成的一种物质,然而科学家惊奇发现,我国秦朝兵马俑的一种颜料竟是硅酸铜钡.由以上事实推测关于硅酸铜钡的说法不正确的是
| A.难氧化 | B.难溶于水 | C.属于硅酸盐 | D.属于混合物 |
您最近一年使用:0次
2018-09-10更新
|
163次组卷
|
2卷引用:江苏省盐城市田家炳中学2019届高三上学期开学考试化学试题



