解题方法
1 . 铁及其化合物在生产、生活中应用广泛。
(1)已知: ①3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H1=a kJ·mol-1;
②2H2(g)+O2(g)=2H2O(1) △H2=b kJ·mol-1
③H2O(g)=H2O(l) △H3=c kJ·mol-1
则3Fe(s)+2O2(g))=Fe3O4(s)△H=_________ kJ·mol-1(用含 a、b、c 的代数式表示)。
(2)活性铁粉是合成氨气的催化剂。工业合成氨的原理为N2+3H2 2NH3 △H<0
2NH3 △H<0
①工业采用“高压”一般为20~50MPa,温度为 500℃。采用“温度为 500℃”的目的是____________ ;
②氨气是合成氮肥的重要原料。常温下,0.1mol·L-1(NH4)2SO4溶液中离子浓度大小排序为___________ ;
③常温下,向a mL c mol·L-1氨水中滴加b mL c mol·L-1稀硝酸恰好至溶液pH=7(溶液体积变化忽略不计),则NH3·H2O的电离常数Kb=___ ;
(3)工业上用热还原法冶炼铁。在密闭容器中,投入足量的 FeO 粉末和炭粉,在一定温度下发生反应:FeO(s)+C(s)⇌Fe(s)+CO(g) △H>0;
①若容积恒定,则下列情况表明上述反应达到平衡状态的是___________ (填代号)
A.FeO 的浓度不再改变 B.气体相对分子质量不再改变 C.气体密度不再改变 D.铁粉的质量不再改变
②在该温度下,上述反应达到平衡时c(CO)=a mol·L-1,则该反应的平衡常数为________ ;在温度不变时,将容器体积扩大至原来的4倍,则达到新平衡时,c(CO)为_____________ 。
(1)已知: ①3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H1=a kJ·mol-1;
②2H2(g)+O2(g)=2H2O(1) △H2=b kJ·mol-1
③H2O(g)=H2O(l) △H3=c kJ·mol-1
则3Fe(s)+2O2(g))=Fe3O4(s)△H=
(2)活性铁粉是合成氨气的催化剂。工业合成氨的原理为N2+3H2
 2NH3 △H<0
2NH3 △H<0①工业采用“高压”一般为20~50MPa,温度为 500℃。采用“温度为 500℃”的目的是
②氨气是合成氮肥的重要原料。常温下,0.1mol·L-1(NH4)2SO4溶液中离子浓度大小排序为
③常温下,向a mL c mol·L-1氨水中滴加b mL c mol·L-1稀硝酸恰好至溶液pH=7(溶液体积变化忽略不计),则NH3·H2O的电离常数Kb=
(3)工业上用热还原法冶炼铁。在密闭容器中,投入足量的 FeO 粉末和炭粉,在一定温度下发生反应:FeO(s)+C(s)⇌Fe(s)+CO(g) △H>0;
①若容积恒定,则下列情况表明上述反应达到平衡状态的是
A.FeO 的浓度不再改变 B.气体相对分子质量不再改变 C.气体密度不再改变 D.铁粉的质量不再改变
②在该温度下,上述反应达到平衡时c(CO)=a mol·L-1,则该反应的平衡常数为
您最近一年使用:0次
解题方法
2 . 自然界中的含硫物质在一定条件下能够相互转化,这种转化在人工条件下也能发生。
(1)最近有人尝试用H2还原工业尾气中SO2,该反应分两步完成,如图所示。

①H2S的电子式为_________________________________ 。
②第二步反应中SO2体现_____________ 性。(填“氧化”或“还原”)
③总反应的化学方程式为_________________________ 。
(2)利用氨水吸收烟气中的二氧化硫,涉及反应2(NH4)2SO3(aq) + O2(g) 2(NH4)2SO4(aq)。
2(NH4)2SO4(aq)。
①随温度升高,氧气氧化(NH4)2SO3的速率先增大后减小,氧化速率减小的原因可能是_______ , (NH4)2SO4溶液呈酸性的原因是__________ (用离子方程式表示)。
②常温下,向(NH4)2SO3和(NH4)2SO4的混合液中滴加足量的氯化钡溶液,充分反应后测得溶液中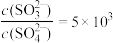 , 则Ksp(BaSO4)=
, 则Ksp(BaSO4)=__________ [已知Ksp(BaSO3)= 5×10-7]
(1)最近有人尝试用H2还原工业尾气中SO2,该反应分两步完成,如图所示。

①H2S的电子式为
②第二步反应中SO2体现
③总反应的化学方程式为
(2)利用氨水吸收烟气中的二氧化硫,涉及反应2(NH4)2SO3(aq) + O2(g)
 2(NH4)2SO4(aq)。
2(NH4)2SO4(aq)。①随温度升高,氧气氧化(NH4)2SO3的速率先增大后减小,氧化速率减小的原因可能是
②常温下,向(NH4)2SO3和(NH4)2SO4的混合液中滴加足量的氯化钡溶液,充分反应后测得溶液中
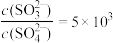 , 则Ksp(BaSO4)=
, 则Ksp(BaSO4)=
您最近一年使用:0次
3 . 铜铁是目前人们使用量最大的合金材料,铁及其化合物也是人们日常生活中应用广泛的一类物质。回答下列问题:
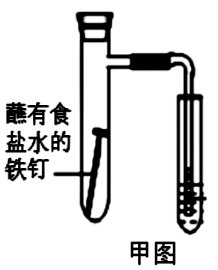
(1)下图中铁钉发生的电化学腐蚀类型是________ ,负极反应式为__________ 。
(2)实验室配置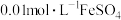 溶液时,需向溶液中滴加几滴稀硫酸,其目的是
溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________ , 溶液中离子浓度由大到小的顺序是
溶液中离子浓度由大到小的顺序是________ 。
(3)高铁盐酸是一种新型的环境消毒剂及水体净化剂,如高铁酸钾( )。其中
)。其中 的化合价是
的化合价是________ ,其净水过程中既表现出强氧化性,又表现了强吸附性,则 与水反应的离子方程式为
与水反应的离子方程式为__________ 。
(4)羰基铁酸[ ]是一种二元弱酸,其第一步电离方程式为
]是一种二元弱酸,其第一步电离方程式为__________ 。
(5)25℃时,向含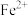 的溶液中加入一定量的
的溶液中加入一定量的 后,
后, 恰好达到溶液平衡,测得溶液的
恰好达到溶液平衡,测得溶液的 ,
,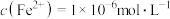 。通过计算判断所得的
。通过计算判断所得的 中是否含有
中是否含有 杂质:
杂质:________ (已知: ,
,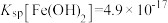 )
)
(1)下图中铁钉发生的电化学腐蚀类型是

(2)实验室配置
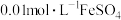 溶液时,需向溶液中滴加几滴稀硫酸,其目的是
溶液时,需向溶液中滴加几滴稀硫酸,其目的是 溶液中离子浓度由大到小的顺序是
溶液中离子浓度由大到小的顺序是(3)高铁盐酸是一种新型的环境消毒剂及水体净化剂,如高铁酸钾(
 )。其中
)。其中 的化合价是
的化合价是 与水反应的离子方程式为
与水反应的离子方程式为(4)羰基铁酸[
 ]是一种二元弱酸,其第一步电离方程式为
]是一种二元弱酸,其第一步电离方程式为(5)25℃时,向含
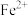 的溶液中加入一定量的
的溶液中加入一定量的 后,
后, 恰好达到溶液平衡,测得溶液的
恰好达到溶液平衡,测得溶液的 ,
,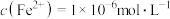 。通过计算判断所得的
。通过计算判断所得的 中是否含有
中是否含有 杂质:
杂质: ,
,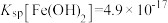 )
)
您最近一年使用:0次
名校
解题方法
4 . 下列关于各图象的解释或结论正确的是


A.由甲可知:热化学方程式是H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ/mol O2(g)=H2O(g) ΔH=-241.8kJ/mol |
B.由乙可知:对于恒温恒容条件下的反应2NO2(g) N2O4(g),A点为平衡状态 N2O4(g),A点为平衡状态 |
| C.由丙可知:相同pH的盐酸和醋酸溶液分别加水稀释,b点溶液的导电性比c点溶液的导电性强 |
| D.由丁可知:同温度、同物质的量浓度的HA溶液与HB溶液相比,其pH前者小于后者 |
您最近一年使用:0次
2020-01-17更新
|
632次组卷
|
2卷引用:海南省海南中学2019-2020学年高二上学期期末考试化学试题
名校
解题方法
5 . 研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g) 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g) N2O2(g)(快) ΔH1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) ΔH1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g) 2NO2(g)(慢) ΔH2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) ΔH2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
(1)反应2NO(g)+O2(g) 2NO2(g)的ΔH =
2NO2(g)的ΔH =___________ (用含ΔH1和ΔH2的式子表示)
(2)一定温度下,恒容的密闭容器中,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_________________ ,升高温度,K值___________ (填“增大”“减小”或“不变”)
(3)下列描述中能说明上述反应已达平衡的是__________ ;
A.容器内气体的平均摩尔质量保持不变
B.2v(NO)正=v(O2)逆
C.容器中气体的密度保持不变
D.单位时间内生成nmolO2的同时生成2nmolNO2
 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:I.2NO(g)
 N2O2(g)(快) ΔH1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) ΔH1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)Ⅱ.N2O2(g)+O2(g)
 2NO2(g)(慢) ΔH2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) ΔH2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)请回答下列问题:
(1)反应2NO(g)+O2(g)
 2NO2(g)的ΔH =
2NO2(g)的ΔH =(2)一定温度下,恒容的密闭容器中,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=(3)下列描述中能说明上述反应已达平衡的是
A.容器内气体的平均摩尔质量保持不变
B.2v(NO)正=v(O2)逆
C.容器中气体的密度保持不变
D.单位时间内生成nmolO2的同时生成2nmolNO2
您最近一年使用:0次
名校
6 . 下列有关CuSO4溶液的叙述中正确的是
| A.该溶液呈碱性 |
| B.它与H2S反应的离子方程式为:Cu2++S2-=CuS↓ |
| C.用惰性电极电解该溶液时,阳极产生铜单质 |
| D.在溶液中:2c (Cu2+) +c (H+)=2c(SO42-) +c(OH-) |
您最近一年使用:0次
名校
7 . SO2在生产、生活中有着广泛的用途。
(1)请你列举一个SO2在生活中的用途:______________________ 。
(2)SO2在工业上常用于硫酸生产:2SO2(g)+O2(g) 2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为
2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为__________________ 。
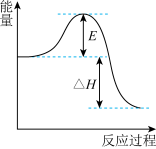

(3)上图中L、X表示物理量温度或压强,依据题中信息可判断:
①X表示的物理量是_________________________ ,
②L1________ (填“>”“<”或“=”)L2。
(4)在容积固定的密闭容器中,起始时充入0.2molSO2和0.1molO2,反应体系起始总压强为0.1MPa。反应在一定的温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极的电极反应式:__________________________________________ 。
(1)请你列举一个SO2在生活中的用途:
(2)SO2在工业上常用于硫酸生产:2SO2(g)+O2(g)
 2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为
2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为

(3)上图中L、X表示物理量温度或压强,依据题中信息可判断:
①X表示的物理量是
②L1
(4)在容积固定的密闭容器中,起始时充入0.2molSO2和0.1molO2,反应体系起始总压强为0.1MPa。反应在一定的温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=
(5)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极的电极反应式:
您最近一年使用:0次
名校
8 . 下列说法正确的是
| A.氢氧燃料电池工作时,若消耗标准状况下11.2 L H2,则转移电子数为6.02×1023 |
| B.常温下,将稀CH3COONa溶液加水稀释后,n(H+)﹒n(OH-)不变 |
| C.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率 |
| D.反应2NaCl(s)==2Na(s)+Cl2(g)的ΔH<0,ΔS>0 |
您最近一年使用:0次
2019-03-28更新
|
496次组卷
|
2卷引用:【全国百强校】海南省海南中学2018届高三下学期第二次模拟考试化学试题
名校
解题方法
9 . I.甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g) HCHO(g)+H2(g) △H1=+85.2kJ/mol
HCHO(g)+H2(g) △H1=+85.2kJ/mol
反应II:CH3OH(g)+ O2(g)⇌HCHO(g)+H2O(g) △H2
O2(g)⇌HCHO(g)+H2O(g) △H2
反应III:2H2(g)+O2(g)⇌2H2O(g) △H3=-483.6kJ/mol
(1)计算反应Ⅱ的反应热△H2=_____________________________ 。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)⇌HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________ (用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
II.CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g) △H=QkJ/mol。一定条件下,按不同的投料比X[X=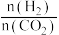 ]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
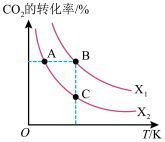
①X1_____ X2(填“>”或“<”,后同),Q_____ 0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____ 。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=_____ [常温下K1(H2CO3)=4.4×10﹣7、K2(H2CO3)=5×10﹣11]。
②欲用5L Na2CO3溶液将23.3g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________ 。[已知:常温下Ksp(BaSO4)=1×10﹣7、Ksp(BaCO3)=2.5×10﹣6]。(忽略溶液体积积的变化)
反应I:CH3OH(g)
 HCHO(g)+H2(g) △H1=+85.2kJ/mol
HCHO(g)+H2(g) △H1=+85.2kJ/mol反应II:CH3OH(g)+
 O2(g)⇌HCHO(g)+H2O(g) △H2
O2(g)⇌HCHO(g)+H2O(g) △H2反应III:2H2(g)+O2(g)⇌2H2O(g) △H3=-483.6kJ/mol
(1)计算反应Ⅱ的反应热△H2=
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)⇌HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=
II.CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g) △H=QkJ/mol。一定条件下,按不同的投料比X[X=
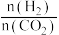 ]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
①X1
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=
②欲用5L Na2CO3溶液将23.3g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为
您最近一年使用:0次
2019-03-14更新
|
741次组卷
|
5卷引用:海南省琼海市嘉积第三中学2021-2022学年高三下学期第三次月考化学科试题
海南省琼海市嘉积第三中学2021-2022学年高三下学期第三次月考化学科试题 【校级联考】江西省重点中学盟校2019届高三上学期第一次联考化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(三)山东省济南市大学城实验高级中学2021届高三1月阶段性考试化学试题云南民族大学附属中学2019-2020学年高二下学期期中考试化学试题
名校
10 . 在密闭容器中将2 mol NaHCO3(s)和一定量Na2O2混合,在加热条件下让其充分反应,150 ℃下所得气体仅含两种组分,反应后固体的物质的量(n)的取值范围是
| A.n≥1 | B.1<n<2 | C.2≤n<4 | D.n≥4 |
您最近一年使用:0次
2018-09-04更新
|
359次组卷
|
4卷引用:海南省海口市华侨中学2019-2020学年高一(上)期末化学必修一期末复习试卷
海南省海口市华侨中学2019-2020学年高一(上)期末化学必修一期末复习试卷【全国百强校】黑龙江省哈尔滨师范大学附属中学2019届高三上学期开学考试化学试题(已下线)2019年7月3日 《每日一题》2020年高考一轮复习-以物质的量为中心的化学计算安徽省六安市舒城育才学校2020-2021学年高二上学期期末考试化学试题



