名校
解题方法
1 . 反应①Fe(s)+CO2(g)=FeO(s)+CO(g);△H1=akJmol-1
反应②CO(g)+ O2(g)=CO2(g);△H2=bkJmol-1
O2(g)=CO2(g);△H2=bkJmol-1
测得在不同温度下,在密闭容器中进行的反应①的平衡常数K值随温度的变化如下:
(1)反应①的化学平衡常数表达式为___ ,a___ 0(填“>”、“<”或“=”)。在500℃2L密闭容器中进行反应①,Fe和CO2的起始物质的量均为4mol,10min后达到平衡状态,平衡时CO2的转化率为___ ,用CO表示的化学反应速率为___ 。
(2)700℃反应①到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有___ (填序号)。
A.缩小反应容器体积
B.通入CO2
C.升高温度到900℃
D.使用合适的催化剂
(3)由反应①和②可求得反应2Fe(s)+O2(g)=2FeO(s)△H3中的△H3=___ (用含a、b的代数式表示)。
反应②CO(g)+
 O2(g)=CO2(g);△H2=bkJmol-1
O2(g)=CO2(g);△H2=bkJmol-1测得在不同温度下,在密闭容器中进行的反应①的平衡常数K值随温度的变化如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.46 | 2.51 |
(1)反应①的化学平衡常数表达式为
(2)700℃反应①到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
A.缩小反应容器体积
B.通入CO2
C.升高温度到900℃
D.使用合适的催化剂
(3)由反应①和②可求得反应2Fe(s)+O2(g)=2FeO(s)△H3中的△H3=
您最近一年使用:0次
12-13高二上·陕西·期中
名校
解题方法
2 . 已知热化学方程式:
① C2H2(g) + O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJ•mol-1
③ H2(g)+ O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为
① C2H2(g) +
 O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJ•mol-1
③ H2(g)+
 O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为
| A.+228.2 kJ·mol-1 | B.-228.2 kJ·mol-1 |
| C.+1301.0 kJ·mol-1 | D.+621.7 kJ·mol-1 |
您最近一年使用:0次
2020-05-31更新
|
642次组卷
|
29卷引用:福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题
福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题(已下线)2011-2012学年陕西师大附中高二年级第一学期期中考试化学试卷(已下线)2012-2013学年广东陆丰碣石中学高二第二次月考化学试卷(已下线)2015届黑龙江省牡丹江第一高中高二上学期期中考试化学(理)试卷河南省信阳市商城县高级中学2017-2018学年高二上学期第一次月考化学试题黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题宁夏吴忠中学2017-2018学年高二下学期开学考试化学试题西藏自治区日喀则市南木林高级中学2018-2019学年高二上学期期中考试化学试题高二人教版选修4 第一章 第三节 化学反应热的计算四川省北大附中成都为明学校2019-2020学年高二9月月考化学试题重庆市云阳县2019-2020学年高二上学期期中考试化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1青海省西宁市海湖中学2020-2021学年高二上学期第一阶段测试化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第二次月考化学试题青海省西宁市海湖中学2020-2021学年高二下学期开学考试化学试题云南省水富县云天化中学2020-2021学年高二下学期期中考试化学试题内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题吉林市第二中学2022-2023学年高二上学期9月月考化学试题四川省成都市简阳市阳安中学2022-2023学年高二上学期期中考试化学试题甘肃省天水市秦安县第一中学2022-2023学年高二上学期期末考试化学试题广西南宁市西乡塘区南宁高新技术产业开发区桂鼎学校2022-2023学年高二上学期11月期中化学试题陕西省黄陵中学2016-2017学年高一(重点班)下学期期末考试化学试题安徽省滁州市明光中学2018-2019学年高一下学期期中考试化学试题陕西省渭南市临渭区尚德中学2020届高三上学期第三次月考化学试题云南省普洱市景东彝族自治县第一中学2019-2020学年高一下学期期中考试化学试题内蒙古乌兰察布市集宁一中2019-2020学年高一下学期期中考试化学试题江西省鹰潭市第一中学2019—2020学年高一下学期期末考试化学试题广东省江门市第二中学2020-2021学年高一下学期第一次考试化学试题黑龙江省牡丹江市阳明区2022-2023学年高三上学期第四次阶段考试化学试题
12-13高二上·广东东莞·期中
名校
解题方法
3 . S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
| A.ΔH3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定 |
您最近一年使用:0次
2020-02-04更新
|
544次组卷
|
42卷引用:福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题
福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题(已下线)2011-2012年广东东莞南城中学高二上学期期中考试化学试卷(已下线)2011-2012年安徽红星中安工大附中高二下学期期中联考理科化学试卷(已下线)2011-2012学年云南省玉溪一中高二下学期期中考试化学试卷(已下线)2012-2013学年广东佛山市中大附中高二上期中考试理科化学试卷(已下线)2012-2013学年陕西省三原县北城中学高二上学期期中考试化学试卷(已下线)2012-2013学年北京市房山区房山中学高二下学期期中考试化学试卷(已下线)2013-2014学年海南三亚一中高二上学期期中考试理科化学试卷(B)(已下线)2014-2015学年广东阳东县第二中学高二10月月考化学(理)试卷(已下线)2014-2015学年山东省乐陵市第一中学高二上学期期中考试化学试卷2014-2015陕西省西安市庆安高级中学高二上学期期末化学试卷2014-2015陕西省西安市七十中高二上学期期末考试化学试卷2015-2016学年山东省寿光现代中学高二下开学测化学试卷2016-2017学年四川省什邡中学高二上第一次月考化学试卷2016-2017学年陕西省西安一中高二上10月月考化学卷2016-2017学年黑龙江省大庆市杜蒙县高二上月考一化学卷2016-2017学年江西省九江一中高二上期中化学试卷2016-2017学年宁夏吴忠中学高二下学期第一次月考化学试卷湖北省沙市中学2017-2018学年高二上学期期中考试化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高二上学期期末考试化学试题【校级联考】江西省南昌市八一中学、洪都中学2018-2019学年高二上学期10月联考化学试题【全国百强校】河北省武邑中学2018-2019学年高二上学期第二次月考化学试题安徽省凤阳县二中2018-2019学年高二下学期开学摸底考试化学试题河北安平中学2018-2019学年高二下学期期末考试化学试题湖北省宜昌市葛洲坝中学2019-2020学年高二10月月考化学试题江西省上高县第二中学2019-2020学年高二上学期第一次月考化学试题陕西省渭南韩城市2019-2020学年高二上学期期中考试化学试题人教版高中化学选修4第一章《化学反应与能量》测试卷(已下线)【南昌新东方】江西省九江第一中学2016-2017学年高二上学期期中考试化学试题吉林省松原市乾安县第七中学2020-2021学年高二上学期第一次教学质量检测化学试题广东省深圳市第七高级中学2020-2021学年高二上学期第一学段考试化学试题湖南省临澧县第一中学2020-2021学年高二上学期期中考试化学试题(选考)新疆哈密市第十五中学2020-2021学年高二上学期期末考试化学试题黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题湖南省临澧县第一中学2020-2021学年高二下学期阶段性考试(二)化学试题福建省南安市柳城中学2020-2021学年高二上学期第一次月考化学试题四川省成都市蒲江县蒲江中学2020-2021学年高二上学期10月月考化学试题江西省抚州市崇仁第二中学2021-2022学年高二上学期第一次月考化学试题甘肃省庆阳市宁县第二中学2022-2023学年高二上学期第一次月考化学试题(已下线)2013-2014学年海南省三亚市一中高二上学期期中考试理科化学试卷陕西省渭南市尚德中学2018-2019学年高一下学期期中考试化学试题【懂做原理题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择提升24题】
名校
解题方法
4 . 反应A(g)+B(g) = C(g) ΔH,分两步进行:①A(g)+B(g) = X(g)ΔH1 (慢)②X(g) = C(g) ΔH2(快)反应过程中能量变化如下图所示,下列说法正确的是


| A.ΔH1+ ΔH2=ΔH >0 | B.E2表示反应C(g) =X (g)的活化能 |
| C.E1是反应①的反应热 | D.整个反应的速率快慢由反应②决定 |
您最近一年使用:0次
2019-12-25更新
|
134次组卷
|
2卷引用:福建省漳平市第一中学2019-2020学年高二上学期第二次月考化学试题
名校
解题方法
5 . (1)已知①H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
②CH4 (g)+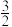 O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
则CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:___ 。
(2)根据键能数据计算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热 ΔH=___ kJ·mol-1。
(3)氢气是合成氨反应的重要原料。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟合成氨的工业化生产:N2(g)+3H2(g) 2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。
2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。

回答下列问题:
①平衡时,M点NH3的体积分数为10%,则N2的物质的量为___ (保留两位有效数字)。
②X轴上a点的数值比b点__ (填“大”或“小”);图中,Y轴表示__ (填“温度”或“压强”),判断的理由是__ 。
 O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1②CH4 (g)+
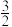 O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1则CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:
(2)根据键能数据计算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热 ΔH=
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(3)氢气是合成氨反应的重要原料。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟合成氨的工业化生产:N2(g)+3H2(g)
 2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。
2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。
回答下列问题:
①平衡时,M点NH3的体积分数为10%,则N2的物质的量为
②X轴上a点的数值比b点
您最近一年使用:0次
名校
6 . 联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=−1048.9 kJ·mol-1
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=−1048.9 kJ·mol-1
| A.ΔH4﹦2ΔH3−2ΔH2−ΔH1 |
B.O2(g)+2H2(g) 2H2O(l) ΔH5,ΔH5>ΔH3 2H2O(l) ΔH5,ΔH5>ΔH3 |
| C.1 mol O2(g)和 2 mol H2(g)具有的总能量高于 2 mol H2O(g) |
| D.联氨和 N2O4 作火箭推进剂的原因之一是反应放出大量的热且产物无污染 |
您最近一年使用:0次
2019-10-20更新
|
289次组卷
|
20卷引用:福建省武平县第一中学2021-2022学年高二上学期第一次月考化学试题
福建省武平县第一中学2021-2022学年高二上学期第一次月考化学试题甘肃省师范大学附属中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】福建省莆田市第一中学2018-2019学年高二上学期第一次月考化学试题浙江省杭州市富阳区新登中学2018-2019学年高二上学期期末模拟化学试题福建省三明市第一中学2019-2020学年高二上学期第一次月考化学试题吉林省靖宇县一中2019-2020学年上学期高二9月月考化学试题河北省沧州市肃宁县第一中学2019-2020学年高二上学期第三次月考化学试题福建省三明第一中学2020-2021学年高二上学期第一次月考化学试题河北省沧州市肃宁县第一中学2020-2021学年高二上学期第一次月考化学试题江西省赣州市会昌县会昌中学2020-2021学年高二上学期第一次月考化学试题重庆市铁路中学校2020-2021学年高二上学期11月月考化学试题安徽省合肥市合肥九中2020-2021学年高二上学期10月摸底考化学试题福建省将乐县第一中学2021-2022学年高二上学期第一次月考化学试题江苏省宿迁市北大附属宿迁实验学校2022-2023学年高二上学期开学考试化学试题福建省宁德市第一中学2021-2022学年高二上学期9月月考化学试题江苏省苏州市实验中学2023-2024学年高二上学期10月月考化学试题江苏省徐州市2018届高三考前模拟检测化学试题(已下线)2018年高考题及模拟题汇编 专题07 化学反应中的能量变化(已下线)2018年11月浙江省普通高校招生选考科目考试化学仿真模拟试卷03(已下线)2019年1月浙江省普通高中学业水平考试化学仿真模拟试题03
解题方法
7 . I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量 N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出该反应的热化学方程式_______________________________________ .
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________ kJ.
(3)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2(g)═2H2O(l)△H=﹣d kJ·mol﹣1(abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______ (填“大于”、“等于”或“小于”)途径II放出的热量.
②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量________ (填“大于”、“等于”或“小于”)生成物具有的总能量.
③b 与a、c、d的数学关系式是_____________ .
II、利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L−1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L−1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________ 。
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm−3,又知中和反应后生成溶液的比热容c=4.18 J·g−1·℃−1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=________ kJ·mol−1_(结果保留一位小数)。
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________ 。
 N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.(1)写出该反应的热化学方程式
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是
(3)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2(g)═2H2O(l)△H=﹣d kJ·mol﹣1(abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量
②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量
③b 与a、c、d的数学关系式是
II、利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L−1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L−1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm−3,又知中和反应后生成溶液的比热容c=4.18 J·g−1·℃−1。为了计算中和热,某学生实验记录数据如下:
| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | ||
| 1 | 20.0 | 20.0 | 23.0 |
| 2 | 20.1 | 20.1 | 23.2 |
| 3 | 20.2 | 20.2 | 23.4 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是
您最近一年使用:0次
2019-10-08更新
|
125次组卷
|
2卷引用:福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题
8 . CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。
已知:CH4(g)+O2(g)=CO2(g)+2H2(g) ΔH=-319kJ·mol−1
CO(g)+1/2O2(g)=CO2(g) ΔH=-283kJ·mol−1
回答下列问题:
(1)写出CH4-CO2催化重整反应的热化学方程式:___________ 。
(2)某温度下,向密闭容器中充入CH4与CO2,发生CH4-CO2催化重整反应。测得平衡混合物中CO(g)的体积分数[φ(CO)]与起始投料比Z[Z=n(CH4)/n(CO2)]的关系如图所示;

①当Z=2时,CO2的平衡转化率ɑ=___________ %。
②当Z=3时,反应达到平衡状态后,CO的体积分数可能是图1中的___________ 点(填“C”、“D”或“E”)。
(3)若CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。

①由图可知压强p1___________ p2(选填“>”、“<“或“=”);
②在温度为T5℃,压强为P1条件下,向2L密闭容器中充入1molCH4与1molCO2发生CH4-CO2催化重整反应,则此条件下该反应的平衡常数为:___________ ;达平衡后若再充入1.5molCH4、1.5molCO2、1molCO、1molH2,则此时v正___________ v逆(选填“>”、“<“或“=”);在该条件下,以下能说明该反应已达平衡的是___________ 。
A.CH4与CO2的物质的量比为1:1
B.氢气的体积分数不变
C.混合气体的平均摩尔质量保持不变
D.当消耗1mol的CO2同时,有2mol的CO生成
已知:CH4(g)+O2(g)=CO2(g)+2H2(g) ΔH=-319kJ·mol−1
CO(g)+1/2O2(g)=CO2(g) ΔH=-283kJ·mol−1
回答下列问题:
(1)写出CH4-CO2催化重整反应的热化学方程式:
(2)某温度下,向密闭容器中充入CH4与CO2,发生CH4-CO2催化重整反应。测得平衡混合物中CO(g)的体积分数[φ(CO)]与起始投料比Z[Z=n(CH4)/n(CO2)]的关系如图所示;

①当Z=2时,CO2的平衡转化率ɑ=
②当Z=3时,反应达到平衡状态后,CO的体积分数可能是图1中的
(3)若CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。

①由图可知压强p1
②在温度为T5℃,压强为P1条件下,向2L密闭容器中充入1molCH4与1molCO2发生CH4-CO2催化重整反应,则此条件下该反应的平衡常数为:
A.CH4与CO2的物质的量比为1:1
B.氢气的体积分数不变
C.混合气体的平均摩尔质量保持不变
D.当消耗1mol的CO2同时,有2mol的CO生成
您最近一年使用:0次
名校
9 . 开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________ 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g) CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
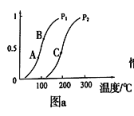
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl_______ P2;A、B、C三点处对应平衡常数(KA、KB、KC)的由大到小的顺序为__________ 。(填“<”、“>”“=”)
②100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则v(H2)=________________ 100℃时该反应的平衡常数K =_________ 。反应达到平衡的标志是:_____________ 。
A.容器内气体密度恒定
B.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C.容器的压强恒定
D.3v正(CH4)= v逆(H2)
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________ (填编号)。
A.升高温度 B.缩小容器体积 C.再充入CH4气体 D.使用合适的催化剂
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g)
 CO(g)+ 3H2(g)
CO(g)+ 3H2(g)①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl

②100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则v(H2)=
A.容器内气体密度恒定
B.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C.容器的压强恒定
D.3v正(CH4)= v逆(H2)
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有
A.升高温度 B.缩小容器体积 C.再充入CH4气体 D.使用合适的催化剂
您最近一年使用:0次
2019-01-02更新
|
150次组卷
|
2卷引用:福建省漳平市第一中学2018-2019学年高二上学期第二次月考化学试题
名校
10 . 下列说法正确的是()
| A.“煮豆燃豆萁,豆在釜中泣”诗中涉及的能量变化主要是化学能转化为热能和光能 |
| B.已知4P(红磷,s)= P4(白磷,s)△H=+17 kJ/mol,则白磷比红磷更稳定 |
| C.同温同压下,H2(g)+Cl2(g) = 2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.已知H+(aq) + OH-(aq) = H2O(aq) △H= —57.3kJ/mol ,则1molH2SO4与1mol Ba(OH)2的反应热△H=2×(—57.3) kJ/mol |
您最近一年使用:0次
2018-11-27更新
|
216次组卷
|
3卷引用:福建省龙岩市连城县第一中学2019-2020学年高二上学期第一次月考化学试题2



