名校
解题方法
1 . 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下方法来合成甲醇:
(1)用CO2生产甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJ•mol﹣1;
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJ•mol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:____________________ 。
(2)用CO生产甲醇。
已知:CO(g)+2H2(g) ⇌CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。
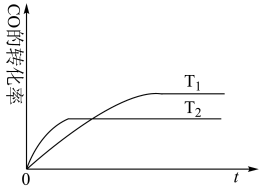
①该反应的焓变ΔH__________ 0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______ K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________ 。
(3)甲醇(CH3OH)可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是________________________ ,正极发生的电极反应式是_______________________ 。
(1)用CO2生产甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJ•mol﹣1;
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJ•mol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
(2)用CO生产甲醇。
已知:CO(g)+2H2(g) ⇌CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH
②T1和T2温度下的平衡常数大小关系是K1
③若容器容积不变,下列措施可增加甲醇产率的是
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.使用合适的催化剂 | D.充入He,使体系总压强增大 |
您最近一年使用:0次
2018-11-15更新
|
126次组卷
|
2卷引用:【校级联考】福建省长汀、连城一中等六校2018-2019学年高二年上学期期中考联考化学试题
名校
2 . 已知25℃、101kPa条件下:4Al (s) + 3O2 (g) = 2Al2O3 (s) △H = -2800 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H = -3100kJ/mol。
由此得出的结论正确的是
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H = -3100kJ/mol。
由此得出的结论正确的是
| A.O2比O3稳定,由O2变O3 为放热反应 |
| B.O3比O2稳定,由O2变O3 为吸热反应 |
| C.等质量的O2与O3分别与足量的可燃物充分反应,后者释放的能量更多 |
| D.将O2转化为O3的过程是物理变化 |
您最近一年使用:0次
2018-11-15更新
|
742次组卷
|
3卷引用:【校级联考】福建省长汀、连城一中等六校2018-2019学年高二年上学期期中考联考化学试题
名校
3 . 下列有关能量的说法不正确的是
| A.化学能可以转变成为热能、电能等 |
| B.应用盖斯定律,可计算某些难以用实验直接测量的反应焓变 |
| C.化学反应中的能量变化主要是由化学键的变化引起的 |
| D.酸碱中和反应放出的能量可设计为原电池转化为电能 |
您最近一年使用:0次
名校
4 . 工业上以氧化铝为原料可制得一些物质。
(1)碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)==4Al(g)+3O2(g) △H1=+3351KJ•mol﹣1
2C(s)+O2(g)==2CO(g) △H2=-221KJ•mol﹣1
2Al(g)+N2(g)==2AlN(s) △H3=-318KJ•mol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是________________________________________________ ,
(2)电解法可制取铝。以石墨作电极电解熔融 Al2O3(加入Na3AlF6为助熔剂)
①电解时铝在_____________ 产生(填阴极或阳极)
②电解过程中作阳极的石墨易消耗,原因是________________________ 。
(3)二氧化碳甲烷化再利用
①已知反应:CO2(g)+4H2(g) CH4(g)+2H2O(g)写出该反应的平衡常数表达式
CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
②据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是_________________ 。
(1)碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)==4Al(g)+3O2(g) △H1=+3351KJ•mol﹣1
2C(s)+O2(g)==2CO(g) △H2=-221KJ•mol﹣1
2Al(g)+N2(g)==2AlN(s) △H3=-318KJ•mol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是
(2)电解法可制取铝。以石墨作电极电解熔融 Al2O3(加入Na3AlF6为助熔剂)
①电解时铝在
②电解过程中作阳极的石墨易消耗,原因是
(3)二氧化碳甲烷化再利用
①已知反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)写出该反应的平衡常数表达式
CH4(g)+2H2O(g)写出该反应的平衡常数表达式②据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是
您最近一年使用:0次
5 . 常温下,已知:铝热反应放热,①4Al(s)+3O2(g)=2Al2O3(s) ∆H1②4Fe(s)+3O2(g)=2Fe2O3(s) ∆H2 下面关于 ∆H1、∆H2 的比较正确的是
| A.∆H1<∆H2 | B.∆H1=∆H2 | C.∆H1>∆H2 | D.无法判断 |
您最近一年使用:0次
2017-12-30更新
|
327次组卷
|
9卷引用:2012-2013学年福建龙岩一中高二上第一学段模块考试化学试卷
(已下线)2012-2013学年福建龙岩一中高二上第一学段模块考试化学试卷(已下线)2014年高中化学人教版选修四第一章 化学反应与能量练习卷2015-2016学年重庆市杨家坪中学高二上学期第一次月考化学试卷2016-2017学年云南省曲靖一中高二上期中化学试卷江西省抚州市临川实验学校2017-2018学年高二上学期第一次月考化学试题河南省南阳市省示范性高中联谊学校2017-2018学年高二上学期第二次月考化学试题内蒙古翁牛特旗乌丹第二中学2019-2020学年高二上学期期中考试化学试题(已下线)2014届辽宁省实验中学分校高一下学期阶段性测试化学试卷 河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题
10-11高三上·福建泉州·期末
名校
6 . 已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)⇌4H2(g)+2CO(g) △H=+255.6kJ•mol-1
b.CH3CH2OH(g)+ O2(g)⇌3H2(g)+2CO(g) △H=+13.8kJ•mol-1
O2(g)⇌3H2(g)+2CO(g) △H=+13.8kJ•mol-1
则下列说法不正确的是( )
a.CH3CH2OH(g)+H2O(g)⇌4H2(g)+2CO(g) △H=+255.6kJ•mol-1
b.CH3CH2OH(g)+
 O2(g)⇌3H2(g)+2CO(g) △H=+13.8kJ•mol-1
O2(g)⇌3H2(g)+2CO(g) △H=+13.8kJ•mol-1则下列说法不正确的是( )
| A.降低温度,可提高b路线中乙醇的转化率 |
| B.从能量消耗的角度来看,b路线制氢更加有利 |
| C.乙醇可通过淀粉等生物原料发酵制得,属于可再生资源 |
| D.由a、b知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ•mol-1 |
您最近一年使用:0次
2016-12-09更新
|
1047次组卷
|
9卷引用:福建省连城县第一中学2019-2020学年高二下学期期中考试化学试题
福建省连城县第一中学2019-2020学年高二下学期期中考试化学试题2015-2016学年甘肃省会宁一中高二上期中(理)化学试卷广东省中山市第一中学2017-2018学年高二上学期第三次统测化学试题江西省上高县第二中学2017-2018学年高二上学期期末考试化学试题广东省中山市第一中学2018-2019学年高二上学期第一次段考化学试题(已下线)第06练 化学反应的调控-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)福建省泉州市四校2010届高三上学期期末联考(化学)(已下线)2013届甘肃省甘谷一中高三第五次检测化学试卷2016届福建省厦门第一中学高三上学期期中考试化学试卷
11-12高二·福建龙岩·阶段练习
解题方法
7 . 回答下列问题:
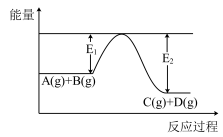
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H______ 0(填“>”、“<”或“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=CO (g)+ H2O (g) △H1= +34.0 kJ/mol
甲酸(g)= CO2(g)+ H2(g) △H2=-7.0 kJ/mol
则甲酸的分子式为___________ ,在该条件下,气态CO2和气态H2反应生成气态CO和气态H2O的热化学方程式为_______________ 。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

I若试管内液面上升,则正极反应:____________ 。
II若试管内液面下降,则发生___________ 腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在_______ (填“甲”或“乙”)溶液中腐蚀的速度快。
(1)反应A(g)+B(g)
 C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=CO (g)+ H2O (g) △H1= +34.0 kJ/mol
甲酸(g)= CO2(g)+ H2(g) △H2=-7.0 kJ/mol
则甲酸的分子式为
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

I若试管内液面上升,则正极反应:
II若试管内液面下降,则发生
III若溶液甲为水,溶液乙为海水,则铁钉在
您最近一年使用:0次
2011高二·福建龙岩·学业考试
解题方法
8 . (1) 2010年10月1日下午18时59分57秒,中国探月二期工程先导星“嫦娥二号”在西昌点火升空,准确入轨。“嫦娥二号”所用燃料为液氢和液氧。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
H2(g)=H2(l) △H=-0.92kJ·mol-1 ;
O2(g)=O2(l) △H=-6.84kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式_______ ;
(2)美国的探月飞船“阿波罗号”使用的氢氧燃料电池,电解液为氢氧化钾溶液,其负极反应式为_______ ;
(3)设计方案实现2HCl+2Cu= CuCl2+H2↑反应,画出装置图_______ ;
(4)pH相同的四种电解质溶液:①Na2CO3 ②NaHCO3 ③CH3COONa ④ NaOH,
其物质的量浓度由大到小的顺序是(填编号)_______ 。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
H2(g)=H2(l) △H=-0.92kJ·mol-1 ;
O2(g)=O2(l) △H=-6.84kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式
(2)美国的探月飞船“阿波罗号”使用的氢氧燃料电池,电解液为氢氧化钾溶液,其负极反应式为
(3)设计方案实现2HCl+2Cu= CuCl2+H2↑反应,画出装置图
(4)pH相同的四种电解质溶液:①Na2CO3 ②NaHCO3 ③CH3COONa ④ NaOH,
其物质的量浓度由大到小的顺序是(填编号)
您最近一年使用:0次
9-10高二下·福建龙岩·期末
解题方法
9 .
(1)在25℃、101KPa时,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则能表示甲醇燃烧的热化学方程式为:_______________________ 。
(2)已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g); △H=-394kJ/mol;
2CO(g)+O2(g)=2CO2(g); △H=-566kJ/mol;
2H2(g)+O2(g)=2H2O(g); △H=-484 kJ/mol;
①在25℃、101kPa时,1 g甲醇不完全燃烧生成1∶1的CO、CO2和液态水,写出此甲醇燃烧的热化学方程式:___________________________________ 。
②工业上可由CO和H2合成甲醇。试写出由C(s)与水蒸气在高温条件下反应生成氢气和一氧化碳的热化学方程式_______________________ 。
(3)利用甲醇可设计燃料电池。
①如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入甲醇和氧气。写出负极的电极反应式___________________ 。
②下列有关甲醇燃料电池的说法中,错误的是_________ 。
A.甲醇燃料电池的负极发生氧化反应
B.甲醇燃料电池的电子由负极、经外电路流入正极
C.甲醇燃料电池在负极区产生CO
D.甲醇燃料电池中使用的氢氧化钾浓度保持不变
(1)在25℃、101KPa时,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则能表示甲醇燃烧的热化学方程式为:
(2)已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g); △H=-394kJ/mol;
2CO(g)+O2(g)=2CO2(g); △H=-566kJ/mol;
2H2(g)+O2(g)=2H2O(g); △H=-484 kJ/mol;
①在25℃、101kPa时,1 g甲醇不完全燃烧生成1∶1的CO、CO2和液态水,写出此甲醇燃烧的热化学方程式:
②工业上可由CO和H2合成甲醇。试写出由C(s)与水蒸气在高温条件下反应生成氢气和一氧化碳的热化学方程式
(3)利用甲醇可设计燃料电池。
①如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入甲醇和氧气。写出负极的电极反应式
②下列有关甲醇燃料电池的说法中,错误的是
A.甲醇燃料电池的负极发生氧化反应
B.甲醇燃料电池的电子由负极、经外电路流入正极
C.甲醇燃料电池在负极区产生CO

D.甲醇燃料电池中使用的氢氧化钾浓度保持不变
您最近一年使用:0次
10 . 已知: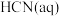 与
与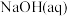 反应的
反应的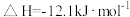 ;
;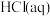 与
与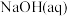 反应的
反应的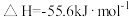 。则
。则 在水溶液中电离的
在水溶液中电离的 等于
等于
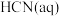 与
与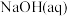 反应的
反应的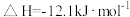 ;
;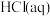 与
与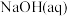 反应的
反应的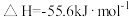 。则
。则 在水溶液中电离的
在水溶液中电离的 等于
等于A.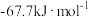 | B. |
C.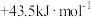 | D.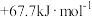 |
您最近一年使用:0次
2016-12-09更新
|
1957次组卷
|
72卷引用:福建省龙岩第一中学2021-2022学年高二上学期开学考试化学试题
福建省龙岩第一中学2021-2022学年高二上学期开学考试化学试题福建省龙岩第一中学2022-2023学年高二上学期第一次月考(普通班)化学试题(已下线)2010年长春外国语学校高二第一学期期末考试化学试卷(已下线)2011-2012学年湖北省荆州中学高二上学期期中考试化学试卷(已下线)2011—2012学年黑龙江哈九中度高二上学期期中考试化学试卷(已下线)2013-2014广东汕头市金山中学第一学期期末高二化学试卷(已下线)2014-2015学年甘肃省兰州一中高二上学期期中考试化学卷(已下线)2014秋湖北省武汉市部分重点中学高二上学期期中联考化学试卷2014-2015陕西省西安市庆安高级中学高二上学期期末化学试卷2014-2015陕西省西安市一中高二上学期期末化学试卷2014-2015陕西省西安市七十中高二上学期期末考试化学试卷2015-2016学年河北省行唐启明中学高二上学期第一次月考化学试卷2015-2016学年湖南省浏阳、攸县一中高二上期中联考化学试卷2015-2016学年江西省丰城中学高二上学期期中考试化学试卷2015-2016学年广西宾阳县宾阳中学高二5月月考化学试卷2016-2017学年青海师大附中高二上期中化学试卷河南省中原名校(即豫南九校)2017-2018学年高二上学期第一次联考化学试题河南省八市2017-2018学年高二上学期第一次质量检测化学试题山西省大同市第一中学2017-2018学年高二上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二上学期期中考试(A卷)化学试题四川省南充高级中学2017-2018学年高二12月月考化学试题安徽省淮北市第一中学2017-2018学年高二下学期第一次月考化学试题1山东省济南市历城第二中学2017-2018学年高二下学期开学考试化学试题人教版高二化学选修四专题:化学反应热的计算同步练习卷【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期10月月考化学试题【全国百强校】河南省信阳市高级中学2018-2019学年高二上学期10月月考化学试题2【校级联考】湖北省孝感市七校教学联盟2018-2019学年高二上学期期中联合考试化学试题河南省上蔡县第二高级中学2018-2019学年高二上学期期中考试化学试题福建省晋江市南侨中学2018-2019学年高二下学期第二次月考化学试题河北安平中学2018-2019学年高二下学期期末考试化学试题(已下线)2019年9月1日《每日一题》人教选修4—— 每周一测浙江省宁波诺丁汉大学附属中学2017-2018学年高二上学期期中考试化学试题云南省保山市第一中学2018-2019学年高二下学期期末化学试题福建省晋江市南侨中学2019-2020学年高二上学期第一阶段考试化学试题宁夏吴忠中学2019-2020学年高二上学期期中考试化学试题河北省沧州市泊头市第一中学2019-2020学年高二月考检测化学试题四川省雅安市2019-2020学年高二上学期期末检测化学试题河北省泊头市第一中学2019-2020学年高二上学期期末模拟考试化学试卷陕西省榆林市绥德县绥德中学2019-2020高二下学期第一次阶段性测试化学试题河南省驻马店市2018-2019学年高二上学期期末考试化学试题吉林省白城市洮南市第一中学2020-2021学年高二上学期第一次月考化学试题河北省保定市唐县第一中学2020-2021学年高二9月月考化学试题(已下线)【全国百强校】广西桂林市第十八中学2018-2019学年高二下学期期中段考化学试题陕西省汉中市洋县中学2018-2019学年高二上学期第一次月考化学试题河南省豫北名校2020-2021学年高二上学期11月质量检测化学试题甘肃省民勤县第一中学2020-2021学年高二下学期(理)开学考试化学试题江苏省南京市第十二中学2020-2021学年高二上学期第一次学情调研测试化学试题广西南宁市上林县中学2020-2021学年高二上学期期末考试化学试题江苏省海安市实验中学2021-2022学年高二上学期第一次月考化学试题广西浦北中学2021-2022学年高二上学期第一次月考化学试题(已下线)必考点01 化学反应的热效应-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)重庆市第七中学校2021-2022学年高二上学期期中考试化学试题山东省青岛第二中学2019-2020学年高二上学期期中考试化学试题四川省乐山沫若中学2022-2023学年高二上学期第二次月考(期中考试)化学试题天津市第二中学2022-2023学年高二上学期期中检测化学试题安徽省合肥市肥东县综合高中2022-2023学年高二上学期11月期中考试化学试题2010年普通高等学校招生全国统一考试理综化学部分(新课标全国I卷)2010年普通高等学校招生全国统一考试(课标Ⅰ卷)理综化学部分全解全析2010年普通高等学校招生全国统一考试(湖南卷)理综化学部分全解全析2010年高考化学试题分项专题七 化学反应中的能量变化(已下线)2012届贵州省遵义四中高三第一次月考理科综合试卷(化学部分)(已下线)2012届山东省济宁一中高三上学期第二次定时练习化学试卷(已下线)2011-2012学年吉林省长春市十一高中高一下学期期末考试化学试卷(已下线)2013-2014黑龙江省大庆铁人中学高一下学期期末考试化学试卷(已下线)2013-2014学年辽宁省抚顺市六校联合体高一下学期期末考试化学试卷(已下线)2015届安徽省黄山市徽州一中高三第一次月考化学试卷2016届河北省枣强中学高三上学期期中测试化学试卷高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第二课时(反应热的计算)2020届高三化学选修4二轮专题练——盖斯定律的应用【选择精编25题】2020届高三化学知识点强化训练—盖斯定律黑龙江省八校2022届高三上学期期中联合考试化学试题安徽省安庆二中2022-2023学年高一下学期5月月考化学试题



