名校
1 . (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。
反应的热化学方程式为___________________________________________ 。
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是___________ kJ。
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为___________________ 。
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:___________ 。
反应的热化学方程式为
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:
您最近一年使用:0次
2018-11-30更新
|
137次组卷
|
2卷引用:山西省晋中市平遥县第二中学2018-2019学年高二上学期期中考试化学试题
12-13高二上·湖北武汉·期中
2 . 已知下列热化学方程式
(1)C(s)+1/2O2(g)===CO(g) △H1=-110.5kJ/mol
(2)2H2(g)+O2(g)===2H2O(g) △H2=-483.6 kJ/mol
由此可知 C(s)+H2O(g) ===CO(g)+H2(g)ΔH3 ,则ΔH3等于
(1)C(s)+1/2O2(g)===CO(g) △H1=-110.5kJ/mol
(2)2H2(g)+O2(g)===2H2O(g) △H2=-483.6 kJ/mol
由此可知 C(s)+H2O(g) ===CO(g)+H2(g)ΔH3 ,则ΔH3等于
| A.+131.3 kJ/mol | B.+373.1 kJ/mol |
| C.-131.3 kJ/mol | D.-373.1 kJ/mol |
您最近一年使用:0次
2018-11-29更新
|
132次组卷
|
6卷引用:山西省吕梁市高级中学2018-2019学年高二上学期期中考试化学试题
山西省吕梁市高级中学2018-2019学年高二上学期期中考试化学试题(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2012-2013学年福建省三明一中高二第一次月考化学试卷2014-2015甘肃省白银市会宁县五中高二上学期期末化学试卷河北省石家庄市元氏县第四中学2020-2021学年高二上学期第一次月考化学试题贵州省安顺市平坝第一高级中学2020-2021学年高二上学期9月月考化学试题
名校
解题方法
3 . 科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=____________________
(2)利用氧化氮氧化物的流程如下:
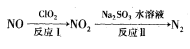
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_____ L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度_____ (填“增大”、“减小”或“不变”);请写出Na2SO3溶液中,c(Na+)、c(H2SO3)、c(SO32-)、c(HSO3-)的大小关系:_____ 。
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol•L﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入_____ ;为确保溶液中不出现浑浊,应调节溶液的pH不超过_____ 。(常温下,Ksp[Fe(OH) 2]=1.8×10﹣16)
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=
(2)利用氧化氮氧化物的流程如下:
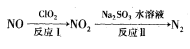
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol•L﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入
您最近一年使用:0次
9-10高二下·福建泉州·期中
名校
4 . 共价键的断裂有均裂和异裂两种方式,即均裂:A∶B → A·+B· ;异裂:A∶B → A++[∶B]-。下列化学反应中发生共价键均裂的是
| A.2K+2H2O=2KOH+H2↑ |
| B.2Na+2C2H5OH → 2C2H5ONa+H2↑ |
C.Na2CO3+H2O NaHCO3+NaOH NaHCO3+NaOH |
D.CH3COOH+C2H5OH 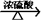 H2O+CH3COOC2H5 H2O+CH3COOC2H5 |
您最近一年使用:0次
2018-06-25更新
|
168次组卷
|
5卷引用:2010—2011学年山西省平遥中学高二下学期期中考试化学试卷
(已下线)2010—2011学年山西省平遥中学高二下学期期中考试化学试卷(已下线)2009—2010泉州七中学年度下学期高二年期中考试化学卷云南省石屏县一中2017-2018学年高二下学期六月份月考化学试题安徽省师范大学附属中学2019届高三上学期9月测试(二)化学试题云南省昭通市彝良县第一中学2018-2019学年高二上学期12月考试化学试题
名校
解题方法
5 . 肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g) =N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g) = N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
(1)写出肼和N2O4反应的热化学方程式______________ ;
(2)上述反应中氧化剂是______________ 。
(3)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4 (g)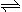 2NO2 (g)
2NO2 (g)
① 上述反应的ΔH_________ 0(选填“>”或“<”)。
② 保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,再次达到平衡时,混合气体中NO2的体积分数_______ (填“增大”、“ 减小”或“不变”),混合气体的颜色_______ (填“变深”或“变浅”)。
③一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是___________ 。
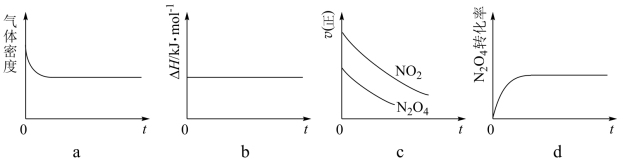
④若在相同温度下,上述反应改在体积为10L的恒容密闭容器中进行,反应3s后NO2的物质的量为0.6mol,则0-3s内的平均反应速率v(N2O4)=___________ mol·L-1·s-1。
①N2(g)+2O2(g) =N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g) = N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
(1)写出肼和N2O4反应的热化学方程式
(2)上述反应中氧化剂是
(3)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4 (g)
 2NO2 (g)
2NO2 (g)① 上述反应的ΔH
② 保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,再次达到平衡时,混合气体中NO2的体积分数
③一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是

④若在相同温度下,上述反应改在体积为10L的恒容密闭容器中进行,反应3s后NO2的物质的量为0.6mol,则0-3s内的平均反应速率v(N2O4)=
您最近一年使用:0次
名校
解题方法
6 . (1)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
①在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为__________________________ 。
②甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
a.CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
b. △H2
△H2
已知H2(g)+ O2(g)
O2(g)  H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
则反应②的△H2=_________ kJ·mol-1。
(2)工业上一般可采用下列反应来合成甲醇:CO(g)+2H2(g)⇌CH3OH(g),现实验室模拟该反应并进行分析,图1是该反应在不同温度下CO的转化率随时间变化的曲线。
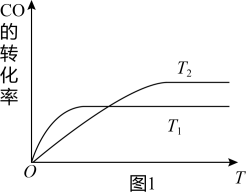

①该反应的焓变△H_____ 0(填“>”“<”或“=”).
②T1和T2温度下的平衡常数大小关系是K1_____ K2(填“>”“<”或“=”)
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,CO的平均反应速率v(CO)=_____ ,该反应的平衡常数为K=_____ 。
④恒容条件下,达到平衡后,下列措施中能使 增大的有
增大的有_____ 。
A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂.
①在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
②甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
a.CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
CO2(g)+3H2(g) △H1=+49.0kJ·mol—1b.
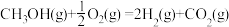 △H2
△H2已知H2(g)+
 O2(g)
O2(g)  H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1则反应②的△H2=
(2)工业上一般可采用下列反应来合成甲醇:CO(g)+2H2(g)⇌CH3OH(g),现实验室模拟该反应并进行分析,图1是该反应在不同温度下CO的转化率随时间变化的曲线。


①该反应的焓变△H
②T1和T2温度下的平衡常数大小关系是K1
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,CO的平均反应速率v(CO)=
④恒容条件下,达到平衡后,下列措施中能使
 增大的有
增大的有A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂.
您最近一年使用:0次
2017-12-05更新
|
236次组卷
|
3卷引用:山西省运城中学、芮城中学2017-2018学年高二上学期期中联考化学试题
名校
7 . 已知热化学方程式:2H2(g)+O2(g) =2H2O(l) ∆H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(l) ∆H= -1452 kJ·mol-1,H+(aq)+OH-(aq) =H2O(l) ∆H= -57.3 kJ·mol-1。据此判断下列说法正确的是
| A.CH3OH的燃烧热∆H为-1452 kJ·mol-1 |
| B.2H2(g)+O2(g) =2H2O(g) ∆H > -571.6 kJ·mol-1 |
| C.CH3COOH(aq)+NaOH(aq)=H2O(l)+CH3COONa(aq) ∆H= -57.3 kJ·mol-1 |
| D.2CH3OH(l)+O2(g)=2CO2(g)+4H2(g) ∆H= -880.4 kJ·mol-1 |
您最近一年使用:0次
2017-12-02更新
|
492次组卷
|
11卷引用:【全国百强校】山西省山西大学附属中学2018-2019学年高二上学期期中考试化学试题
【全国百强校】山西省山西大学附属中学2018-2019学年高二上学期期中考试化学试题2016届江西省赣州市十三县高三下期中理综化学试卷广东省广东实验中学2017-2018学年高二上学期期中考试化学试题河南省周口中英文学校2019-2020学年高二上学期期中考试化学试题安徽省滁州市定远县民族中学2019-2020学年高二上学期期中考试化学试题山西省晋中市平遥县第二中学2019-2020学年高二12月月考化学试题广东实验中学2022-2023学年高二上学期期中考试化学试题2016届广东省华南师大附中等四校高三上期末联考理综化学试卷安徽省滁州市定远县育才学校2019-2020学年高二(普通班)上学期第三次月考化学试题安徽省滁州市定远县育才学校2019-2020学年高二(实验班)上学期第三次月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——弱电解质的电离及影响因素(强化练习)
名校
8 . 羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+ H2O(g) H2S(g) +CO2(g) △H=-34 kJ·mol1
H2S(g) +CO2(g) △H=-34 kJ·mol1
氢解反应:COS(g) +H2(g) H2S(g)+CO(g) △H=+7 kJ·mol1。
H2S(g)+CO(g) △H=+7 kJ·mol1。
已知:2H2(g) +O2(g)=== 2H2O(g) △H=-484 kJ·mol1。
写出表示CO燃烧热的热化学方程式:______________ 。
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率______ (填“增大”“减小”或“不变”,下同),COS 的转化率_______ 。
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5 min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5 min 内,v(H2S)=_______ mol·L-1·min-1。
②该温度下,上述水解反应的平衡常数K=____________ 。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+ H2O(g)
 H2S(g) +CO2(g) △H=-34 kJ·mol1
H2S(g) +CO2(g) △H=-34 kJ·mol1氢解反应:COS(g) +H2(g)
 H2S(g)+CO(g) △H=+7 kJ·mol1。
H2S(g)+CO(g) △H=+7 kJ·mol1。已知:2H2(g) +O2(g)=== 2H2O(g) △H=-484 kJ·mol1。
写出表示CO燃烧热的热化学方程式:
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5 min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5 min 内,v(H2S)=
②该温度下,上述水解反应的平衡常数K=
您最近一年使用:0次
2017-11-19更新
|
315次组卷
|
5卷引用:山西省临汾一中、康杰中学、鄂尔多斯一中等五校2017-2018学年高二上学期期中联考化学试题
名校
解题方法
9 . A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C是地壳中含量最多的元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.
请回答:
(1)由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物的水溶液充分反应的化学方程式为____________ 。
(2)单质B与A2C在一定条件下发生反应,工业上用于制水煤气、利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH=-90.8 kJ·mol-1
CH3OH(g) ΔH=-90.8 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1
请写出由水煤气合成二甲醚的总反应的热化学方程式:__________ 。
(3)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式_____________ 。
请回答:
(1)由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物的水溶液充分反应的化学方程式为
(2)单质B与A2C在一定条件下发生反应,工业上用于制水煤气、利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)
 CH3OH(g) ΔH=-90.8 kJ·mol-1
CH3OH(g) ΔH=-90.8 kJ·mol-1 ②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1 请写出由水煤气合成二甲醚的总反应的热化学方程式:
(3)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式
您最近一年使用:0次
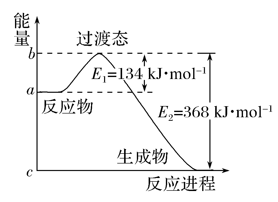
10 . (1)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1________ (填“增大”、“减小”或“不变”,下同),ΔH________ 。请写出NO2和CO反应的热化学方程式:________________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ· mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ· mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ· mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为________________________________________________________________ 。

(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ· mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ· mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ· mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为
您最近一年使用:0次
2017-08-19更新
|
155次组卷
|
3卷引用:山西省天镇县实验中学2021-2022学年高二上学期期中考试化学试题



