1 . 工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:

(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:____________ 。
当温度降低时,化学平衡常数K值________ (填“增大”、“减小”或“无影响”)。
(2)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是________ (填字母)。
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.0 mol,n(H2)=0.8 mol,n(NH3)=0.8 mol,则反应速率v(H2)=________ ,平衡常数=________ 。
③若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____ (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度____ (填“大于”、“小于”或“等于”)原来的2倍。

(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:
当温度降低时,化学平衡常数K值
(2)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2
 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。①下列各项标志着该反应达到化学平衡状态的是
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 |
| B.v正(N2)=v逆(H2) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
③若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将
您最近一年使用:0次
2016-12-09更新
|
545次组卷
|
2卷引用:2014-2015安徽省师范大学附属中学高二下学期期中考查化学试卷
2 . 运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;
(1)甲醇是重要的可再生燃料。已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ∆H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H=-556.0kJ/mol
H2O(g)=H2O(l) ∆H=-44.0kJ/mol
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_________ 。
(2)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤.
①一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生上述反应,能说明该反应已达到平衡状态的是________ 。
a.体系的密度不发生变化
b.体系中硫元素的质量百分含量不再变化
c.SO2与SO3的体积比保持不变
d.容器内的气体分子总数不再变化
e.单位时间内转移4 mol电子,同时消耗2molSO3
②T℃时,在1L密闭容器中充入0.6 molSO3,下图表示SO3物质的量随时间的变化曲线。达到平衡时,用SO2表示的化学反应速率为________ ;SO3的转化率为________ (保留小数点后-位):T℃时,反应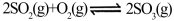 的平衡常数为
的平衡常数为_______ ;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________ (填字母)。
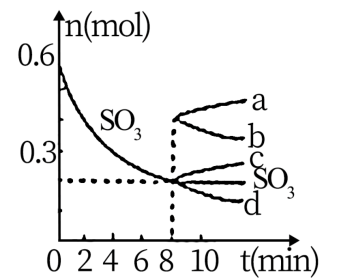
(3)有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。
电池正极的电极反应式是_____ 电解质溶液的pH______ (填写增大、减小、不变),A.物质是______ (写化学式)。
(1)甲醇是重要的可再生燃料。已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ∆H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H=-556.0kJ/mol
H2O(g)=H2O(l) ∆H=-44.0kJ/mol
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
(2)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤.
①一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生上述反应,能说明该反应已达到平衡状态的是
a.体系的密度不发生变化
b.体系中硫元素的质量百分含量不再变化
c.SO2与SO3的体积比保持不变
d.容器内的气体分子总数不再变化
e.单位时间内转移4 mol电子,同时消耗2molSO3
②T℃时,在1L密闭容器中充入0.6 molSO3,下图表示SO3物质的量随时间的变化曲线。达到平衡时,用SO2表示的化学反应速率为
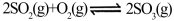 的平衡常数为
的平衡常数为
(3)有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。

电池正极的电极反应式是
您最近一年使用:0次
真题
解题方法
3 . 偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是___________ .
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)⇌2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为__________ (填“吸热”或“放热”)反应.
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是_________ .若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数______ (填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=_______ mol/(L•s)﹣1.
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是____________________ (用离子方程式表示).向该溶液滴加b L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_________ mol•L﹣1.(NH3•H2O的电离平衡常数取Kb=2×10﹣5 mol•L﹣1)

(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)⇌2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是

您最近一年使用:0次
2014·北京大兴·一模
解题方法
4 . 最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是_______
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
根据表中的数据判断该试样的酸碱性为_______ ,其pH=______ 。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式___________ 。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g) 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1
ⅱ 2C(s)+ O2(g) 2CO(g) △H =- 221.0 kJ·mol-1
2CO(g) △H =- 221.0 kJ·mol-1
ⅲ C(s)+ O2(g) CO2( g) △H =- 393.5 kJ·mol-1
CO2( g) △H =- 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数_________ 。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式_______________ 。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等

①写出反应Ⅰ的化学方程式:________________ 。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是___________ 。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是________________ 。
(1) 下列关于PM2.5说法正确的是
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中的数据判断该试样的酸碱性为
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)
 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1ⅱ 2C(s)+ O2(g)
 2CO(g) △H =- 221.0 kJ·mol-1
2CO(g) △H =- 221.0 kJ·mol-1ⅲ C(s)+ O2(g)
 CO2( g) △H =- 393.5 kJ·mol-1
CO2( g) △H =- 393.5 kJ·mol-1温度升高,反应ⅲ化学平衡常数
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等

①写出反应Ⅰ的化学方程式:
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是
您最近一年使用:0次
2014·山东枣庄·二模
解题方法
5 . 大气中的部分碘源于 对海水中
对海水中 的氧化。将
的氧化。将 持续通入
持续通入 溶液中进行模拟研究。
溶液中进行模拟研究。

(1) 将
将 氧化成
氧化成 的过程由3步反应组成:
的过程由3步反应组成:
①
②
③
总反应的化学方程式为____________ ,
其反应热
________ 。
(2)在溶液中存在化学平衡: ,其平衡常数表达式为
,其平衡常数表达式为________ 。
(3)为探究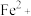 对
对 氧化
氧化 反应的影响(反应体系如上图),某研究小组测定两组实验中
反应的影响(反应体系如上图),某研究小组测定两组实验中 浓度和体系
浓度和体系 ,结果见图和表。
,结果见图和表。

①第1组实验中,导致反应后pH升高的原因是____________ 。
②图1中的A为________ 。由 生成A的过程能显著提高I-的转化率,原因是
生成A的过程能显著提高I-的转化率,原因是____________ 。
③第2组实验进行18 s后, 浓度下降。导致下降的直接原因有(双选)
浓度下降。导致下降的直接原因有(双选)________ 。
A. 减小 B.
减小 B. 减小
减小
C. 不断生成 D.
不断生成 D. 增加
增加
(4)据图2,计算3~18 s内第2组实验中生成 的平均反应速率
的平均反应速率____________ (写出计算过程,结果保留两位有效数字)。
 对海水中
对海水中 的氧化。将
的氧化。将 持续通入
持续通入 溶液中进行模拟研究。
溶液中进行模拟研究。
图1
(1)
 将
将 氧化成
氧化成 的过程由3步反应组成:
的过程由3步反应组成:①

②

③

总反应的化学方程式为
其反应热

(2)在溶液中存在化学平衡:
 ,其平衡常数表达式为
,其平衡常数表达式为(3)为探究
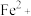 对
对 氧化
氧化 反应的影响(反应体系如上图),某研究小组测定两组实验中
反应的影响(反应体系如上图),某研究小组测定两组实验中 浓度和体系
浓度和体系 ,结果见图和表。
,结果见图和表。| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 |  | 5.2 | 11.0 |
| 第2组 |  | 5.2 | 4.1 |

图2
①第1组实验中,导致反应后pH升高的原因是
②图1中的A为
 生成A的过程能显著提高I-的转化率,原因是
生成A的过程能显著提高I-的转化率,原因是③第2组实验进行18 s后,
 浓度下降。导致下降的直接原因有(双选)
浓度下降。导致下降的直接原因有(双选)A.
 减小 B.
减小 B. 减小
减小C.
 不断生成 D.
不断生成 D. 增加
增加(4)据图2,计算3~18 s内第2组实验中生成
 的平均反应速率
的平均反应速率
您最近一年使用:0次
10-11高三·山东烟台·阶段练习
解题方法
6 . “低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101kPa时:C(s)+ O2(g)═CO(g)△H=-126.4kJ•mol-1
O2(g)═CO(g)△H=-126.4kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
H2O(g)═H2O(l)△H=-44kJ•mol-1
则在25℃、101kPa时:C(s)+H2O(g)═CO(g)+H2(g)△H=________ .
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
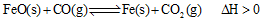 ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值______ (填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,则在这种情况下,该反应是否处于化学平衡状态?_______ (填“是”或“否”),其判断依据是________ 。
(3)目前工业上可用 来生产燃料甲醇,有关反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示;
来生产燃料甲醇,有关反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示;
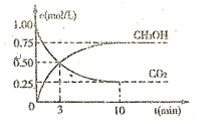
①从反应开始到平衡,氢气的平均反应速率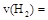
________ ;
②下列措施能使 增大的是
增大的是_____ (填符号)。
A.升高温度
B.再充入
C.再充入
D.将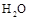 (g)从体系中分离
(g)从体系中分离
E.充入He(g),使体系压强增大
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101kPa时:C(s)+
 O2(g)═CO(g)△H=-126.4kJ•mol-1
O2(g)═CO(g)△H=-126.4kJ•mol-12H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
H2O(g)═H2O(l)△H=-44kJ•mol-1
则在25℃、101kPa时:C(s)+H2O(g)═CO(g)+H2(g)△H=
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
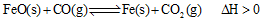 ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值
②1100℃时测得高炉中,c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,则在这种情况下,该反应是否处于化学平衡状态?
(3)目前工业上可用
 来生产燃料甲醇,有关反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示;
来生产燃料甲醇,有关反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示;
①从反应开始到平衡,氢气的平均反应速率
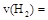
②下列措施能使
 增大的是
增大的是A.升高温度
B.再充入

C.再充入

D.将
 (g)从体系中分离
(g)从体系中分离E.充入He(g),使体系压强增大
您最近一年使用:0次
11-12高二上·山东临沂·期中
7 . 在某一容积为5 L的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g);反应中CO2的浓度随时间变化情况如图:

(1) 根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=______ mol/(L·min);该温度下的平衡常数K=______ 。
(2) 不能作为判断该反应达到平衡的依据是______ 。(填序号)
① CO、H2O、CO2、H2的浓度都相等
②正、逆反应速率都为零
③ CO、H2O、CO2、H2的浓度都不再发生变化
④混合气体的密度不再发生变化
(3) 如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=______ mol/L。
(4) 427℃时该反应的平衡常数为9.4,请结合(1)中的计算结果回答,如果升高温度该反应平衡向______ 方向移动。

(1) 根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=
(2) 不能作为判断该反应达到平衡的依据是
① CO、H2O、CO2、H2的浓度都相等
②正、逆反应速率都为零
③ CO、H2O、CO2、H2的浓度都不再发生变化
④混合气体的密度不再发生变化
(3) 如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=
(4) 427℃时该反应的平衡常数为9.4,请结合(1)中的计算结果回答,如果升高温度该反应平衡向
您最近一年使用:0次
10-11高三·湖北·阶段练习
解题方法
8 . T1℃时,向容积为2L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2> t1):
(1)用H2表示反应在t1min内的平均速率为v(H2)=_______ 。
(2)保持其他条件不变,若起始时向容器中充入1.50m olCO和1.00molH2O(g),达到平衡时,n(CO2)=________ 。
(3)保持其他条件不变,在t2时向容器中再通入0.50molCO,与原平衡相比,达到新平衡时CO转化率将_______ (填增大或减小,下同),H2O的体积分数将 ______ 。
(4)保持其他条件不变,若起始时向容器中充入amolCO和bmolH2O(g),达到平衡时,CO2的体积分数为24%,a、b的值须满足的条件是_______ 。
(5)温度升至T2℃,上述反应的平衡常数为0.64,则正反应的∆H____ 0(填>或<)。
| 反应时间/min | N(CO)/mol | H2O(g)/mol |
| 0 | 1.00 | 1.50 |
| t1 | 0.40 | |
| t2 | 0.90 |
(1)用H2表示反应在t1min内的平均速率为v(H2)=
(2)保持其他条件不变,若起始时向容器中充入1.50m olCO和1.00molH2O(g),达到平衡时,n(CO2)=
(3)保持其他条件不变,在t2时向容器中再通入0.50molCO,与原平衡相比,达到新平衡时CO转化率将
(4)保持其他条件不变,若起始时向容器中充入amolCO和bmolH2O(g),达到平衡时,CO2的体积分数为24%,a、b的值须满足的条件是
(5)温度升至T2℃,上述反应的平衡常数为0.64,则正反应的∆H
您最近一年使用:0次
11-12高二上·河北邢台·阶段练习
9 . 在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H=QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc=_______ mol/(L·min);实验2中采取的措施是_______ ;实验3中n3_______ 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q_______ 0(填“>、=、<”),理由是_______
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的_______ 。
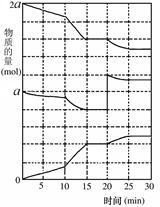
a.0~15 min可能是升高了温度
b.0~15 min可能是加入了催化剂
c.0 min时可能是缩小了容器体积
d.0 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的7/8。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的7/8。
①a、b、c必须满足的关系是_______ ,_______ 。(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是_______ 。
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
 实验序号 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 80℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 80℃ | n2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 80℃ | n3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 73℃ | 1.0 | 0.90 | 0.80 | 0.75 | 0.70 | 0.65 | 0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc=
②比较实验4和实验1,可推测该反应中Q
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的

a.0~15 min可能是升高了温度
b.0~15 min可能是加入了催化剂
c.0 min时可能是缩小了容器体积
d.0 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的7/8。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的7/8。
①a、b、c必须满足的关系是
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是
您最近一年使用:0次
2011·广东广州·模拟预测
10 . 碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1= —1214kJ/mol
②2CO(g)+O2(g)=2CO2(g);△H2= —566kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H= 。
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其正极电极反应式是: 。
②某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
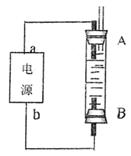
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
③若将所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)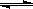 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
①实验1中,以v(H2)表示的平均反应速率为 。
②该反应的正反应为 (填“吸”或“放”)热反应。
(4)将2.4g碳(碳的相对原子质量为12)在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中的溶质的化学式是 ;溶液中所含离子的物质的量浓度由大到小的顺序为: 。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1= —1214kJ/mol
②2CO(g)+O2(g)=2CO2(g);△H2= —566kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H= 。
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其正极电极反应式是: 。
②某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)

A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
③若将所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)
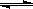 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | a | b | c | 1 |
①实验1中,以v(H2)表示的平均反应速率为 。
②该反应的正反应为 (填“吸”或“放”)热反应。
(4)将2.4g碳(碳的相对原子质量为12)在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中的溶质的化学式是 ;溶液中所含离子的物质的量浓度由大到小的顺序为: 。
您最近一年使用:0次



